MGMT基因甲基化状态在结直肠锯齿状病变中的表达及意义
许春伟 王鲁平 葛 畅
北京军区总医院病理科,北京100700
MGMT基因甲基化状态在结直肠锯齿状病变中的表达及意义
许春伟 王鲁平▲葛 畅
北京军区总医院病理科,北京100700
目的观察锯齿状病变组织中MGMT基因甲基化状态和MGMT蛋白表达,探讨临床病理意义和在癌变通路中的作用,同时探讨MGMT基因在不同年龄层段甲基化状况。方法应用Taqman探针qPCR(MethyLight)方法检测北京军区总医院2007~2013年的225例锯齿状病变[包括96例增生性息肉(HP)、61例广基(无蒂)锯齿状腺瘤/息肉(SSA/P)和68例传统型锯齿状腺瘤(TSA)]、54例管状腺瘤(TA)、69例结直肠癌(CRC)和42例正常结直肠黏膜组织中MGMT基因CpG岛甲基化状态,并通过测序法验证扩增的目的片段甲基化状态,同时应用免疫组化方法检测其中116例锯齿状病变(包括52例HP、41例SSA/P、23例TSA)、20例TA、24例CRC和24例正常结直肠黏膜组织中MGMT蛋白的表达情况。结果MGMT基因启动子甲基化状态和MGMT蛋白异常阳性程度在锯齿状病变和对照组中差异均有统计学意义(P<0.05),且两者之间呈负相关;MGMT基因启动子甲基化频率在不同年龄层段相关性比较中两者呈正相关,但差异无统计学意义(P>0.05)。结论组织中MGMT基因甲基化可能诱导其蛋白表达下调的主要原因,在结直肠“增生性息肉-锯齿状腺瘤-癌”的锯齿状癌变通路中起重要作用。
DNA甲基化;MGM T基因;qPCR;DNA探针;锯齿状病变
锯齿状病变是一组具有锯齿状(波浪状或星状)结构的异质性上皮病变,包括增生性息肉(hyperplastic polyp,HP)、广基(无蒂)锯齿状腺瘤/息肉(sessile serrated adenoma/polyp,SSA/P)、传统型锯齿状腺瘤(traditional serrated adenoma,TSA)。新近统计发现,结直肠癌(colorectal cancer,CRC)中60%的来自普通腺瘤,35%来自“增生性息肉-锯齿状腺瘤-癌”这条锯齿状通路[1],特别是锯齿状病变的CpG岛甲基化表型(CpG islandmethylator phenotyp,CIMP)。锯齿状通路涉及一系列异常的表观遗传学修饰[2]。这些异常修饰中以DNA甲基化最常见。DNA异常甲基化分为A型和C型,前者与年龄因素有关,年龄越大,甲基化频率越高,后者与肿瘤相关,通过引起相关基因表达下调或沉默,促进肿瘤的发生发展[3]。
MGMT为DNA损伤修复基因,定位于人类染色体10q26,全长170 kb,由5个外显子,4个内含子组成。启动子富含GC碱基,顺式作用元件有CpG岛中的6个Spl位点、2个糖皮质激素反应元件(GRE),AP-I元件等。cDNA长约769 bp,编码207个氨基酸组成的蛋白质。MGMT序列具有相对稳定性,从结肠杆菌到哺乳动物均含有结构一致的“-异亮氨酸-脯氨酸-半胱氨酸-组氨酸-精氨酸-缬氨酸-”(IPCHRV)活性基序列,活性位点在145位半胱氨酸残基上[4]。本研究通过MethyLight方法,一方面分析锯齿状病变中MGMT基因启动子区CpG岛甲基化状态和免疫组化中MGMT蛋白的表达情况,在基因层面和蛋白层面对MGMT进行初步探究,另一方面分析锯齿状病变中MGMT基因启动子区CpG岛甲基化状态和年龄相关因素情况,在甲基化和年龄上对MGMT进行初步探究。

表1 MGMT和内参基因的引物及探针序列
1 材料与方法
1.1 材料
1.1.1 标本收集北京军区总医院2007~2013年病理诊断为各类结直肠息肉和腺瘤切片4810例,从中筛选出腺体具有锯齿状特征的息肉及腺瘤,进行组织学诊断及分类。由3名病理医师按WHO(2010)消化系统肿瘤分类及文献标准[5-9]4~5轮回顾性阅片。从中筛选出225例锯齿状病变(96例HP、61例SSA/P和68例TSA)作为实验组,并以54例管状腺瘤(tubular adenoma,TA)、42例正常结直肠黏膜组织和69例CRC作为对照。
1.1.2 主要试剂和仪器DNA提取试剂盒购自德国QIAGEN公司,甲基化修饰试剂盒为美国ZYMO公司产品,核酸蛋白质浓度测量仪B-500购自上海创萌生物科技有限公司,甲基化阳性/阴性对照为美国ZYMO公司产品,qPCR反应试剂ROX购自TaKaRa公司,Mix购自上海辉睿生物科技有限公司,MGMT抗体购自中杉金桥公司(1∶500稀释),内参基因β-肌动蛋白(β-actin)引物和探针参照文献[10]设计,甲基化引物和探针由上海辉睿生物科技有限公司合成。Mx3000P定量PCR扩增仪为美国Stratagene公司产品。
1.2 方法
1.2.1 甲基化引物和探针设计MGMT基因序列参照GenBank(http://www.ncbi.nlm.nih.gov),GenBank Accession:NC_000010。甲基化引物和探针由Beacon Designer7.9软件设计,设计标准:引物扩增片段大小在80~150 bp范围,引物长度17~25 bp,GC含量在40%~70%,两条引物的Tm值尽量接近。避免引物内部或之间形成3 bp以上的互补序列。探针长度20~30 bp,探针的Tm值比引物高5~10℃,探针内标或探针与引物之间避免形成3 bp以上的互补序列,对其进行BLAST检查,引物和探针符合要求,并由上海辉睿生物科技有限公司合成。见表1。
1.2.2 DNA提取采用QIAamp DNA FFPE Tissue Kit试剂盒提取组织DNA,将含有DNA组织的蜡块连切5张10μm的厚蜡膜,严格按照试剂盒说明步骤进行操作。并测定其纯度和浓度备用。
1.2.3 甲基化修饰采用EZ DNA Methylation-GoldTM Kit(D5005)试剂盒,严格按照试剂盒说明步骤进行操作。经此步后,DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U)。
1.2.4 Methy Light PCR反应体系(20μL):2×Taq PCR Master Mix 10μL;修饰后的DNA模板2μL;上、下游引物各1μL(10 pmol);探针FAM 0.4μL(10 pmol);ROX 0.3μL。反应条件:94℃预变性5min;94℃30 s,56℃45 s,72℃45 s,共50个循环;72℃延伸5 min,4℃冷却5 min。每例标本设两个复孔,经亚硫酸氢盐修饰的Human Methylated&Non-methylated DNA Set作为阳性、阴性对照,水为空白对照。
1.2.5 测序法验证扩增序列PCR扩增产物送北京金唯智生物科技有限公司测序,由于扩增序列(94 bp)过小,连接到质粒作为载体后,用通用引物的方法测序,结果如图1所示,测序目的片段和Beacon Designer 7.9软件设计序列吻合。
图1 MGMT基因扩增片段部分测序图
1.2.6 免疫组织化学染色所有标本常规石蜡包埋,4μm厚连续切片,60℃温箱烘烤90min。采用EnVision二步法,实验过程严格按照试剂盒说明书进行,高温高压抗原修复,DAB显色,磷酸盐缓冲液(PBS)代替一抗为阴性对照,已知阳性的结肠腺体组织为阳性对照。
1.2.7 结果判断标准MethyLight结果判断标准[11]:同时扩增目的基因(MGMT)和内参基因(β-actin),根据标准曲线得到两者的原始拷贝数,计算标准甲基化指数(normalized index ofmethylation,NIM)其定义为:NIM= [(MGMT sample/MGMT positive)β-actin sample/βactin positive)]×100,其中MGMT sample指样本中甲基化MGMT基因的拷贝数,MGMT positive指阳性对照中甲基化MGMT基因的拷贝数,β-actin sample和β-actin positve与上述相同。NIM≥4为甲基化,NIM<4为非甲基化。免疫组化判断标准[12]:MGMT阳性定位于细胞核;标记指数计算方法:每张切片低倍镜下选择组织结构良好、比较清晰的5个阳性细胞最为密集的区域,每个区域在高倍镜下,计数100个细胞中的阳性细胞指数(不包括间质细胞和其他非肿瘤细胞),计算阳性细胞数平均值的百分率。标记指数计分:Ⅰ级10%~25%为1分,Ⅱ级>25%~50%为2分,Ⅲ级>50%~75%为3分,Ⅳ级>75%~100%为4分。染色强度计分:Ⅰ级淡黄色为1分,Ⅱ级棕黄色为2分,Ⅲ级棕褐色为3分。每张切片两种评分之乘积为该切片最后的表达强度:0分为(-),1~3分为(+),4~6分为(++),≥7分为(+++)。
1.3 统计学方法
所有数据采用SPSS 19.0统计软件,正态分布计量资料以均数±标准差(x±s)表示。甲基化结果运用χ2及Fisher确切概率法,免疫组化结果使用多组有序秩和检验,两组间比较运用Bonferroni检验,甲基化和蛋白表达相关性及甲基化和年龄相关性运用Pearson相关法进行统计学处理,以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料特征
225例锯齿状病变中HP 96例、SSA/P 61例、TSA 68例,分别占锯齿状病变的42.67%、27.11%和30.22%,96例HP中,男63例,女33例,男性多见,年龄31~88岁,平均(56.052±12.448)岁;61例SSA/P中,男43例,女18例,男性多见,年龄23~84岁,平均(56.665± 14.976)岁;68例TSA中,男46例,女22例,男性多见,年龄30~85岁,平均(59.470±12.506)岁。
2.2 MGMT基因标准曲线分析
将阳性对照按10的倍数稀释成1~1×10-67个浓度梯度制作标准曲线(其拷贝数为103~109/mL),各浓度梯度反应均做复孔。MethyLight的线性范围为104~108拷贝/mL,R2为0.942。
2.3 MGMT基因启动子CpG岛甲基化状态
MGMT基因启动子CpG岛甲基化阳性表达率在正常组、TA组、HP组、SSA/P组、TSA组和CRC组分别为0.00%(0/42)、46.30%(25/54)、26.04%(25/96)、60.66%(37/61)、76.47%(52/68)和68.12%(47/69),各组差异有高度统计学意义(χ2=112.790,P=0.000)。正常组与SSA/P、TSA、TA、CRC组之间差异有统计学意义(P<0.05),HP组与SSA/P、TSA、CRC组之间差异有统计学意义(P<0.05),其余各组差异无统计学意义(P>0.05)。见表2、图2(见封三)。
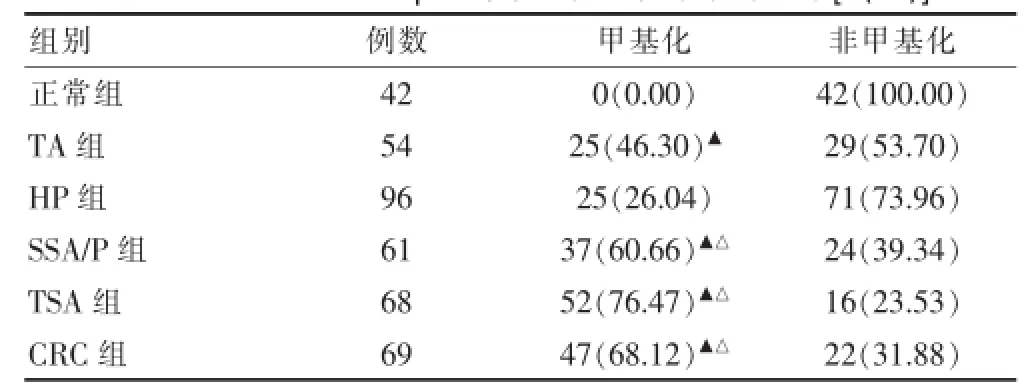
表2 MGMT基因CpG岛甲基化阳性率统计结果[n(%)]
2.4 MGMT蛋白阳性表达率
MGMT蛋白阳性表达率在正常组、TA组、HP组、SSA/P组、TSA组和CRC组分别为100.00%(24/24)、80.00%(16/20)、98.08%(51/52)、78.05%(32/41)、69.57%(16/23)和70.83%(17/24),差异有高度统计学意义(χ2=26.641,P=0.000)。正常组与HP、SSA/P、TSA、TA、CRC组之间差异有统计学意义(P<0.05),HP组与SSA/P组、TSA组、TA组和CRC组之间差异有统计学意义(P<0.05),其余各组差异无统计学意义(P>0.05)。见表3、图3。
2.5 MGMT基因甲基化与MGMT蛋白相关性分析
经统计学分析显示,TA、SSA/P、TSA、CRC三组中MGMT甲基化与MGMT蛋白表达结果差异有统计学意义(P<0.05),且相关性为负相关,相关系数分别为r=-0.500、-0.361、-0.437、-0.412;HP中MGMT甲基化与MGMT蛋白表达结果差异无统计学意义(P>0.05),但相关性为负相关,相关系数为r=-0.220。见表4。
2.6 MGMT基因甲基化与年龄相关性分析
经统计学分析显示,TA、HP、SSA/P、TSA四组中MGMT基因甲基化与年龄差异均无统计学意义(P>0.05)。MGMT基因甲基化与年龄相关性为正相关,与TA、HP、SSA/P、TSA相关系数分别为0.042、0.009、0.087、0.138。见表5。
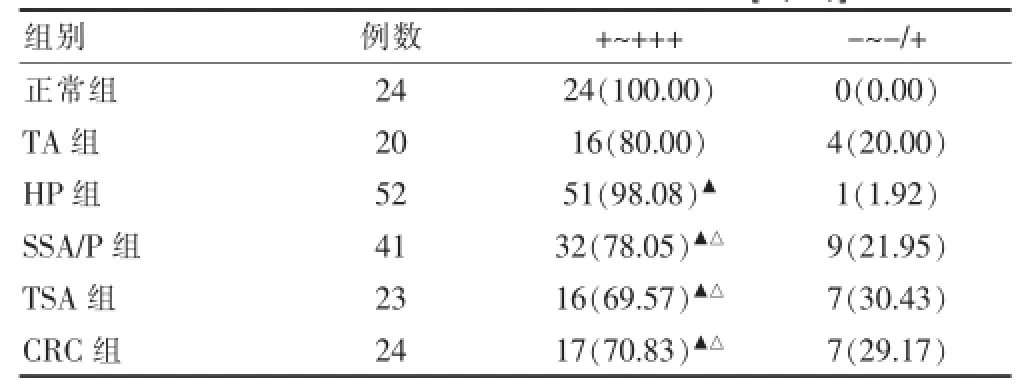
表3 MGMT蛋白表达阳性率统计结果[n(%)]

图3 锯齿状病变及CRC组织MGMT免疫组化结果
3 讨论
CRC是最常见的恶性消化道肿瘤之一,全球CRC每年新发病例数达123万,死亡约为发病率的1/2。近年研究表明,CRC发病率目前仍呈持续增长态势,其原因之一就是对结直肠锯齿状病变认识不足[2,13]。2010年WHO消化系统肿瘤病理学和遗传学分类中对锯齿状病变的分类比以往更为详细[9],HP在锯齿状病变中最常见,占所有病变的75%以上,根据组织学上的微小差别分为微泡性增生性息肉(microvesicular hyperplastic polyp,MVHP)、富于杯状细胞的增生性息肉(goblet-cell rich hyperplastic polyp,GCHP)、寡黏液型增生性息肉(mucin-poor type,MPHP)[14]。SSA/P占锯齿状病变的15%~25%,根据细胞异型性分为伴/不伴有细胞异性增生型[14-16]。TSA不常见占锯齿状病变的1%左右,特征为具有整体复杂结构域纤维状生长方式,常显示细胞异型特点,与TA及伴细胞异型的SSA不同[14,17]。TSA一般与高MSI癌无关,可能与低MSI有关[6]。近年来从分子遗传学角度对锯齿状病变进行研究发现,结直肠锯齿状病变通路是一个多因素、多阶段、多基因连续累积发生的过程,在此演变过程中有众多CRC相关基因参与。锯齿状通路分为:①无蒂(广基)锯齿通路:以SSA/P和MVHP为代表,癌变机制为BRAF突变,引起错配修复基因h-MLH-1甲基化和高水平CpG岛甲基化现象,导致腺体不同程度异型性增生直至癌变。②传统锯齿状通路:包括TSA和GCHP,癌变机制为K-RAS基因突变,引起DNA修复基因MGMT甲基化和低高水平CpG岛甲基化现象等。MGMT基因甲基化后,引起一些基因沉默,导致腺体异型性增加,进一步发展为癌。锯齿状通路中有众多异常基因甲基化,若能深入研究并加以利用,不仅可以用于CRC的早期诊断、高危人群的监测、癌变风险评估等,还可为CRC靶向治疗药物提供理论依据支持[1,18]。
在本实验基因层面研究中发现正常黏膜组织、TA、HP、SSA/P和TSA中均有MGMT基因启动子CpG岛甲基化,实验组锯齿状病变HP、SSA/P和TSA甲基化率为26.04%(25/96)、60.66%(37/61)和76.47%(52/ 68),对照组正常黏膜组织、TA和CRC的甲基化率为0.00%(0/42)、46.30%(25/54)和68.12%(47/69)。Dhir等[18]在18例TA中检测到甲基化率为47.1%,29例不伴异型性的SSA/P中检测到甲基化率为29.63%,19例伴有异型性的SSA/P中检测到甲基化率为52.63%,在9例HP中检测到甲基化率为14.29%,本研究中对照组的TA和实验组的SSA/P的甲基化率与以上研究结果基本符合,但实验组HP的甲基化率明显高于Dhir等[18]研究,这可能与样本量、样本来源、引物在CpG岛的位置不同等因素引起系统误差有关。本研究对照组与实验组组间比较过程中,对照组正常黏膜组织与实验组SSA/P(P=0.000)和TSA(P=0.000)有显著性差异,与实验组HP(P=0.230)差异性不显著;对照组CRC与实验组HP(P=0.000),与实验组SSA/P(P=0.375)和TSA(P=0.275)差异性不显著;对照组TA与实验组HP(P=0.012)和TSA(P=0.001)有显著性差异,与实验组SSA/P(P=0.123)差异性不显著;实验组组组间比较过程中,HP和SSA/P(P=0.000),HP和TSA(P=0.000)组间有显著性差异,SSA/P和TSA(P=0.053)组间差异性不显著。在本实验蛋白层面运用免疫组化方法研究中发现实验组HP、SSA/P和TSA蛋白表达阳性率为98.08%(51/52)、78.05%(32/41)和69.57%(16/23),对照组正常黏膜组织、TA和CRC中蛋白表达阳性率为100%(24/24)、80.00%(16/20)和70.83%(17/24)。与Sawyer等[19]对39例SA运用免疫组化方法发现MGMT阳性表达率为18%(7/39)相比,在本实验中,SSA/P蛋白阳性表达率[78.05%(32/41)]和TSA蛋白阳性表达率[69.57%(16/23)]明显高于Sawyer等[9]研究,具体原因可能与甲基化引物设计、样本来源、样本量大小等因素有关。本研究对照组与实验组组间比较过程中,对照组正常黏膜组织与实验组HP(P=0.001)、SSA/P(P=0.000)和TSA(P= 0.000)有显著性差异;对照组CRC与实验组HP(P= 0.001)有显著性差异,但SSA/P(P=0.515)和TSA(P= 1.000)差异性不显著;对照组TA与实验组HP(P= 0.029)有显著性差异,但与实验组SSA/P(P=1.000)和TSA(P=0.434)差异性均不显著;实验组与实验组组间比较过程中,HP和TSA(P=0.001),HP和SSA/P(P=0.006)中组间有显著性差异,但在SSA/P和TSA(P=0.452)中组间差异性均不显著。在本实验MGMT基因甲基化与蛋白表达相关性研究中,发现在实验组HP、SSA/P和TSA中分别呈弱相关(P=0.117,r=-0.220)、弱相关(P=0.020,r=-0.361)及中等程度相关(P=0.037,r=-0.437),对照组正常黏膜组织、TA和CRC中,正常黏膜组织运用Pearson法无法计算相关性,TA中呈中等程度相关(P=0.025,r=-0.500),CRC中呈中等程度相关(P=0.046,r=-0.412)。通过数据可以看出,在实验组中HP、SSA/P和TSA基因甲基化和蛋白表达有显著性差异,相关性分别为弱相关、弱相关和中等程度相关;在对照组中TA和CRC基因甲基化和蛋白表达有显著性差异,相关性都为中等程度相关。通过基因层面和蛋白层面及两者相关性的探究,推测在锯齿状病变通路中MGMT基因启动子甲基化有诱导MGMT蛋白表达下调,在锯齿状通路的发生发展中起重要作用。在年龄相关性甲基化研究方面,在基因目的序列(-107~-200)这部分的位点上实验组HP(P=0.931,r=0.009)、SSA/P(P= 0.763,r=0.042)和TSA(P=0.263,r=0.138)及对照组TA(P=0.763,r=0.042)中差异性均不显著(P>0.05),且相关性为弱正相关。
综上所述,MGMT基因启动子CpG岛甲基化可能导致MGMT蛋白表达下调,与锯齿状病变的发生、发展密切相关,在无蒂(广基)锯齿通路和传统锯齿状通路中起重要推动作用,是CRC发生重要的分子事件。
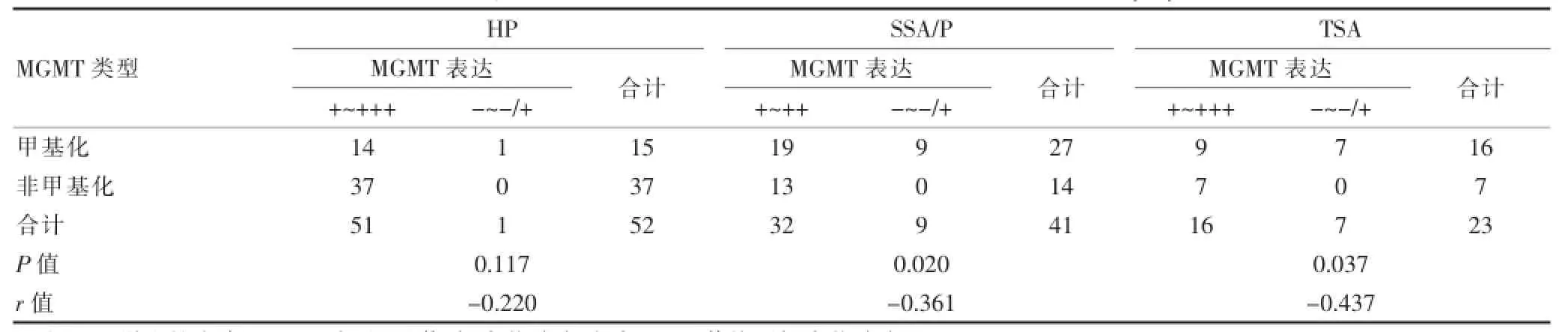
表4 HP、SSA/P和TSA组中MGMT蛋白表达与MGMT甲基化情况(例)
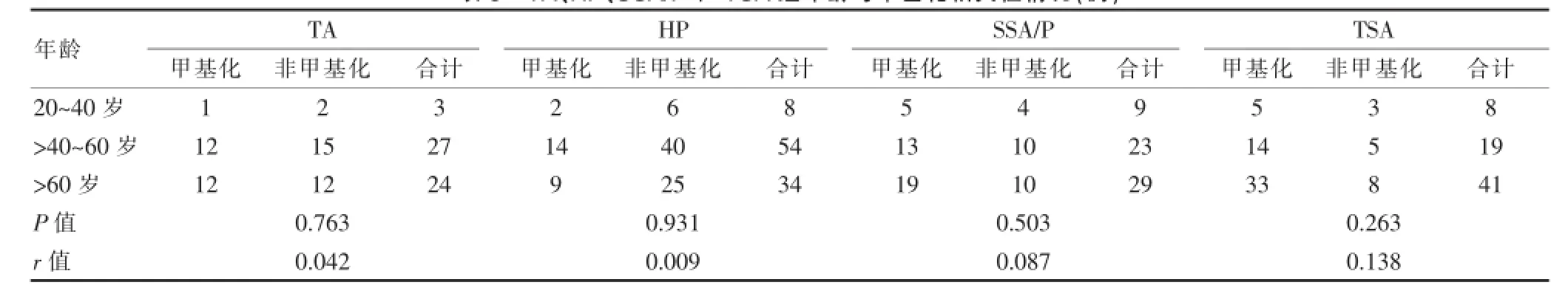
表5 TA、HP、SSA/P和TSA组年龄与甲基化相关性情况(例)
[1]Snover DC.Update on the serrated pathway to colorectal carcinoma[J].Hum Pathol,2011,42(1):1-10.
[2]Makinen MJ.Colorectal serrated adenocarcinoma[J].Histo pathology,2007,50(1):131-150.
[3]Jass JR,Whitehall VL,Young J,et al.Emerging concepts in colorectal neoplasia[J].Gastroenterology,2002,123(3):862-876.
[4]Harris LC,Potter PM,Tano K,et al.Characterization of the promoter region of the human O6-methylguanine-DNA methyltransferasegene[J].Nucleic AcidsRes,1991,19(22):6163-6167.
[5]Torlakovic EE,Gomez JD,Driman DK,et al.Sessile serrated adenoma(SSA)vs.traditional serrated adenoma(TSA)[J].Am JSurg Pathol,2008,32(1):21-29.
[6]East JE,Saunders BP,Jass JR.Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon:classification,molecular genetics,natural history,and clinicalmanagement[J].Gastroenterol Clin North Am,2008,37(1):25-46.
[7]王鲁平,陈健.与癌密切相关的结直肠广基锯齿状腺瘤(SSA)的概念及病理诊断要点[J].诊断病理学杂志,2008,15(2):84-87.
[8]王鲁平,杨光之,周志勇,等.结直肠锯齿状病变104例形态学及细胞增殖活性的观察[J].中华病理学杂志,2009,38(2):100-105.
[9]Hamilton SR,Bosman FT,Boffetta P.Carcinomaof the colon and rectum.WHO Classification of Tumors of the Digestive System.Pathology and Genetics Tumours and Digestive System[M]//4th edition,Switzerland:WHO press,2010:134-146,160-165.
[10]Ogino S,Kawasaki T,Brahmandam M,etal.Precision and performance characteristics of bisulfite conversion and real-time PCR(MethyLight)for quantitative DNA methylation analysis[J].JMol Diagn,2006,8(2):209-217.
[11]Eads CA,Lord RV,Kurumboor SK,et al.Fields of aberrant CpG island hypermethylation in Barrett's esophagus and associated adenocarcinoma[J].Cancer Res,2000,60(18):5021-5026.
[12]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,(4):229-231.
[13]赵娜,杨廷翰,郝晋,等.高风险结直肠癌患者快速流程模式的临床应用[J].中国现代普通外科进展,2011,14(4):269-272.
[14]Torlakovic E,Skovlund E,Snover DC,et al.Morphologic reappraisal of serrated colorectal polyps[J].Am JSurg Pathol,2003,27(1):65-81.
[15]Goldstein NS,Bhanot P,Odish E,et al.Hyperplastic-like colon polyps that preceded microsatellite-unstable adenocarcinomas[J].Am JClin Pathol,2003,119(6):778-796.
[16]Spring KJ,Zhao ZZ,Karamatic R,et al.High prevalence of sessile serrated adenomas with BRAF mutations:a prospective study of patients undergoing colonoscopy[J]. Gastroenterology,2006,131(5):1400-1407.
[17]Snover DC,Jass JR,Fenoglio-Preiser C,et al.Serrated polyps of the large intestine:amorphologic and molecular review of an evolving concept[J].Am JClin Pathol,2005,124(3):380-391.
[18]Dhir M,Yachida S,Neste L,et al.Sessile serrated adenomas and classical adenomas:an epigenetic perspective on premalignant neoplastic lesions of the gastrointestinal tract[J].Int JCancer,2011,129(8):1889-1898.
[19]Sawyer EJ,Cerar A,Hanby AM,et al.Molecular characteristics of serrated adenomas of the colorectum[J].Gut,2002,51(2):200-206.
Expression and significance of MGMT genemethylation status in colorectal serrated lesions
XU Chunwei WANG Luping▲GE Chang
Department of Pathology,the Military General Hospital of Beijing PLA,Beijing 100700,China
Ob jective To discuss patientswith serrated lesions tissues MGMT genemethylation status and MGMT protein expression and cancer pathways and the role and clinical significance of MGMT gene in different age paragraph methylation level.M ethods From 2007 to 2013 in the Military General Hospital of Beijing PLA,225 cases of serrated lesions[96 cases of hyperplastic polyp(HP),61 cases of sessile serrated adenoma/polyp(SSA/P)and 68 cases of traditional serrated adenoma(TSA)],54 cases of tubular adenoma(TA),69 cases of colorectal cancer(CRC)and 42 cases of normal colorectal mucosa tissues were selected;MGMT genemethylation status of CpG island was detected by qPCR applications Taqman probe(MethyLight)methods,methylation stateofamplification target fragmentwas verified by by sequencingmethod,at the same time,MGMT protein expression in 116 cases of serrated lesions(including 52 cases of HP,41 cases of SSA/P,23 cases of TSA),20 cases of TA,24 cases of CRC,24 cases of normal colorectalmucosa tissue was detected by immunohistochemicalmethod.Resu lts The differences of MGMT gene promotermethylation state and degree of abnormal MGMT protein positive degree in the serrated lesions and the control group were statistically significant(P<0.05),the negative correlation was found;the positive correlation was found between frequency ofMGMT gene promotermethylation and differentage paragraph,but the differencewas notstatistically significant(P>0.05).Conclusion Organization MGMT genemethylationmay induce the protein expression in themain reason for the downgrade, it plays an important role in serrated canceration pathway of hyperplastic polyps-serrated adenoma-carcinoma.
DNAmethylation;MGMT gene;qPCR;DNA probe;Serrated lesions
R735.3
A
1673-7210(2014)01(b)-0011-06
2013-11-14本文编辑:李继翔)
首都卫生发展科研专项基金资助项目(编号2011-5021-02)。
▲通讯作者

