Let-7a靶向抑制Ewing肉瘤中CDK6的表达
瞿岱彪,邵 斌,袁志峰,王 芳,余 佳,刘会文*
(1.景德镇市第一人民医院骨科,江西景德镇333000;2.中国医学科学院基础医学研究所北京协和医学院基础学院医学分子生物学国家重点实验室,北京100005)
MicroRNA(miRNA)是新近发现的在转录后水平起调控作用的一类非编码RNA 分子[1]。一般而言,miRNA 是通过调控其靶基因,并可与转录因子、表观遗传因子等共同调节各种复杂生命的活动。有研究表明:Let-7 直接调控除RAS 之外的多种细胞周期蛋白,并直接抑制肺癌细胞增殖通路[2],而在直肠癌细胞系中过表达Let-7a 后,明显抑制了肿瘤细胞的增殖[3]。说明Let-7 家族在肿瘤细胞恶性表型中起重要的调控作用。然而,越来越多的报道证实miRNA 在Ewing 肉瘤的发展中起重要的作用[4]。因此,探索Let-7a 在Ewing 肉瘤细胞系中的表达情况及其靶基因具有非常重要的意义,可为进一步实验提供基础。
1 材料与方法
1.1 试剂
寡核苷酸Let-7a 成熟体(Let-7a_mimic)及其对照(Scramble 和mimic_control)(上海吉码公司);Triol、细胞培养基(McCoy'5A)和胰蛋白酶(Trypsin-EDTA)(Invitrogen 公司);青霉素及链霉素、丙烯酰胺、过硫酸铵(AP)和SDS(Sigma 公司);转染试剂DharmaFECT 1(Thermo 公司);胎牛血清(HyClone公司);单克隆抗体CDK6(EPITOMICS 公司);限制性内切酶(Spe Ⅰ、Mlu Ⅰ和Kpn Ⅰ)(NEW ENGLAND 公司);Hybond-N 尼龙膜(Amersham 公司);PCR 反应体系hs primer start(Takara 公司);SK-ES-1 细胞系(美国模式菌种收集中心)。辣根过氧化物酶标记的山羊抗兔的二抗(北京中杉金桥生物技术有限公司);X 线片(柯达公司)。
1.2 细胞培养及分组
SK-ES-1 细胞培养条件为:37 ℃、5% CO2、饱和湿度环境下分别用含10% 胎牛血清的完全培养基McCoy'5A 培养。在转染前1 天,以合适浓度传代,使SK-ES-1 细胞在转染前处于对数增殖期。转染前1 h,用无血清无双抗的培养基将细胞重悬,按5 ×105/孔接种于6 孔板中,置37 ℃、5% CO2、饱和湿度环境下的培养箱中培养;将Let-7a-PC/CDK6_WT/CDK6_MUT 与Let-7a mimic/mimic control 和pRL-TK 用DharmaFECT 1 共转染SK-ES-1 细胞,具体步骤按照DharmaFECT 1 说明书进行。
SK-ES-1 细胞转染Let-7a scramble,mimic,mimic control,具体转染方法同上。
1.3 基因的构建
根据Genebank 中CDK6 野生型的部分基因序列设计引物进行扩增,上游引物引入Spe Ⅰ酶切位点(斜体加粗部分),下游引物引入Mlu Ⅰ酶切位点(斜体加粗部分),以人类基因组DNA 为模板进行PCR 扩增。按照分子克隆的具体步骤,与通过Spe Ⅰ和Mlu Ⅰ酶切的pMIR-Reporter 载体进行连接,构建成CDK6_WT 质粒。CDK6_MUT 是根据设计好的引物,以CDK6_WT DNA 为模板,采用20 μL反应体系进行35 个循环反应(98 ℃40 s,55 ℃40 s,72 ℃7 min),最后72 ℃延伸10 min 后收集产物进行电泳鉴定,并利用DNA 凝胶回收试剂盒进行纯化回收。CDK6_MUT 突变的引物长度包含有45个碱基对,其中含有Let-7a 结合的突变位点-acgga,上下游引物通过DNAssit 软件反向互补。最后采用限制性内切酶Kpn Ⅰ于37 ℃消化PCR 扩增的模板4 h 所得。
用于阳性对照质粒是根据Let-7a 成熟序列,设计含有Spe Ⅰ和Mlu Ⅰ酶切位点的碱基序列,通过自身互补、退火,并通过Spe Ⅰ和Mlu Ⅰ酶切位点构建到pMIR-Reporter 载体上。所有构建的载体均经DNA 测序证实。上述引物序列(表1)。
1.4 Northern blot
使用Trizol 提取不同Ewing 肉瘤细胞系和MSCs 的总RNA。使用去离子甲酰胺在55 ℃下进行30 min变性。每泳道30 μg 加入到15%聚丙烯酰胺凝胶进行电泳,后电转移到Hybond-N 尼龙膜,晾干后进行紫外胶联,最后置于-80 ℃下进行保存。合成与成熟miRNA Let-7a 序列互补的寡核苷酸并用做于探针,随后γ-32P-末端标记的miRNA探针加入到管中,并温育。在杂交之后,将膜按照标准程序洗涤,用滤纸吸干水滴后用保鲜膜封好,-80 ℃下进行放射自显影,U6 snRNA 用作内参。并以目的RNA/内参照的灰度值来表示结果。
1.5 Let-7a 的real time PCR
提取转染后的SK-ES-1 细胞,使用Trizol 提取细胞中的总RNA,具体操作按照Trizol 说明书进行。提取的总RNA 测定浓度后,使用反转录试剂盒进行cDNA 第一链的合成。所用特异性反转录引物:内参U6 RT 引物及Let-7a RT 引物参照表2,具体方法按照M-MLV 反转录试剂盒说明书进行。采用20 μL反应体系进行两步法扩增检测Let-7a的表达效率,相对定量值采用CT 计算[5],并以U6 snRNA 作为相对定量的内参,引物序列(表2)。
1.6 双荧光报告基因实验
通过Targetscan 靶基因预测网站,分析了Let-7a可能的靶基因,然后将预测的靶基因CDK-6 mRNA的3'UTR 区包含Let-7a 结合位点的序列以及突变了结合位点的序列插入到萤火虫荧光素酶报告载体pMIR-reporterTMLuciferase 的下游,得到质粒CDK6_WT 和CDK6-Mut,按照上述方法共转染SKES-1 细胞。转染48 h 后,检测萤火虫荧光素酶与海肾荧光素酶活力,海肾荧光素酶(PRL-TK)作为内参,测定萤火虫荧光素酶相对活性。此操作按照双荧光分析系统进行。
1.7 Western blot
收取转染好的细胞,提取总蛋白,采用BCA 法进行蛋白定量,每泳道加入30 μg 处理的蛋白样品进行SDS-PAGE 电泳,转移至PVDF 膜,室温下5%脱脂奶粉封闭2 h 后加入兔抗人一抗(anti-CDK6 1∶1 000),4 ℃孵育过夜,TBST 洗膜3 次,每次10 min,室温下加入HRP 标记的羊抗兔二抗(1∶5 000)孵育2 h。TBST 洗膜3 次,每次10 min后,暗室中显影,蒸馏水终止反应,GAPDH 为内参。并以目的蛋白/内参照的灰度值来表示结果。
1.8 统计学分析
2 结果
2.1 Let-7a 在Ewing 肉瘤细胞系中系低表达
与骨髓间充质细胞(MSCs)相比,在A673、RDES 和SK-ES-1 3 个细胞系中,Let-7a 的表达量明显降低(P<0.05)(图1)。

表1 分子克隆的引物序列Table 1 Primers sequence for cloning

表2 Real-time PCR 引物序列Table 2 Primer sequences for real-time PCR
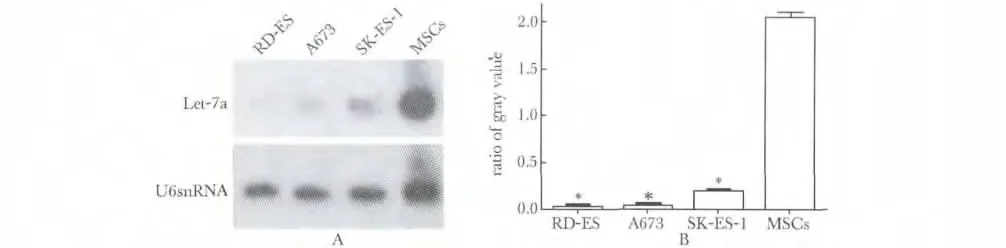
图1 在不同的细胞系中Let-7a 表达量变化Fig 1 Expression of Let-7a in different cell lines
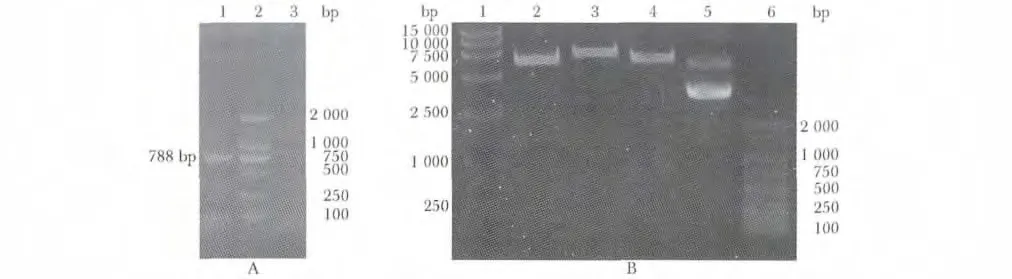
图2 质粒pMiR-report-CDK6 的构建与鉴定Fig 2 Identification of pMiR-report-CDK6
2.2 构建pMIR-reporter-CDK6 3'非编码区(3'UTR)野生型质粒
电泳显示在788 bp 处见一明显扩增条带(图2A);然后PCR 产物经Spe Ⅰ和Mlu Ⅰ双酶切后,电泳结果第4 泳道可见分别为6 440 bp 载体片段和788 bp 大小片段(图2B)。DNA 测序证实目的基因序列与GeneBank 中的序列完全一致。
2.3 在SK-ES-1 细胞系中过表达Let-7a
在SK-ES-1 细胞系中Let-7a 的表达水平显著升高(图3)。其中,瞬时转染效率达到了50%~60%(P<0.01)。
2.4 Let-7a 靶向抑制CDK-6 的表达

图3 SK-ES-1 细胞经过不同的处理后Let-7a相对表达量Fig 3 The relative expression of Let-7a in different treatment of SK-ES-1
通过序列分析,于CDK6 mRNA 的3'UTR 有Let-7a 结合位点(图4A);野生型CDK6(CDK6_WT)荧光素酶表达水平与对照组相比降低了约40%,(P<0.05)通过采取“突变”实验,突变型(CDK6_MUT)荧光素酶表达水平与对照组相比降低了约15%(图4B);在SK-ES-1 细胞中过表达Let-7a 后,抑制了CDK6 的蛋白的表达水平(图4C)。
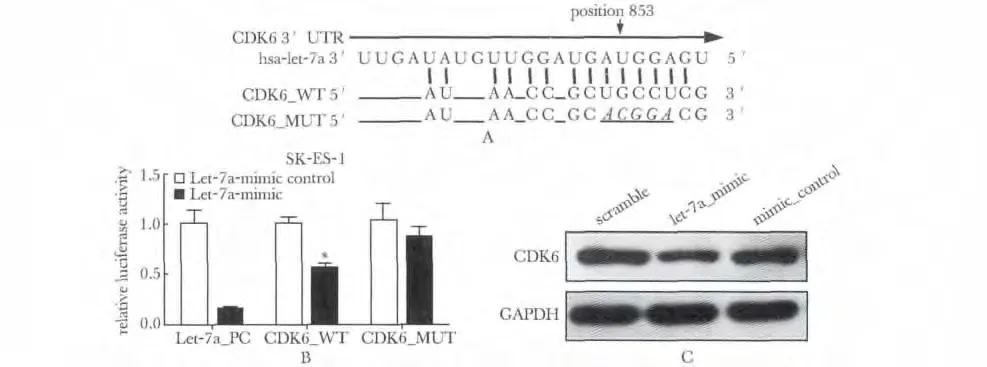
图4 Let-7a 靶向抑制CDK6 表达Fig 4 Identification of CDK6 as a direct target gene of Let-7a
3 讨论
越来越多的报道[6-7]miRNA 是在诸多的恶性肿瘤调控中起重要作用的一类非编码RNA 分子。上调或者下调miRNA 将会影响肿瘤血管生成和肿瘤的复发、转移。Let-7 家族作为一个抑癌miRNA 在许多恶性肿瘤中都是低表达的。该实验Northern blot 证实了与骨髓间充质细胞相比,Let-7a 在Ewing肉瘤中的表达量是明显下调的。在Ewing 肉瘤中,融合蛋白EWS-FLI-1 直接结合到Let-7a 启动子,抑制其转录活性,从而减少Let-7a 的表达,这是通过调节其靶基因HMGA2 而影响Ewing 肉瘤家族肿瘤的变化[8]。诸多报道证明CDK6 在恶性肿瘤和干细胞中是一种新兴的增殖和分化的调节器[9-10]。该实验以SK-ES-1 细胞作为Ewing 肉瘤的体外模型,寻找Let-7a 潜在的靶基因。通过生物信息预测网站(Target Scan,PicTar,miRanda)发现与迁移、侵袭、转移和增殖相关的基因超过1 000 个。Let-7a 作为抑癌miRNA 对Ewing 肉瘤最可能是通过调控CDK6而起作用的。CDK6 是细胞周期蛋白依赖性蛋白激酶家族的成员,在细胞周期的调控中起到非常重要的作用。细胞周期蛋白的表达顺序调控细胞周期的正常表达,并且细胞周期蛋白激活细胞周期蛋白依赖性激酶(CDK),其中一个丝氨酸/苏氨酸蛋白激酶家族的磷酸化是细胞周期进程所必需的靶蛋白[11]。有报道证实CDK6 不但在细胞增殖中起非常重要的作用,而且阻碍细胞的分化[12]。这与其他的细胞周期蛋白依赖性蛋白激酶不同,例如:CDK2和CDK4[13-14]。
本实验成功构建了野生型质粒(CDK6_WT)及其突变体(CDK6_MUT)和阳性对照质粒(Let-7a_PC),并经DNA 测序证实目的基因序列与DNA 序列数据库中的序列完全一致。经双荧光素酶报告实验显示与对照组荧光素酶表达水平相比,CDK6_WT 和CDK6_MUT 分别降低了约40%和15%,这表明Let-7a 与CDK6 3'UTR 存在结合位点。然后利用体外合成的寡核苷酸转染SK-ES-1 细胞系,通过RT-qPCR 检测成功过表达了Let-7a,瞬时转染效率达到了50% -60%。采取Western blot 结果显示抑制了CDK6 的蛋白的表达水平。因此,CDK6 是Let-7a 靶基因。
综上所述,本研究通过生物信息软件分析、双荧光素酶报告实验和Western blot 确定了抑癌microRNA(Let-7a)在Ewing 肉瘤细胞系中靶基因,其可能是通过调控细胞周期编码蛋白CDK6 在Ewing肉瘤的恶性表型中发挥重要作用。这就为后续研究CDK6 的功能和Let-7a 在Ewing 肉瘤发病机制中的信号通路奠定了基础。
[1]Yanokura M,Banno K,Kobayashi Y,et al.MicroRNA and endometrial cancer:Roles of small RNAs in human tumors and clinical applications (Review)[J].Oncol Lett,2010,1:935-940.
[2]Johnson CD,Esquela-Kerscher A,Stefani G,et al.The Let-7 MicroRNA Represses Cell Proliferation Pathways in Human Cells[J].Cancer Res,2007,67:7713-7722.
[3]Akao Y,Nakagawa Y,Naoe T.Let-7 MicroRNA Functions as a Potential Growth Suppressor in Human Colon Cancer Cells[J].Biol Pharm Bull,2006,29:903-906.
[4]Dylla L,Moore C,Jedlicka P.MicroRNAs in Ewing Sarcoma[J].Front Oncol,2013,3:65.
[5]Chen C,Ridzon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33:179-188.
[6]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers.nature,2005,435:834-838.
[7]Calin GA,Croce CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6:857-866.
[8]De Vito C,Riggi N,Suvà ML,et al.Let-7a Is a Direct EWS-FLI-1 Target Implicated in Ewing's Sarcoma Development[J].PLoS ONE,2011,6:e23592.
[9]Kohrt DM,Crary JI,Gocheva V,et al.Distinct subcellular distribution of cyclin dependent kinase 6[J].Cell Cycle,2009,8:2837-2843.
[10]Rivadeneira DB,Mayhew CN,Thangavel C,et al.Proliferative suppression by CDK4/6 inhibition:complex function of the retinoblastoma pathway in liver tissue and hepatoma cells.Gastroenterology[J].2010,138:1920-1930.
[11]Fu M,Wang C,Li Z,et al.Minireview:Cyclin D1:normal and abnormal functions[J].Endocrinology,2004,145:5439-5447.
[12]Grossel MJ,Hinds PW.Beyond the cell cycle:a new role for Cdk6 in differentiation[J].J Cell Biochem,2006,97:485-493.
[13]Pierson J,Hostager B,Fan R,Vibhakar R.Regulation of cyclin dependent kinase 6 by microRNA 124 in medulloblastoma[J].J Neurooncol,2008,90:1-7.
[14]Martha J.Grossel,Philip W.Hinds.From Cell Cycle to Differentiation:An Expanding Role for Cdk6[J].Cell Cycle,2006,5:266-270.

