新的金刚烷酰腙衍生物的微波合成及结构表征
黄美薇, 吴双, 刘亦飞, 赵志刚
(1. 西南民族大学化学与环境保护工程学院, 四川 成都 610041; 2. 西南民族大学电气信息工程学院, 四川 成都 610041)
新的金刚烷酰腙衍生物的微波合成及结构表征
黄美薇1, 吴双2, 刘亦飞1, 赵志刚1
(1. 西南民族大学化学与环境保护工程学院, 四川 成都 610041; 2. 西南民族大学电气信息工程学院, 四川 成都 610041)
以1-金刚烷甲酸为起始原料, 利用微波辐射无溶剂法, 设计合成了9个金刚烷酰腙衍生物, 并利用1H NMR、ESI-MS、 IR和元素分析对其结构进行了确认. 通过微波法和常规法的对比发现, 使用微波法后, 反应产率从70%~80%升高到90%~95% , 反应时间从2.0~3.5 h缩短到1.0~3.0 min.
金刚烷; 酰腙; 微波合成
金刚烷有十分稳定的笼状结构. 具有高度对称性, 良好的热稳定性、润滑性、亲油性和对光的稳定性. 其衍生物在医药[1]、功能高分子材料[2]等领域具有重要应用.酰腙类化合物在医药(如抗肿瘤[3-4]、抗病毒[5]、抗菌[6])、农药[7]、分析试剂[8]等方面有重要应用. 金刚烷酰腙类化合物具有金刚烷和酰腙的双重性能.
近几年来微波合成法受到人们的广泛关注, 微波合成法具有快速、高效、反应条件温和、环境友好等特点[9-10].本文采用微波辐射和传统实验的对照方法设计合成了一类新的金刚烷酰腙衍生物. 合成路线见图1.
1 实验部分
1.1 仪器与试剂
400 MHz核磁共振仪(Me4Si作内标,CDCl3作溶剂,瓦利安公司); FINNIGAN-LCQDECA型质谱仪(美国菲立根公司); IR-200 型红外光谱仪(KBr压片,美国利高丽公司); Vario Micro Cube 型元素分析仪(德国元素公司); WRS-1B型数字熔点仪; (上海申光仪器仪表有限公司); XH-100A商用微波炉反应器(北京祥鹄科技发展有限公司). 所用试剂均为分析纯. 中间体2、3参考文献[11]的方法合成.
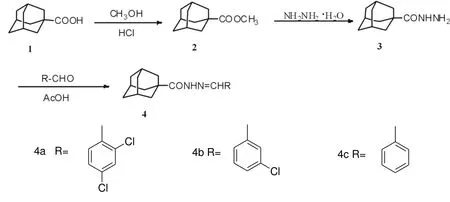
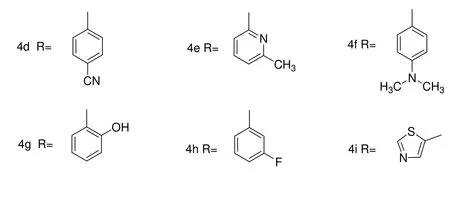
图1 目标物的合成路线Scheme 1 The synthetic route of target compounds
1.2 目标物4a~4i 的合成通法
微波合成: 将1.5 mmol中间体3, 1.6 mmol 芳香醛, 1滴醋酸, 0.8 g 中性Al2O3, 混合均匀, 置于专用合成微波炉中, 并外接干燥管,于400 W微波辐射下反应1.0~3.0 min(TLC监测反应进程), 反应结束后用CH2Cl2提取(10 mL×3), 减压蒸去溶剂后得粗品, 用无水乙醇-石油醚重结晶得到纯品, 产率为90%~ 95%.
常规合成: 将1.5 mmol中间体3溶于5ml 甲醇, 再依次加入1.6 mmol 芳香醛, 1滴醋酸, 回流反应2.0~3.5 h(TLC检测反应进程), 冷却, 减压蒸去溶剂后得粗品, 用无水乙醇-石油醚重结晶得纯品.
化合物4a: 白色晶体, 收率91%, m. p. 300~301℃,1H NMR (CDCl3, 400MHz) δ∶ 8.99 (s, 1H, CONH); δ∶ 8.54 (s, 1H, N=CH); δ∶ 8.05 (d, J = 8.4 Hz, 1H, ArH); δ∶ 7.35 (s, 1H, ArH); δ∶ 7.25(s, 1H, ArH); 2.07~1.70 (m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3166, 3029, 2900, 2850, 1652, 1588, 1541, 1472, 1867, 820. ESI-MS m/z (%): 725([2M+Na]+, 100). Ana1. Calcd.for C18H20Cl2N2O: C, 61.55; H, 5.74; N, 7.97. Found: C, 61.43; H, 5.77; N, 8.01.
化合物4b: 白色晶体, 收率91%, m. p. 252~253℃,1H NMR (CDCl3, 400MHz) δ: 8.91 (s, 1H, CONH); δ: 8.29 (s, 1H, N=CH); δ: 7.71 (s, 1H, ArH); δ: 7.58 (d, J = 7.8 Hz 1H, ArH); δ: 7.35~7.27 (m, 2H, ArH); 2.09~1.72 (m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3180, 3024, 2902, 2850, 1652, 1557, 1471, 1451, 812, 728. ESI-MS m/z (%): 600([2M+Na]+, 100). Ana1. Calcd. for C18H21ClN2O: C, 68.24; H, 6.68; N, 8.84. Found: C, 67.99; H, 6.65; N, 8.85.
化合物4c: 白色晶体, 收率95%, m. p. 221~222℃, 1H NMR (CDCl3, 400MHz) δ: 8.76 (s, 1H, CONH); δ: 8.12(s, 1H, N=CH); δ: 7.66~7.62 (m, 2H, ArH); δ:7.45~7.38 (m, 2H, ArH); 2.01~1.67(m, 15H, Adamantryl-H). IR (KBr), ν, cm-1: 3238, 3059, 2903, 2849, 1652, 1605, 1489, 755, 692. ESI-MS m/z (%):655([2M+Na]+, 100). C18H21ClN2O: C, 68.24; H, 6.68; N, 8.84. Found: C, 68.80; H, 6.71; N, 8.87.
化合物4d: 白色晶体, 收率92%, m. p. 259~260℃,1H NMR (CDCl3, 400MHz) δ: 8.90 (s, 1H, CONH); δ: 8.43 (s, 1H, N=CH); δ: 7.79 (d, J = 9.0 Hz, 2H, ArH); 7.66(d, J = 8.0Hz,2H,ArH); δ: 2.01~1.72 (m,15H, Adamantryl-H).IR (KBr), ν,cm-1: 3358, 2905, 2850, 2223, 1675, 1652, 1544, 1517, 1500, 829. ESI-MS m/z (%): 638 ([2M+Na]+, 100). Ana1. Calcd.for: C19H21N3O: C, 74.27; H, 6.89; N, 9.92. Found: C, 74.20; H, 6.92; N, 9.95.
化合物4e: 白色晶体, 收率90%, m. p. 250~251℃,1H NMR (CDCl3, 400MHz) δ: 8.89 (s, 1H, CONH); δ: 8.77 (s, 1H, N=CH); δ: 8.61~8.60 (m, 1H, ArH); δ: 8.40 (s, 1H, ArH); δ: 8.19 (d, J = 7.2 Hz, 1H, ArH); δ: 2.10(s, 3H, CH3); δ: 1.98~1.74 (m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3448, 3178, 2905, 1662, 1552, 1450, 810, 703.ESI-MS m/z(%): 645([2M+Na]+, 100). Ana1. Calcd. for C19H25N3O: C, 73.28; H, 8.09; N, 13.49. Found: C, 73.20; H, 8.12; N, 13.47.
化合物4f: 黄色晶体, 收率93%, m. p. 202~203℃,1H NMR (CDCl3, 400MHz) δ: 8.61 (s, 1H, CONH); δ: 8.07 (s, 1H, N=CH); δ: 7.60 (d, J = 8.8 Hz, 2H, ArH); δ: 6.68 (d, J = 8.8 Hz, 2H, ArH); δ: 3.00(s, 6H, CH3); δ: 2.07~1.71(m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3222, 2902, 2847, 1639, 1603, 1552, 1521, 813. ESI-MS m/z(%): 674([2M+Na]+, 100). Ana1. for Calcd. C17H21N3O: C, 73.81; H, 8.36; N, 12.91. Found: C, 73.66; H, 8.39; N, 12.88.
化合物4g: 白色晶体, 收率92%, m. p. 218~219℃,1H NMR (DMSO, 400MHz) δ: 10.73 (s, 1H, OH); δ: 9.59 (s, 1H, CONH); δ: 8.29 (s, 1H, N=CH); δ: 7.30~7.20(m, 1 H, ArH); δ: 7.12 (d, J = 7.6 Hz, 1H, ArH); δ: 7.02 (d, J = 7.6 Hz, 1H, ArH); δ: 6.81~6.78(m, 1H, ArH); δ: 2.09~1.60(m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3249, 3080,2849, 1652, 1578, 1538, 1452, 785. ESI-MS m/z(%): 620 ([2M+Na]+, 100). Ana1. Calcd. for C18H22N2O: C, 72.49; H, 7.43; N, 9.39. Found: C, 72.35; H, 7.40; N, 9.41.
化合物4h: 白色晶体, 收率92%, m. p. 225~226℃,1H NMR (CDCl3, 400MHz) δ∶ 8.71(s, 1H, CONH); δ∶ 8.34 (s, 1H, N=CH); δ∶ 7.48~7.44 (m, 2H, ArH); δ∶ 7.37~7.32(m, 1H, ArH); δ∶ 7.10~7.05 (m, 1H, ArH); δ∶ 2.10~1.72 (m, 15H, Adamantryl-H) . IR(KBr), ν, cm-1: 3181, 3019, 2901, 2852, 1651, 1490, 1449, 785, 685. ESI-MS m/z(%) :620([2M+ Na]+, 100). Ana1. Calcd. for C18H21FN2O: C,71.98; H,7.05; N, 9.33. Found: C, 71.87; H, 7.02; N, 9.31.
化合物4i: 黄色晶体, 收率94%, m. p. 292~293℃,1H NMR (CDCl3, 400MHz) δ: 9.06(s, 1H, CONH); δ: 8.71(s, 1H, N=CH); δ: 2.55(s, 3H, thiazole-H); δ: 2.04 (s, 3H, CH3); δ: 2.04~1.71(m, 15H, Adamantryl-H). IR(KBr), ν, cm-1: 3175, 2902, 2882, 2849, 1651, 1567, 953, 793. ESI-MS m/z(%): 630([2M+Na]+, 100). Ana1. Calcd.for C16H21N3OS: C, 63.33; H, 6.98; N, 13.85. Found: C, 63.20; H, 6.96; N, 13.83.
2 结果与讨论
2.1 目标物4a ~ 4i合成方法比较
微波干法与常规法合成目标化合物的实验结果见表1. 以中性Al2O3固体为载体, 在微波辐射无溶剂条件下,快速高效的合成了金刚烷酰腙类衍生物. 与传统加热合成方法相比, 微波辐射无溶剂法具有以下优势:
(1)反应产率从常规方法的70%~80%, 提升到90%~95%.
(2)反应时间从常规所需的2.0~3.5 h缩短到1.0~3.0 min, 反应速度增大70~130倍不等.
(3)避免大量有机溶剂在反应中的使用, 反应更加“绿色”.
因此微波无溶剂法是一种快捷、高效、绿色的合成金刚烷酰腙类衍生物的方法.
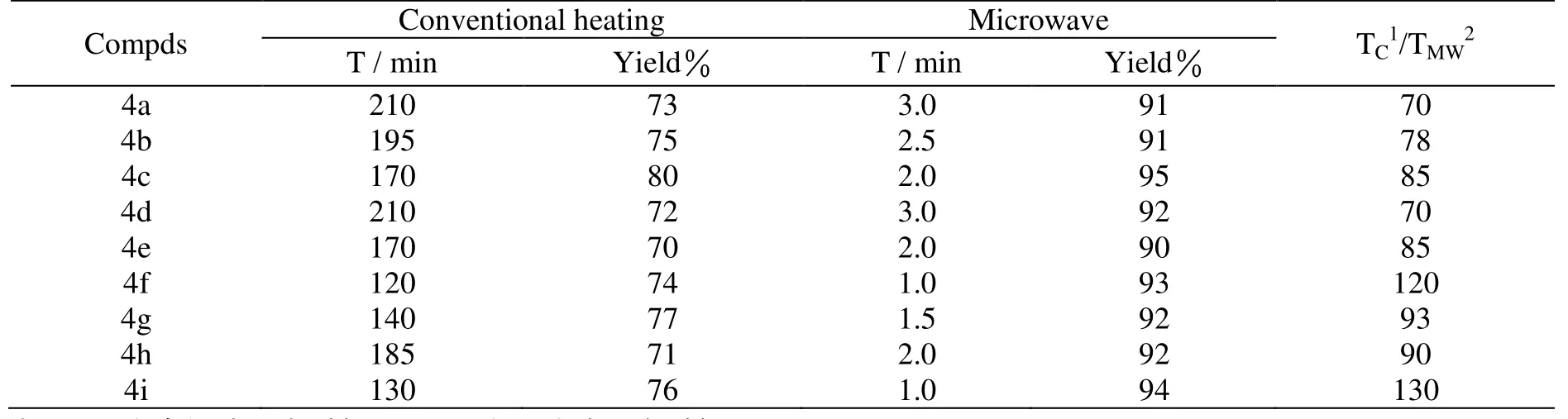
表1 微波法与常规法合成目标物4a ~ 4i的比较Tab. 1 Synthetic comparison between microwave irradiation and conventional heation of compounds 4a ~ 4i
2.2 目标物4a~4i的结构确认
在1H NMR谱图中, δ 8.61~9.59 ppm 的单峰属于酰腙结构中CONH的质子峰, δ 8.07~8.77 ppm 的单峰属于酰腙结构中N=CH的质子峰, δ 1.60~2.09 ppm的多重峰为金刚烷上的质子峰. 在IR谱图中在1650 cm-1附近出现强吸收带为酰腙羰基(C=O)的吸收峰. 从质谱图中可见, 所有的目标化合物均能给出分子离子峰, 其m/z与相应分子式的分子量是一致的. 元素分析结果表明, 所有化合物的组成与其实验式相符. 综上所述化合物4a~4i所有光谱和元素分析数据与其结构式相符合, 表明所有化合物均为目标化合物.
[1]BALZARINI J, ORZESZKO B, MAURI J K, ORZESZKO A, Synthesis and anti-HIV studies of 2-adamantyl-substituted thiazolidin-4-ones[J]. Eur J Med Chem, 2007, 42: 993-1003.
[2]刘卅, 郭建维.含金刚烷聚合物的研究进展[J]. 高分子材料科学与程, 2008, 24(7): 6-10.
[3]XING M, ZHAO T T, REN Y J, et al. Synthesis, biological evaluation, and molecular docking studies of pyrazolyl-acylhydrazone derivatives as novel anticancer agents[J]. Medicinal Chemistry Research, 2014, 23(7): 3274-3286.
[4]CONGIU C, ONNIS V. Synthesis and biological evaluation of novel derivateives as potential antitumor agents[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 21(21): 6592-6599.
[5]BURGESON J R, GHARAIBEH D N, MOORE A L, et al. Lead optimization of an acylhydrazone scaffold possessing antiviralactivity against Lassa virus[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(21): 5840-5843.
[6]HERNANDEZ P, ROJAS R, GILMAN R H, et al. Hybrid furoxanyl N-acy lhydrazone derivatives as hits for the development of neglected diseases drug candidates[J]. European Journal of Medicinal Chemistry, 2012, 59:64-74.
[7]黄明智, 黄可龙, 陈灿, 等. 2-甲硫基-1-苯基乙酮苯甲酰腙类化合物的合成和生物活性[J]. 农药学学报, 2004, 6(3) : 67- 70.
[8]任海仙, 唐静, 魏太保, 等. 酰腙类化合物的合成和阴离子识别研究[J]. 无机化学学报, 2007, 23(11) : 1907-1911.
[9]HOSSEIN NAEIMI, NASEIN ALISHAHI. An efficient and one-pot reductive cyclization for synthesis of 2-substituted benzimidazoles from o-nitroaniline under microwave conditions[J]. Journal of Industrial and Engineering Chemistry, 2014, 20: 2543-2547.
[10]DING CHEN, YINGZHE ZHANG, BIYU CHEN, et al. Coupling Effect of Microwave and Mechanical Forces during the Synthesis of Ferrite Nanoparticles by Microwave-Assisted Ball Milling[J]. Industral&Engineering Chemistry Research, 2013, 52: 14179-14184.
[11]陈义兴, 王艳玲, 李德江. 含4-噻唑啉酮环的新金刚烷类化合物的合成及抗癌活性研究[J]. 化学试剂, 2013, 35(7): 604- 606.
Microwave-assisted synthesis and structural characterization of novel adamantaneacylhydrazone derivatives
HUANG Mei-wei1, WU Shuang2, LIU Yi-fei1, ZHAO Zhi-gang1
(1. School of Chemistry and Environmental Protection Engineering, Southwest University for Nationalities,Chengdu 610041, P.R.C.; 2. School of Electrical and Information Engineering, Southwest University for Nationalities, Chengdu 610041, P. R.C.)
Nine novel adamantaneacylhydrazone derivatives were synthesized in the solvent-free condition under microwave irradiation by using 1-adamantanecarboxylic acid as starting material. Compared with a conventional method, the yield was increased from 70%~ 80% to 90%~95% and the reaction time was reduced from 2.0~ 3.5 h to 1.0~ 3.0 min. The structures of the new compounds are confirmed by1H NMR, ESI-MS spectra, IR and element analyses.
adamantane; acylhydrazone; microwave synthesis
O621.3
A
1003-4271(2014)05-0686-04
10.3969/j.issn.1003-4271.2014.05.09
2014-08-04
赵志刚(1963-), 男, 汉族, 四川合江人, 教授, 博士, 从事生物有机与微波化学研究.
四川省科技支撑计划项目(No. 2012SZ0160)
——以塔里木盆地塔中地区凝析油为例

