白藜芦醇对病理性瘢痕成纤维细胞及TGF-β1/Smads信号通路的影响
丁继存,翟晓翔,唐志铭
(1.南京中医药大学徐州附属医院皮肤科,江苏 徐州 221003;2.江苏省徐州市中医院皮肤科,江苏 徐州 221003)
病理性瘢痕是一种皮肤纤维化疾病,目前认为成纤维细胞凋亡受阻或过度增殖是其发生的主要病理学基础。转化生长因子β1(transforming growth factor-β1,TGF-β1) 是参与细胞生长、分化及凋亡的调控因子[1],Smads蛋白是其下游信号分子,能把TGF-β1介导的信号从细胞外传递到细胞核中。研究[2]表明,TGF-β1/Smads信号通路与细胞凋亡的发生有密切的关系。白藜芦醇(resveratrol,Res)是一种多酚类化合物,具多种生物学活性及药理作用。近几年来的研究[3-4]结果表明它能通过多种途径抑制细胞增殖,诱导凋亡,因此起到对抗增生性疾病的作用。本研究观察Res对病理性瘢痕成纤维细胞增殖、凋亡及TGF-β1/Smads信号通路的影响,旨在为Res应用于临床治疗病理性瘢痕提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂:Res(西安冠宇生物技术有限公司)、DMEM培养基及PBS(天津灏洋生物制品科技有限公司)、D-Hank液(北京华迈科生物技术有限责任公司)、0.25%胰蛋白酶-EDTA液(北京Solarbio公司)、胎牛血清(FBS,杭州四季青生物工程材料有限公司)、Trizol Reagent ( Invitrogen公司)、兔抗人TGF-β1、Smads单克隆抗体( Santa Cruz公司)、异硫氰酸荧光素(FITC)标记的山羊抗兔IgG二抗(BD Pharmingen公司)。
1.1.2 主要仪器:CO2培养箱(日本三洋)、高速离心机(长沙平凡仪器仪表有限公司)、JSM-6510型扫描电镜(日本电子)、自动酶标仪(美国BioTek仪器有限公司)、电泳仪(北京六一)、PCR 仪 (上海山富科学仪器有限公司)、Quantity-one凝胶成像分析系统(美国Bio-Rad公司)、荧光显微镜及数字CCD成像装置(日本奥林巴斯)、Image Pro-Plus图像分析系统(美国Media Cybernetics公司)。
1.1.3 标本来源:实验标本均来自2011年6月—2012年5月徐州市中医院皮肤科及烧伤整形科病理性瘢痕手术患者。标本的获取均征得患者的知情同意,并签订知情同意书。
1.2 方法
1.2.1 成纤维细胞分离、培养:无菌条件下切取人病理性瘢痕组织标本,用眼科剪仔细剔除上皮及皮下组织,D-Hank洗3遍,然后剪成1mm3大小的组织块,置于一无菌瓶中。无菌瓶中加入0.25%胰蛋白酶-EDTA溶液5mL,封口,摇匀,4℃冰箱冷消化14h;再置于37℃培养箱中孵育15min,若组织稀疏,边缘变毛,用200目筛网过滤,收集滤液,其余可以继续消化;将滤液离心,1 000r/min,7min,弃上清液;用10%FBS的DMEM液5mL混匀沉淀细胞,置于一个25ml的培养瓶中;在37℃、5%CO2饱和湿度的培养箱中静置培养48h后,用含10%FBS的DMEM换液,镜下观察细胞生长情况。细胞接近长满时,按1∶3比例进行传代。本实验选用第5代细胞。
1.2.2 扫描电镜观察病理性瘢痕成纤维细胞形态学变化:接种细胞在96孔培养板中分为对照组(A组)和3个药物浓度组,即B组(浓度10μmol/L)、C组(浓度50μmol/L)、D组(浓度100μmol/L),浓度筛选根据预实验中细胞半数抑制浓度1/3~2/3 范围时的Res浓度得出,每组24个培养孔。用含10%FBS的DMEM液将第5代成纤维细胞配成单个细胞悬液,以1.0×104/mL的密度接种于96孔培养板中,200μL/孔,置于CO2培养箱中常规培养。细胞贴壁后,吸去培养板孔内旧培养液,再每孔加入不含FBS的DMEM液180μL,然后3个实验组分别加入相应浓度的Res 20μL。对照组则加入含10%FBS的DMEM液20μL。标准环境下孵育24h 后,去除培养液,用温PBS 冲洗3 次以去除未贴壁细胞,然后用3%戊二醛固定1h后,用PBS洗3次,再用1%四氧化锇后固定2h,使用不同浓度的乙醇脱水,充分干燥,离子溅射镀膜仪镀金,最后在扫描电镜下观察细胞的形态变化。
1.2.3 四甲基偶氮唑蓝(four methyl thiazolyl tetrazolium,MTT)法检测病理性瘢痕成纤维细胞增殖状况:按前述方法分组及接种后,将Res用DMSO溶解为所需浓度,分别加入上述3个药物浓度组,每孔20μL,对照组每孔加入1%DMSO/DMEM20μL。药物干预24h,每孔加入5mg/mL MTT(用pH 7.4 PBS配制)20μL,37℃继续培养4h后,小心吸弃上清,每孔加入150μL DMSO,振荡10min,使甲臜结晶颗粒溶解为均匀的蓝紫色,以空白孔调零,在酶标仪波长490nm处测定各孔吸光度(OD)值。
1.2.4 反转录聚合酶链反应检测TGF-β1,Smad 2、3、4、7 mRNA的表达:细胞培养及干预方法如前。采用Trizol Reagent总RNA提取试剂盒进行总RNA提取,操作步骤按试剂盒说明书进行。电泳鉴定提取RNA的完整性。经测定,所有样本A260/A280均大于1.8,提示样本纯度较高,无明显蛋白污染。统一调整总RNA纯度为0.5g/L,于-70℃储存。
取6μL RNA为反转录模板。反转录反应体系为20μL,反应条件为37℃1h,95℃3min。标准曲线定量法制备cDNA模板标准品,依次10倍梯度稀释,制备成5个梯度的cDNA模板定量标准品。在GenBank数据库中获得目的基因mRNA序列,采用Primer express 2.0软件,在CDS区设计特异性引物。引物序列见表1。

表1 TGF-β1、Smads基因引物序列及扩增产物片段长度Table 1 TGF-β1,Smads gene primer sequences and amplification fragment length of the product
PCR反应体系为50μL,反应条件,93℃预变性3min,93℃变性30s,57℃退火30s,共循环30次,72℃延伸5min。取6μL PCR产物于1.5%琼脂糖凝胶中电泳,用Quantity-one凝胶成像分析系统分析各条带的灰度值,以各目的基因与内参基因β-actin的灰度值比值表示mRNA的相对表达量。
1.2.5 免疫荧光细胞化学染色法检测TGF-β1,Smad 2、3、4、7蛋白的表达:用上述方法培养病理性瘢痕成纤维细胞24h后,吸去培养液,加入4%多聚甲醛室温下固定30min,用PBS洗涤3次,0.1%Triton X-100 37℃孵育20min,PBS洗涤,非免疫山羊血清封闭1h,吸净血清后加入TGF-β1、Smads一抗(1∶100)4℃孵育过夜,次日PBS冲洗后,加入FITC标记的羊抗兔二抗(1∶200),37℃孵育60min,PBS冲洗,DAPI避光复染,10min后荧光显微镜下观察,用数字电荷耦合元件(charge-couple device,CD)成像装置采集图像,Image Pro-Plus图像分析系统进行图像分析,测定荧光强度。

2 结 果
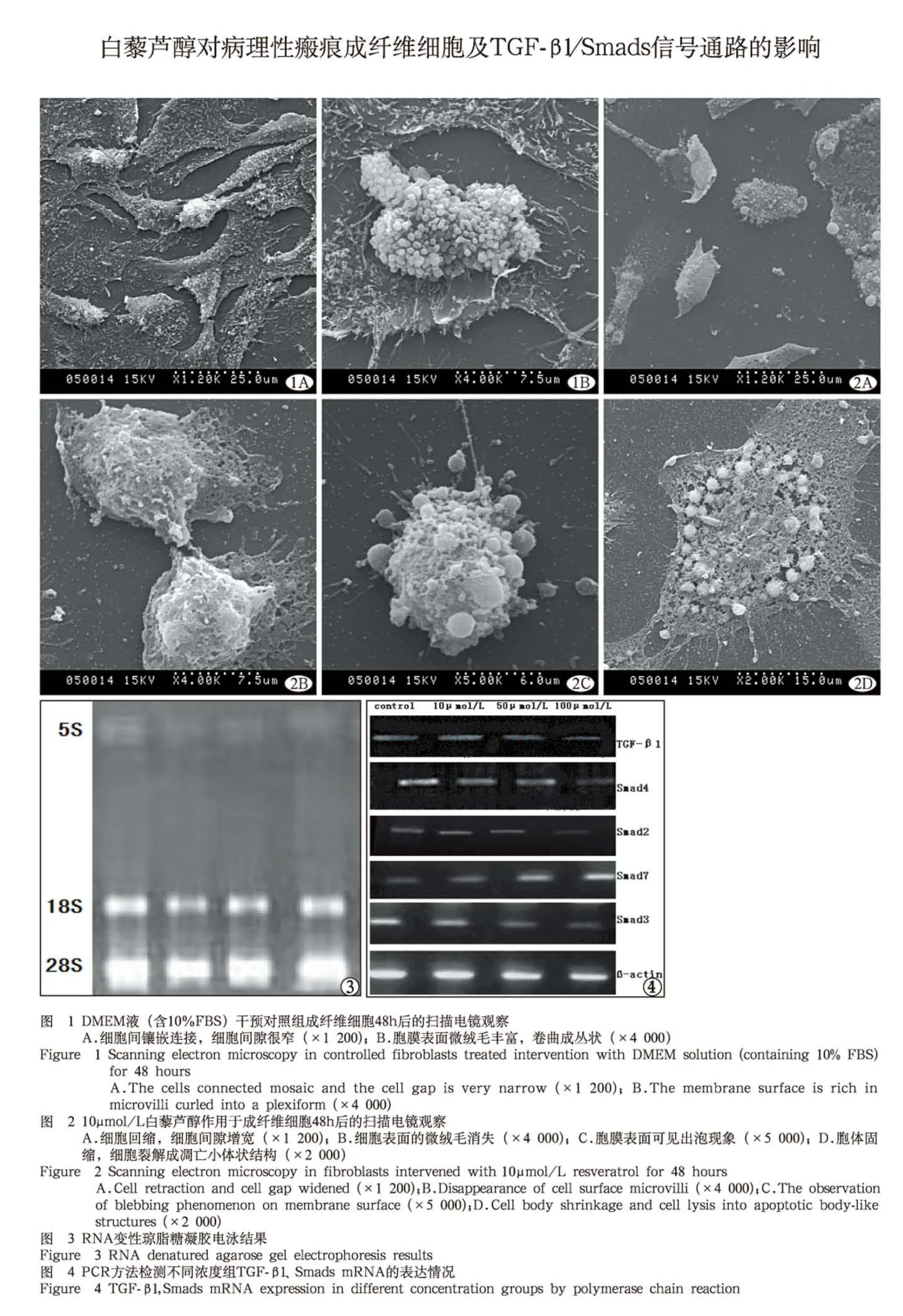
2.1 扫描电镜观察病理性瘢痕成纤维细胞形态学变化:对照组成纤维细胞铺展良好,细胞间镶嵌连接,相邻细胞的间隙很窄,胞膜完整,表面微绒毛丰富,卷曲成丛状,规则排列(图1A,1B)。用10μmol/L Res处理病理性瘢痕成纤维细胞48h后,细胞间隙增宽,细胞明显回缩,铺展面积减小(图2A),细胞表面的微绒毛逐渐消失(图2B),膜表面可见出泡现象(图2C),最后胞体固缩,细胞裂解成许多胞膜完整、大小不一的凋亡小体状结构(图2D)。在50μmol/L和100μmol/L Res作用下,细胞的变化与上述情况相似。
2.2 MTT法检测病理性瘢痕成纤维细胞增生状况:以不同浓度的Res处理病理性瘢痕成纤维细胞后,采用MIT法检测其增殖情况,结果显示,各不同药物浓度组与对照组相比,OD值均明显偏低,差异有统计学意义(P<0.05)。说明Res对病理性瘢痕成纤维细胞的增殖有显著抑制作用,并且这种抑制作用有剂量依赖性。见表2。
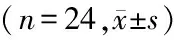

GroupsConcentrationsOD valueA-0.485±0.034 B10μmol/L0.324±0.017∗C50μmol/L0.267±0.014∗ D100μmol/L0.173±0.009∗
*P<0.05vsgroup A byqtest
2.3 RT-PCR检测各组TGF-β1、Smads mRNA的表达:提取的总RNA经紫外线分光光度仪测定其浓度及纯度,RNA 的A260/A280值为1.8~2.0,表明纯度良好。RNA变性琼脂糖凝胶电泳结果见图3。图中各电泳条带显示,28S和18S区带清晰集中,表明未被降解,RNA完整性好。
病理性瘢痕成纤维细胞经10、50、100μmol/L的Res干预后,其TGF-β1,Smad 2、3、4 mRNA的相对表达量降低,而Smad 7 mRNA 的相对表达量增加,与对照组相比,差异有统计学意义(P<0.05),见图4及表3。Pearson相关性分析表明,TGF-β1,Smad 2、3、4 mRNA的相对表达量与Res干预浓度呈负相关(r=-0.869,P=0.02;r=-0.749,P=0.03;r=-0.751,P=0.03;r=-0.695,P=0.04),Smad 7 mRNA的相对表达量与Res干预浓度呈正相关(r=0.882,P=0.02)。
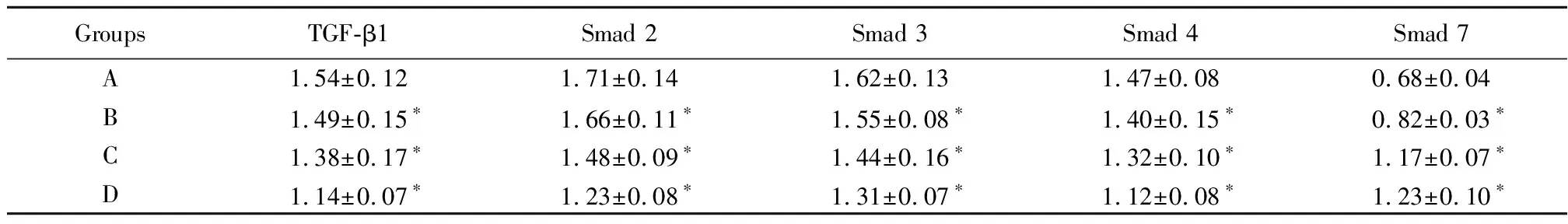
GroupsTGF-β1Smad 2Smad 3Smad 4Smad 7A1.54±0.121.71±0.141.62±0.131.47±0.080.68±0.04B1.49±0.15∗1.66±0.11∗1.55±0.08∗1.40±0.15∗0.82±0.03∗C1.38±0.17∗1.48±0.09∗1.44±0.16∗1.32±0.10∗1.17±0.07∗D1.14±0.07∗1.23±0.08∗1.31±0.07∗1.12±0.08∗1.23±0.10∗
*P<0.05vsgroup A byqtest
2.4 免疫荧光检测各组TGF-β1、Smads蛋白表达:Res各浓度组TGF-β1,Smad 2、3、4 荧光强度随着Res的干预浓度升高而降低,呈负相关(r=-0.921,P=0.02;r=-0.913,P=0.02;r=-0.843,P=0.03;r=-0.865,P=0.03),而Smad 7荧光强度随着Res的干预浓度升高而增强,呈正相关(r=0.854,P=0.03),与对照组相比,差异有统计学意义(P<0.05),见表4。
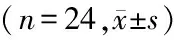

GroupsTGF-β1Smad 2Smad 3Smad 4Smad 7A36.23±3.2828.97±3.1134.35±2.9631.16±3.6523.09±2.78B32.43±2.54∗25.32±3.17∗30.45±2.84∗28.32±3.06∗29.11±3.19∗C27.13±3.19∗21.14±2.88∗26.95±3.12∗25.18±3.23∗35.52±3.62∗D21.47±2.77∗17.37±3.04∗21.86±2.42∗20.37±2.95∗38.83±3.51∗
*P<0.05vsgroup A byqtest
3 讨 论
病理性瘢痕包括增生性瘢痕和瘢痕疙瘩,以真皮成纤维细胞增殖并产生过量的胞外基质(Ⅰ、Ⅲ型胶原,黏蛋白和黏多糖等)为特点[5],是一种皮肤结缔组织增生性疾病。本病常发生在烧伤、外科手术及外伤后,不仅影响美观,甚至可以引起严重的功能障碍。目前病理性瘢痕的治疗方法较多,但因其发病机制仍不清楚,故治疗没有取得突破性进展[6]。因此,通过更深入的揭示病理性瘢痕的发病机制,并寻找一种新的有效的防治病理性瘢痕的天然药物是皮肤外科领域的一项重要课题。
Res是一种含有芪类结构的非黄酮类多酚化合物,是植物在受到真菌感染、紫外线照射或病理状况下产生的植物防御素。它具有广泛的生物学活性和多种药理作用,如抗肿瘤、抑制血小板聚集、抗炎、免疫调节、抗菌抗病毒[7]。此外,它能通过多种途径抑制细胞增殖,诱导其凋亡,因此起到对抗增生性疾病的作用。但Res是否能够抑制病理性瘢痕成纤维细胞增殖,并诱导其凋亡,目前鲜有报道。
病理性瘢痕发生的主要病理学基础是成纤维细胞凋亡不足或受阻,导致其增殖相对过度。TGF-β1参与细胞生长、分化及凋亡,是目前公认的与病理性瘢痕形成密切相关的最重要的细胞因子之一。Smads蛋白是TGF-β1的下游信号分子,能把TGF-β1介导的信号从细胞外传递到细胞核中。Smads家族蛋白根据其结构和功能不同可分为3类[8]:受体调节型Smad(Smad 1、2、3、5、8)、共同型Smad(Smad 4)、抑制型Smad(Smad 6、7)。研究[9]表明,TGF-β1/Smads信号通路与细胞凋亡的发生有密切的关系。在细胞凋亡过程中,TGF-β1首先与细胞膜上的受体结合,进而磷酸化胞质内的受体调节型Smads,即Smad 2、3,磷酸化的Smad 2、3再与Smad 4形成异三聚体,转运到核内,与核内的转录因子共同作用或独立调控下游特异基因的表达。
有研究[10]表明miR-200c可通过降低磷酸化Smad 2和Smad 3的蛋白表达水平来抑制经TGF-β1诱导的人瘢痕疙瘩纤维细胞的增殖和胶原合成,因此TGF-β1/Smads信号通路与病理性瘢痕的发生、发展密切相关。Res是否能通过调控TGF-β1/Smads信号通路来对病理性瘢痕成纤维细胞的增值、凋亡产生影响,目前国内外文献还没有这方面的研究报道。因此,本课题组对此进行了一些探索。
研究应用扫描电镜对Res干预后的病理性瘢痕成纤维细胞进行观察,在形态学上可见典型的凋亡特征。MTT法检测结果显示,不同浓度Res干预后,病理性瘢痕成纤维细胞的增殖都受到一定程度的抑制,其抑制作用随着Res浓度增加而增强,表明这种抑制作用有一定的剂量依赖。RT-PCR及免疫荧光检测结果显示,病理性瘢痕成纤维细胞经不同浓度的Res干预后,其TGF-β1,Smad 2、3、4 mRNA和蛋白表达降低,而Smad 7 mRNA和蛋白表达增加,与对照组相比,差异有统计学意义(P<0.05)。Pearson相关性分析表明,TGF-β1,Smad 2、3、4 mRNA和蛋白表达与Res干预浓度呈负相关,而Smad 7 mRNA和蛋白表达与Res干预浓度呈正相关。由此可知,Res能够抑制病理性瘢痕成纤维细胞的增值,诱导其凋亡,其机制可能与下调TGF-β1,Smad 2、3、4表达并上调Smad 7表达有关,这为后续开发利用Res治疗病理性瘢痕提供了理论依据。
[1] ZHANG ZF,ZHU F,XIAO L,et al.Side population cells in human gallbladder cancer cell line GBC-SD regulated by TGF-β-induced epithelial-mesenchymal transition[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(6):749-755.
[2] 赵柯森.白藜芦醇的生物学特性和效应[J].中国病理生理杂志,2012,28(9):1709-1711.
[3] 马双陶,杨大春,唐兵,等.白黎芦醇抑制基质金属蛋白酶抗酒性心肌纤维化[J].中国动脉硬化杂志,2012,20(1):21-24.
[4] VIEIRADE,ALMEIDA LM,PINEIRO LL,et al.Protective effects of resveratrol on hydrogen peroxide induced toxicity in primary cortical astrocyte culture[J].Neurochem Res,2008,33(1):8-15.
[5] 丁继存,翟晓翔,陈向辉,等.五倍子瘢痕膏水溶液对瘢痕疙瘩成纤维细胞增殖的影响[J].河北医科大学学报,2008,29(6):829-833.
[6] 王琨,刘刚.瘢痕疙瘩的治疗进展[J].中国中西医结合皮肤性病学杂志,2012,11(3):202-204.
[7] 焦慧琴,王莛,孙海梅,等.白藜芦醇对人皮肤癌细胞株a431生长抑制机制实验研究[J].首都医科大学学报,2009,30(2):212-217.
[8] SUZUKI H,YAGI K,KONDO M,et al.C-SKi inhibits the TGF-beta signaling pathway through stabilization of inactive snad complexes on smad-binding elements[J].Onlogence,2008,23(29):5068-5076.
[9] GRADY WM.Transforming growth factor-beta,smads,and cancer[J].Clin Cancer Res,2008,11(9):3191-3197.
[10] 孙慧娟,蒙喜永,胡纯婷.MicroRNA-200c通过TGF-β/Smad通路抑制人瘢痕疙瘩成纤维细胞增殖和胶原合成[J].中国美容医学,2012,21(9):1539-1542.

