Skp2反义寡核苷酸对大肠癌细胞SW480生长和增殖的影响
聂 伟,周洪伟,王继建
(1.武警重庆总队医院甲乳血管外科 400061;2.重庆医科大学第二附属医院普外科 400010;3.浙江省杭州师范大学附属医院普外科 310015)
泛素-蛋白酶体途径是真核细胞内蛋白质选择性降解的重要方式。S期激酶相关蛋白2(S-phase kinase-associated protein 2,Skp2)作为一个非常重要的F-box蛋白,参与泛素-蛋白酶体中作为泛素连接酶复合物SCF的组成,同时也是参与降解细胞周期抑制因子P27kip1重要蛋白[1]。根据既往的研究结果显示,Skp2和P27kip1分别扮演了原癌基因和抑癌基因的角色,并且在大肠癌组织中的表达呈显著负相关[2]。那么这种关系发生的相关机制是什么?以及它们之间是怎样进行调控?作者针对Skp2在大肠癌中过表达的特点,设计合成了以Skp2为靶点的高度特异性的反义寡核苷酸序列(antisense oligodeoxynucleotide ASODN),通过对Skp2表达的反义抑制作用,从分子生物学角度探讨Skp2与P27kip1蛋白表达呈负相关的可能机制,同时也为大肠癌的基因治疗提供实验依据。
1 材料与方法
1.1试剂 大肠癌细胞株SW480,购于第四军医大学实验动物中心;Skp2 ASODN、无义寡核苷酸(Nonsense oligodeoxynu-cleotide,NSODN)和内标GAPDH引物均由上海生物工程公司合成;脂质体 Lipofectamine TM2000购于美国Invitrogen公司;Trizol试剂盒购于北京鼎国生物技术有限责任公司;RT-PCR试剂盒购于Takara宝生物工程(大连)有限公司。
1.2方法
1.2.1Skp2 ASODN的设计与合成 参阅相关文献,并根据Skp2mRNA(GenBank:NM-005983)起始密码子后180~196 bp碱基序列,设计与其互补的17个碱基寡聚物。Skp2 ASODN序列为 5′-CCT GGG GGA TGT TCT CA- 3′ ;Skp2 NSODN序列为5′-GGC TTC CGG GCA TTT AG-3′,Skp2 NSODN序列的碱基数目及比例与Skp2 ASODN相同,但序列随机排列,经GenBank检索不与基因组序列配对。
1.2.2引物设计与合成 内标GAPDH引物参照文献。Skp2、P27kip1引物以NewStar软件自行设计。GAPDH上游引物:5′-CCA TGG AGA AGG CTG GGG-3′,下游引物:5′-CAA AGT TGT CAT GGA TGA CC-3′,扩增产物为195 bp。P27kip1上游引物:5′-CGT GGC TCG TCG GGG TCT GTG TCT-3′, 下游引物:5′-GGG GCC GCG GGG GTC TGT AGT AG-3′,扩增产物431 bp。Skp2上游引物:5′-AAG AGG AGC CCG ACA GTG AGA ACA-3′,下游引物:5′-GAC AGT ATG CCG TGG AGG GTG GAC-3′,扩增产物481 bp。
1.2.3噻唑蓝(MTT)检测Skp2 ASODN对SW480细胞的增殖抑制影响 将SW480细胞以细胞密度为2×105/mL,接种于96孔培养板。分别加入Skp2 ASODN和Skp2 NSODN,终浓度分别为0.050、0.125、0.250、0.500、1.000、2.000、4.000 μmol/L,每组接种5孔,每孔总体系保持200 μL。空白对照组加入等量无血清、无抗生素的RPMI-1640液。孵育12 h后,弃去转染液,添加含血清RPMI-1640培养液200 μL,继续培养72 h。每孔加入MTT(浓度5 mg/mL)20 μL,继续孵育4 h,终止培养。小心吸弃孔内培养上清液,每组取3孔加入150 μL 二甲基亚砜,振荡10 min,并在酶联免疫检测仪上测定各孔490 nm波长吸光度值(A值)。细胞增殖抑制率(%)=[1-(实验组A值/对照组A值)]×100%。每组另外2孔在倒置显微镜下观察其生长情况。
1.2.4流式细胞仪检测Skp2 ASODN对SW480细胞周期影响 取对数生长期SW480细胞,经稀释成终浓度为3.5×105/50 mL细胞悬液后继续培养24 h,分别加入Skp2 ASODN、Skp2 NSODN至终浓度1.0 μmol/L,加入无血清的培养液使总的体系为200 μL,转染12 h。吸去转染液后,添加含有血清的培养液,置于37 ℃、5% CO2孵箱培养72 h。收集细胞,调整细胞终浓度为1×106/mL,经磷酸盐缓冲液(PBS)洗涤,-4 ℃预冷的70%乙醇固定1 h,加RNA酶(100 μg/mL,罗氏公司)500 μL,30 min,加50 μg/mL 碘化丙啶(PI)500 μL,30 min,混合液用300目尼龙网除去杂质。用流式细胞仪进行细胞周期分析。
1.2.5RT-PCR检测Skp2 mRNA和P27kip1mRNA 实验分为ASODN、NSODN和对照组。细胞接种和转染方法同上。PBS洗涤各组细胞,用Trizol核酸提取试剂盒,按照说明分别提取各组细胞中的总RNA,按照RT-PCR试剂盒说明操作,反应体系为20 μL,反应条件为37 ℃恒温类30 min,95 ℃ 5 min中止反应,随后进行PCR反应。取逆转录的cDNA产物2 μL,分别加入10×RT缓冲液4.5 μL,Taq酶1 μL,DEPC-ddH2O 42.5 μL,上、下游引物各50 pmoL,反应体系为50 μL进行RT-PCR反应。Skp2扩增条件为94 ℃ 2 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 45 s,30个循环;72 ℃ 延伸5 min。P27kip1扩增条件为96 ℃ 1 min,62 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 延伸10 min。GAPDH扩增条件为95 ℃ 1 min,62 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 延伸8 min。取PCR产物,经2.5%琼脂糖凝胶电泳,凝胶系统成像(美国Bio-Rad公司),观察结果并照相。
1.2.6细胞免疫化学染色测定Skp2和P27kip1蛋白表达 取对数生长期SW480细胞,用0.25%胰蛋白酶消化成单细胞悬液后,以1×105/孔接种于12孔培养板中,置于37 ℃、5%饱和湿度条件下培养24 h,待细胞贴壁后,分别加入1 μmol/L Skp2 ASODN和NSODN,同时设立空白对照组。孵育12 h后,弃去转染液,添加含血清RPMI-1640培养液200 μL,继续培养72 h。经PBS清洗,经95%乙醇固定后,对细胞进行免疫化学染色。根据前期实验可知,Skp2 和P27kip1表达均位于细胞核,染色呈棕黄色或黄褐色。
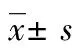
2 结 果
2.1Skp2 ASODN对SW480细胞生长的影响 倒置显微镜下观察发现, 经过Skp2 ASODN处理72 h后,SW480细胞形态未见改变,但其生长速度明显减慢。见图1。

A:对照组细胞培养72 h;B:Skp2 ASOND处理后培养72 h。
图1 Skp2 ASODN对SW480细胞生长的影响
2.2MTT检测Skp2 ASODN对SW480细胞增殖的抑制作用 当Skp2 ASODN浓度达到0.125 μmol/L时,其A值与对照组比较,差异有统计学意义(P<0.05),随着Skp2 ASODN浓度的增加,各浓度A值与对照组比较,差异有统计学意义(P<0.01)。当Skp2 NSODN浓度达到4.000 μmol/L时,其对细胞的增殖也显示抑制作用(P<0.01),见表1。
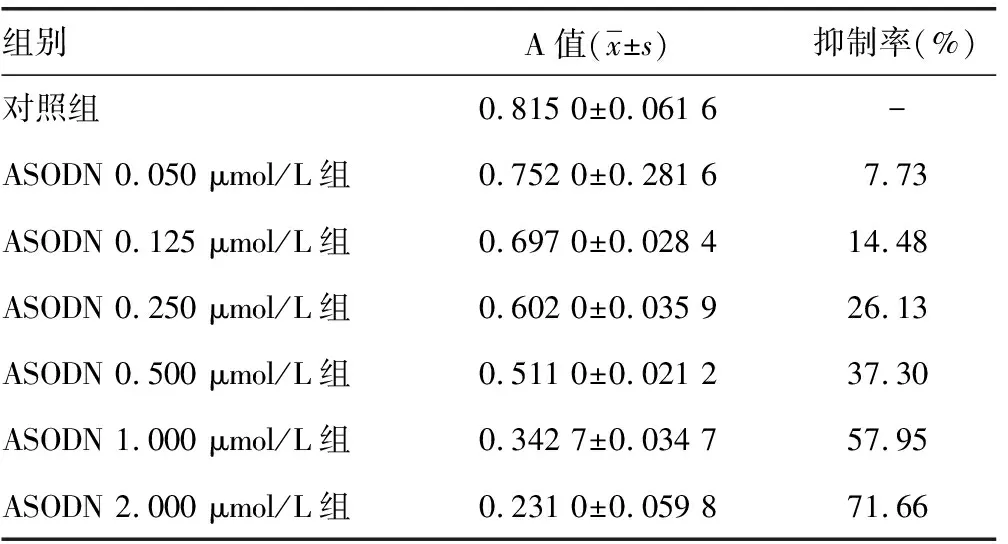
表1 Skp2 ASODN、Skp2 NSODN作用SW480细胞后的A值及增殖抑制率

续表1 Skp2 ASODN、Skp2 NSODN作用SW480细胞后的A值及增殖抑制率
-:此项无数据。
2.3Skp2 ASODN对SW480细胞周期的影响 经Skp2 ASODN作用后,停留于G0/G1期SW480细胞增多(P<0.01),而进入S期的细胞减少(P<0.05),在G2/M期的细胞数量无明显改变(P>0.05)。见表2。
2.4Skp2 ASODN对Skp2、P27kip1mRNA表达的影响 RT-PCR实验结果显示,Skp2 ASODN作用后的SW480细胞中Skp2 mRNA表达降低,P27kip1mRNA表达无变化。见图2。
2.5Skp2 ASODN对Skp2、P27kip1蛋白表达的影响 细胞免疫化学结果显示,经Skp2 ASODN处理后SW480细胞中Skp2蛋白表达降低(染色减弱),P27kip1蛋白表达增强(染色增强)。见图3。
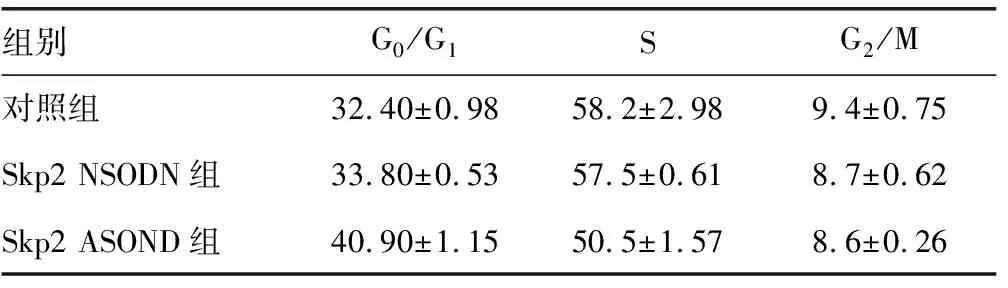
表2 FCM检测Skp2 ASODN和Skp2 NSODN处理后SW480的细胞周期结果(%)

M:Marker;1:ASODN Skp2;2:ASODN P27kip1;3:GAPDH;4:NSODN Skp2;5:NSODN P27kip1;6:GAPDH;7:对照组 Skp2;8:对照组 P27kip1;9:GAPDH。
图2各组Skp2和P27kip1mRNA表达情况

A:经Skp2 ASODN处理后Skp2蛋白表达;B:经Skp2 NSODN处理后Skp2蛋白表达;C:经Skp2 ASODN处理后P27kip1蛋白表达;D:经Skp2 NSODN处理后P27kip1蛋白表达。
图3经Skp2 ASODN、NSODN处理后Skp2、P27kip1蛋白变化(SP×200)
3 讨 论
细胞周期是生命活动的基础,通过有效的内外调控作用,保证细胞周期有序地进行。肿瘤则是一类渐进性细胞周期调控机制紊乱的疾病,因此,对肿瘤细胞周期调控机制的研究,对认识肿瘤的发生、发展,临床诊断与治疗有着重要意义。作为泛素连接酶,Skp2主要功能是特异性识别磷酸化的底物并介导其泛素化降解。研究显示,Skp2和细胞周期调控因子之间密切相关,如E2F、cyclinA、cyclinB、cyclinDl、cyclinE、p21、P27kip1和p53都是泛素蛋白酶体途径的底物[3-5]。近年研究发现 Skp2扮演着原癌基因的角色,参与了肿瘤的发生及发展。为了进一步研究Skp2对细胞调控因子的异常泛素化降解作用,Wei等[6]发现作为调节细胞周期泛素蛋白酶体之一的SCF复合体,可通过对Skp2的调节,发挥对细胞G1期的调控。Nelsen等[7]研究发现, cyclinE和Skp2转染大大缩短了肝细胞G1期向S期过渡时间,并且还促进大量肝细胞的复制和肝组织的增生,证实Skp2是一种参与G1期到S期过渡调控的蛋白,扮演致癌基因的作用。既往研究发现,在许多人类恶性肿瘤中,如食道鳞状上皮细胞癌、胃癌、乳腺癌、肺癌、宫颈癌以及前列腺癌等,Skp2均呈过表达[8-12]。以前的研究发现,Skp2在大肠癌中也呈过表达,扮演着癌基因的角色。
既往有关P27kip1的研究,主要是其对细胞周期的负性调控方面,发现在多种肿瘤中均有P27kip1表达的下调现象[13],推测可能与细胞周期关卡G1/S抑制作用减弱有关。但近年来,随着对大量肿瘤细胞中Skp2和P27kip1的相关性研究发现,Skp2-P27kip1通路与人类恶性肿瘤发生存在密切关系,推测与泛素-蛋白酶体途径有关[14]。泛素-蛋白酶体途径是真核细胞选择性降解蛋白的重要途径,是参与调控细胞周期、基因转录及信号转导等过程中的关键机制。作为F-box蛋白家族成员之一,Skp2参与SCF复合体组成并起到了底物识别的作用,对细胞周期因子P27kip1进行特异性识别并降解,从而参与细胞周期调控。Miyamoto等[15]研究发现,Skp2和P27kip1在正常子宫内膜增生期和分泌期表达。59%的子宫内膜癌患者Skp2与P27kip1表达呈负相关。Xiang等[16]发现在鼻型自然杀伤T细胞淋巴瘤患者中,71%Skp2阳性,73% P27kip1阴性,两者呈负相关。此外,在乳腺癌、胆管癌等肿瘤中也有类似的报道[17]。本实验中,作者发现在大肠癌细胞中Skp2呈过表达,P27kip1表达下调,二者呈负相关,推测Skp2-P27kip1通路参与此过程,其可能的机制与泛素-蛋白酶体途径有关,主要发生在转录后水平。
作为调控和检测特定基因表达的重要方法,ASODN技术在近年来取得了显著的进步。ASODN技术具有合成方便、序列设计简单、选择性高、亲和力强等特点。通过本研究发现,利用ASODN的基因封闭和阻断技术,能有效抑制大肠癌细胞的增殖和生长,不仅证实了Skp2在大肠癌中扮演了原癌基因的角色,同时也为大肠癌的基因治疗提供实验依据。
综上所述,大肠癌同其他大多数肿瘤一样,可能也存在着过表达的Skp2以泛素-蛋白酶体途径从而对P27kip1产生过度降解,二者共同参与肿瘤的发生和发展。随着对Skp2和P27kip1研究的不断深入,二者在大肠癌细胞中是否还存在其他作用机制,有待进一步研究。
参考文献:
[1] Carrano AC,Eytan E,Hershko A,et al.SKP2 is required for ubiquitin-mediated degradation of the CDK inhibitor p27[J].Nat Cell Biol,1999,1(4):193-199.
[2] 聂伟,周洪伟,易永芬,等.Skp2、c-Myc和P27~(kip1)蛋白在大肠癌组织中的表达及相关性研究[J].重庆医科大学学报,2006,31(4):556-560.
[3] Bremner R,Zacksenhaus E.Cyclins,Cdks,E2f,Skp2,and more at the first international RB Tumor Suppressor Meeting[J].Cancer Res,2010,70(15):6114-6118.
[4] Sorbye SW,Kilvaer TK,Valkov A,et al.Prognostic impact of Jab1,p16,p21,p62,Ki67 and Skp2 in soft tissue sarcomas[J].PLoS One,2012,7(10):e47068.
[5] Song GJ,Barrick S,Leslie KL,et al.The scaffolding protein EBP50 promotes vascular smooth muscle cell proliferation and neointima formation by regulating Skp2 and p21(cip1)[J].Arterioscler Thromb Vasc Biol,2012,32(1):33-41.
[6] Wei W,Ayad NG,Wan Y,et al.Degradation of the SCF component Skp2 in cell-cycle phase G1 by the anaphase-promoting complex[J].Nature,2004,428(6979):194-198.
[7] Nelsen CJ,Hansen LK,Rickheim DG,et al.Induction of hepatocyte proliferation and liver hyperplasia by the targeted expression of cyclin E and skp2[J].Proc Natl Acad Sci U S A,2001,20(15):1825-1831.
[8] Liang Y,Hou X,Cui Q,et al.Skp2 expression unfavorably impacts survival in resectable esophageal squamous cell carcinoma[J].J Transl Med,2012,10(1):73-80.
[9] Wei Z,Jiang X,Qiao H,et al.STAT3 interacts with Skp2/p27/p21 pathway to regulate the motility and invasion of gastric cancer cells[J].Cell Signal,2013,25(4):931-938.
[10] Uehara N,Yoshizawa K,Tsubura A.Vorinostat enhances protein stability of p27 and p21 through negative regulation of Skp2 and Cks1 in human breast cancer cells[J].Oncol Rep,2012,28(1):105-110.
[11] Hung WC,Tseng WL,Shiea J,et al.Skp2 overexpression increases the expression of MMP-2 and MMP-9 and invasion of lung cancer cells[J].Cancer Lett,2010,288(2):156-161.
[12] Wang Z,Gao D,Fukushima H,et al.Skp2:a novel potential therapeutic target for prostate cancer[J].Biochim Biophys Acta,2012,1825(1):11-17.
[13] Serres MP,Kossatz U,Chi Y,et al.p27(kip1) controls cytokinesis via the regulation of citron kinase activation[J].J Clin Invest,2012,122(3):844-858.
[14] Egozi D,Shapira M,Paor G,et al.Regulation of the cell cycle inhibitor p27 and its ubiquitin ligase Skp2 in differentiation of human embryonic stem cells[J].FASEB J,2007,21(11):2807-2817.
[15] Miyamoto T,Horiuchi A,Kashima H,et al.Inverse correlation between Skp2 and p27(Kip1) in normal endometrium and endometrial carcinoma[J].Gynecol Endocrinol,2010,26(3):220-229.
[16] Xiang LM,Zu LS,Dan H,et al.Skp2/p27 expression profile is correlated with Epstein-Barr virus status in extranodal nasal-type natural killer cell lymphoma[J].Transl Res,2008,151(6):303-308.
[17] Liu S,Yamauchi H.p27-Associated G1 arrest induced by hinokitiol in human malignant melanoma cells is mediated via down-regulation of pRb,Skp2 ubiquitin ligase,and impairment of Cdk2 function[J].Cancer Lett,2009,286(2):240-249.

