苦参碱抑制人骨肉瘤细胞MG63增殖的实验研究
李国慧,刘瑞花,李贵霞,张丽霞
(1.河北省儿童医院检验科,河北 石家庄 050031;2.河北省老年病医院药剂科,河北 石家庄 050011;3.河北省儿童医院成人科,河北 石家庄 050031)
骨肉瘤,又称成骨肉瘤,是青少年最常见的恶性成骨性肿瘤之一,该瘤恶性程度高,预后极差。以大剂量化疗为主的综合治疗效果并不理想,且不良反应大。苦参碱作为药用植物在我国据文字记载已有2 000多年的历史,目前在医药领域有着广泛的应用,有关苦参碱抗肿瘤作用也受到了人们的广泛关注。本研究初步观察了苦参碱对骨肉瘤MG63细胞生长、增殖的影响,旨在为苦参碱抗肿瘤作用的临床应用提供相应的理论基础。
1 材料与方法
1.1 细胞培养:人骨肉瘤MG63细胞株由河北医科大学第三医院实验中心保存,提供使用。MG63细胞生长在含10%胎牛血清的DMEM培养基37℃饱和湿度5%CO2培养箱中培养。待细胞进入对数生长期后用于实验。
1.2 倒置相差显微镜下观察:将MG63细胞接种于放有盖玻片的培养皿中培养,待细胞生长至对数生长期,换用含有不同浓度苦参碱的新鲜培养基,定时镜下观察并照相。
1.3 四甲基偶氮唑蓝实验:取对数生长期A21-2细胞经胰酶消化后,调整细胞浓度为1×104/mL,每孔200μL接种于96孔板,培养24h后吸去培养液,加入含药的培养液,分别设对照组(不含药培养基)和不同浓度(0.2、0.4、0.6、0.8、1.0g/L)苦参碱组,每组设10个复孔。分别培养48、72h,培养结束前4h每孔加入20μL四甲基偶氮唑蓝(5g/L),37℃继续孵育4h(药物继续作用),吸去培养液,每孔加入150μL DMSO,在振荡器上振荡15min,用全自动酶标仪(测定波长492nm,参考波长630nm)测定各孔吸光度(A)值计算细胞生长抑制率并计算IC50值以及相关系数(r)。细胞生长抑制率(%)=(A对照-A实验)÷A对照×100%
1.4 反转录聚合酶链反应测定caspase-3mRNA的表达
1.4.1 细胞总RNA的提取:将按上述分组干预过的细胞,吸去培养液,每瓶加入TRIZOL 1mL,冰上振荡裂解15min,将瓶内液体移入离心管内,分别加入0.2mL氯仿,颠倒混匀,4℃,12 000r/min离心15min,小心吸取上层水相移入另一离心管内,加入异丙醇0.5mL混匀,静置30min,4℃,12 000r/min离心10min,弃上清,沉淀用75%乙醇洗两遍,干燥后用30μL DEPC水溶解,取5μL,用紫外分光光度计测其RNA浓度。
1.4.2 cDNA的合成:取总RNA5μg,在70℃变性10min后,加入1μL 10 mmol/LdNTP,4μL 3U RNA酶抑制剂,1μL 50ng/μL 随机引物,2μL(AMV)反转录酶,4μL(5×AMV)缓冲液,用超纯水补足到20 μL。反应条件为25℃ 10min,42℃ 1h,95℃ 5min,得到cDNA。
1.4.3 聚合酶链反应:反应总体积为20μL,包括4μL cDNA,25mmol/L MgCl21.5μL,0.5U Taq酶1μL,10μmol/L引物各0.7μL,10mmol/L dNTP 0.4μL,10×buffer 0.8μL,用超纯水补足到20μL。聚合酶链反应反应条件,94℃预变性5min,94℃30s,56℃退火30s,72℃延伸45s,30个循环,72℃复性5min。引物由北京奥科生物技术公司设计合成。Caspase-3引物序列上游,5′-TTCAGAGGGGATC-GTTGTAGAAGTC-3′;下游,5′-CAAGCTTGTCGGCATAC-TGTTTCAG -3′(265bp);β-actin上游,5′-GACAGGCA-GAAGGAGATTACTG-3′;下游,5′-GCTGATCCACAT-CTGCTGGAA-3′(142bp)。聚合酶链反应产物经8%聚丙烯酰氨凝胶电泳,溴化乙锭显色,Bio-profif 凝胶图像分析系统进行摄像分析。通过caspase-3/β-actine灰度比值作相对定量。

2 结 果
2.1 倒置相差显微镜下观察结果:镜下可见对照组细胞贴壁生长,呈梭形或多角形,核圆形,胞浆透亮,细胞增殖状态良好(图1A)。0.6g/L的苦参碱干预MG63细胞72h后见部分细胞脱落,悬浮于培养基中,在贴壁生长的细胞中有少数可见膜破裂呈坏死状。且高浓度组比低浓度组效果更明显(图1B)。

图1苦参碱作用MG63细胞72h后倒置相差显微镜观察结果
A.对照组细胞( ×20);B.0.6g/L苦参碱作用72h后( ×20)
Figure 1 The morphological changes of MG63 cells treated with matrine for 72h
A.Control cells( ×20);B.Cells treated with 0.6g/L matrine ( ×20)
2.2 四甲基偶氮唑蓝实验结果:各浓度苦参碱对MG63细胞的生长均具有抑制作用,且随着苦参碱浓度的增高,作用时间的延长,抑制率也随着增加,当应用1g/L苦参碱处理MG63细胞72h后,其增殖抑制率达到71.16%,显示出较强的增殖抑制作用。苦参碱作用48h的IC50为1.019g/L。苦参碱作用72h的IC50为0.701g/L,且药物浓度与抑制率之间呈现良好的剂量-效应关系(r=0.979 7,P<0.01)。不同浓度处理组间的比较表明不同浓度苦参碱对细胞的生长抑制作用差异均有统计学意义。并且相同浓度苦参碱,随着时间的延长,抑制作用明显增强,具有良好的时效关系(表1)。


Matrine concentrations (g/L)48hMTT-A valueInhibitory rate (%) 72hMTT-A valueInhibitory rate (%) 0(control)0.225±0.0220.290±0.0230.20.196±0.010∗8.990.256±0.009∗11.890.40.182±0.010∗15.270.236±0.018∗18.640.60.155±0.006∗27.700.170±0.009∗41.350.80.137±0.008∗36.270.101±0.011∗65.131.00.104±0.004∗51.770.084±0.013∗71.16
*P<0.01vscontrol group byANOVA
2.3 Caspase-3 mRNA表达情况:由反转录聚合酶链反应的聚丙烯酰氨凝胶电泳图可以观察到,经0.4、0.6、0.8g/L的苦参碱处理的MG63细胞72h后,与对照组相比caspase-3的条带明显变亮,由MG63细胞得caspase-3mRNA/β-actin比值分别为0.519±0.105、0.754±0.173、0.973±0.165,与对照组0.131±0.107比较差异有统计学意义(P<0.01)(图2)。
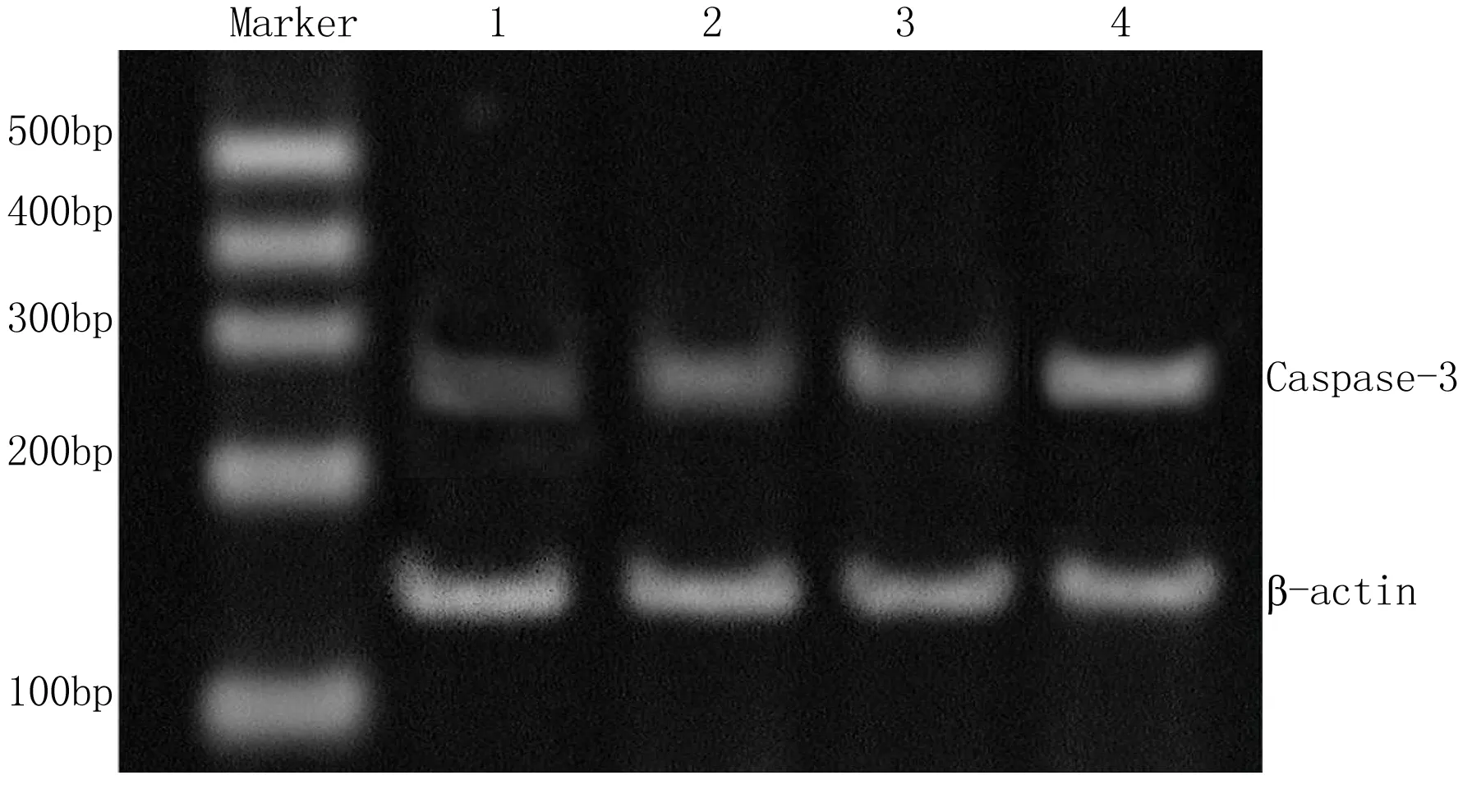
图2 苦参碱作用MG63细胞72h后caspase-3 mRNA 的表达分析
标记条带:标记DNA;条带1:对照组;条带2:苦参碱浓度为0.4g/L;条带3:苦参碱浓度为0.6g/L;条带4:苦参碱浓度为0.8g/L
Figure 2 Analysis of the caspase-3 mRNA expression in MG63 cells treated with matrine for 72 hours
Lane marker: DNA marker;Lane 1:control cells; Lane 2:0.4g/L matrine;Lane 3:0.6g/L matrine;Lane 4:0.8 g/L matrine
3 讨 论
目前癌症已成为严重危害人类生命和健康的常见病、多发病。癌症之所以难以治愈是由于癌细胞不受机体控制而无限增殖,同时癌细胞具有侵袭性,能够破坏邻近的组织和器官,从而使癌症难以彻底治愈。苦参碱是从中药苦参的干燥根中提取的一类活性物质,具有明显的抗炎、抗病毒、抗心律失常等功效[1-2]。近年来其抗肿瘤的作用引起了人们的广泛关注[3-4]。本研究将苦参碱作用于 MG63细胞株,观察药物作用后癌细胞细胞形态学的变化,观察癌细胞受抑制情况以及caspase-3表达情况,旨在为苦参碱在临床治疗肿瘤过程中提供理论依据。肿瘤细胞的显著特点之一就是生长失控,无限增殖。直接杀死肿瘤细胞是诸多抗肿瘤药物的主要作用。本研究结果显示,苦参碱作于MG63细胞后,倒置相差显微镜下观察到,与对照组相比,用药组的细胞生长明显被抑制,胞浆内颗粒增多增粗,细胞贴壁能力减弱,部分细胞收缩、变圆而悬浮在培养基内。
有研究[5-10]发现苦参碱可呈剂量依赖性的抑制癌细胞的增殖。本研究结果显示,苦参碱能有效抑制MG63细胞的生长,当作用一定时间时,随着药物浓度的增加,苦参碱对MG63细胞的生长抑制率逐渐上升;当药物浓度一定时,适当延长作用时间,抑制率也明显上升。这表明苦参碱对MG63细胞的抑制作用具有明显的时间和剂量依赖性。
Caspase-3又称半胱氨酸蛋白酶32或Yama/Apopain,是caspase家族的重要成员,caspase-3的表达下调与恶性肿瘤的浸润转移和病理分级密切相关,说明caspase-3在恶性肿瘤表达下调导致癌细胞凋亡失控,进而参与恶性肿瘤的发生与演进过程,因此研究caspase-3在肿瘤发生发展过程中的作用,以探寻如何在分子水平上促进肿瘤细胞的凋亡,已日益成为临床肿瘤康复治疗过程中提高患者生存率和改善患者生活质量的全新研究方向。本研究应用反转录聚合酶链反应技术观察到经不同浓度苦参碱处理的MG63细胞中caspase-3mRNA 表达不同,其表达的高低与苦参碱的药物浓度呈正相关。表明苦参碱可使caspase-3基因的mRNA表达水平上调,这可能是苦参碱促进肿瘤细胞凋亡的作用机制之一,即通过使caspase-3表达上调而实现。
[1] 李素梅,蒋永兴,常靓.氧化苦参碱的研究进展[J].中国保健营养,2012,22(6):1701-1702.
[2] 闫桂珍,郭景生.苦参碱滴丸抗心律失常作用的实验研究[J].河北医科大学学报,2004,25(3):142-143.
[3] ZHANG JQ,LI YM,LIU T,et al.Antitumor effect of matrine in human hepatoma G2 cells by inducing apoptosis and autophagy[J].World J Gastmenterol,2010,16(34):4281-4290.
[4] QIN XG,HUA Z,SHUANG W,et al.Effects of matrine on HepG2 cell proliferation and expression of tumor relevant proteins in vitro[J].Pharm Biol,2010,48(3):275-281.
[5] DAI ZJ,GAO J,JI ZZ,et al.Matrine induces apoptosis in gastric carcinoma cells via alteration of Fas/FasL and activation of Caspase-3[J].J Ethnopharmacol,2009,123(1):91-96.
[6] LIU T,SONG Y,CHEN H,et al.Matrine inhibits proliferation and induces apoptosis of pancreatic cancer cells in vitro and vivo[J].Biol Pharm Bull,2010,33(10):1740-1745.
[7] HAN Y,ZHANG S,WU J,et al.Matrine induces apoptosis of human multiple myeloma cells via activation of the mitochondrial pathway[J].Leuk Lymphoma,2010,51(7):1337-1346.
[8] LIANG CZ,ZHANG JK,SHI Z,et al.Matrine induces caspase-dependent epoptosis in human osteosarcoma cells in vitro and invivo through the upregulation of Bax and Fal/FasL and downregulation of Bcl-2[J].Cancer Chemother Pharmacol,2012,69(2):217-331.
[9] ZHAO B,LI B,BAI S,et al.Effects of matrine on proliferation and apoptosis of cultured retinoblastoma cells[J].Graefes Arch Clin Exp Ophthalmol,2012,250(6):897-905.
[10] ZHANG S,QI J,SUN L,et al.Matrine induces programmed cell death and trgulates expression of relevant genes based on PCR array analysis in C6 glioma cells[J].Mol Biol Rep,2009,36(4):791-799.

