自制双管套管在大鼠前扣带回皮层置管给药的方法*
冯晓璞兰坤张肖怡宋瑞瑞王锐张宇
自制双管套管在大鼠前扣带回皮层置管给药的方法*
冯晓璞①兰坤①张肖怡①宋瑞瑞①王锐①张宇①
目的:自制双管套管在大鼠脑部前扣带皮层双侧注射药物。方法:首先自制双管套管,在立体定位仪的指引下将双管套管精确定位埋置并插入堵丝,然后用牙科水泥和螺钉将其固定于颅脑顶部;待大鼠术后体重恢复,将连接有微量进样器的注射针插入已埋置好的套管,用微量注射泵将药物缓慢注射于两侧前扣带皮层区域;给药完毕后即可观察大鼠的行为反应;如此可反复多次给药进行长期实验观察。结果:药物被准确注射到目的脑区,即双侧前扣带皮层,实验过程中大鼠状态良好,行为反应如预期。结论:自制双管套管的方法简便易行、经济可靠,实验取得良好的效果。
前扣带回皮层; 双管套管; 脑内置管; 大鼠
在一些神经生理学和神经药理学的实验中,观察大脑内双侧分布的核团在神经环路中的作用时,需要进行双侧脑区同时给药以便于研究。由于大脑神经环路较多并且复杂,而实验中脑室或某一脑区局部给药多用于观察特定脑区或核团在某一神经功能活动中的作用或研究药物和内源性活性物质对神经系统的作用[1-2]。局部埋置导管给药主要有以下优点:一是通过导管将药物注入脑内特定区域,可在小范围局部干预目标核团或脑区的功能活动,便于更精确探索目
标核团或脑区在功能活动中起的作用;二是可以分不同时间点多次给药,观察药物作用的时效性,掌握实验动物对药物刺激的反应;三是埋置导管术后5~10 d时手术应激已消失,血脑屏障已修复,可在动物清醒、自然状态下观察动物的行为表现[3]。
实验若埋置的是单管导管,那么单管导管可以购买(国内有生产),也可自己制作,其方法国内已有文献[4]介绍,但有些实验是需要埋置双管套管的。双管套管国内还没有厂家可以生产,若购买国外的产品,价格昂贵,实验中大量使用会有较大经济负担;若用两个单管分别埋置,像前扣带皮层(ACC)这样左右对称的脑区间隔距离又小于并排两个单个给药导管的导管间距,不利于准确定位[5-6]。本研究室近年的工作集中于前扣带皮层神经元参与痛情绪反应的相关研究,需要在动物大脑前扣带皮层部位给予相关受体的激动剂或者拮抗剂[7-8]。实验中需要大量的双管套管,在实验中,笔者结合以往的使用经验,在不影响实验的规范性的前提下,自制了用于ACC脑区双侧给药的双管套管,并设计了将管道固定于立体定位仪上的装置,提高了实验的效率,使实验成本大大降低。下面就制作方法和使用体会进行介绍。
1 材料与方法
1.1 实验器材
1.1.1 套管系统
1.1.1.1 基本装置 25 G橙色平头针头(也可将注射用25 G针头加工);注射内芯外径0.30 mm,可顺畅插入25 G注射针头;注射内芯连接PE管(瑞沃德,规格型号62303),外径0.5 mm,内径0.25 mm;导管堵头用直径0.2 mm或0.3 mm的304不锈钢钢丝做成。
1.1.1.2 双管套管的制作 将25 G橙色针头的塑料柄削为合适的厚度(大约0.6 mm),然后将两个经过处理的25 G橙色针头用万能胶并排粘在一起,使两个针头的距离固定为1.2 mm。将不锈钢丝裁剪约为25 mm的小段,然后弯成U形,在针头内插入U形不锈钢丝,将多余的堵丝剪掉,使得U型不锈钢堵丝在针头平面以下0.2 mm,双针头给药管制作完成,见图1。
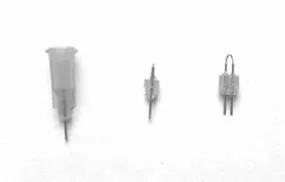
图1 自行制作实验用套管实物图
1.1.1.3 套管系统的直径和长度选择 笔者在侧脑室所要置管的目标位置是前扣带皮层即Bregma向前2.6 mm,旁开0.6 mm,深度为颅骨平面下1.6 mm[9]。此长度在250~270 g重的SD大鼠刚好可以垂直达到前扣带皮层,在250~270 g SD大鼠刚刚穿透皮层进入前扣带皮层,这样就基本避免了定位偏差时相对粗大的外管对大脑的损伤。自制给药系统装置的示意图见图2。
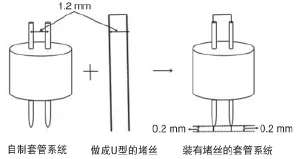
图2 自制给药系统装置的示意图
1.1.1.4 套管系统给药过程 装有给药管的套管系统,将连接有PE管的注射内芯插入自制套管内即可给药,见图3。
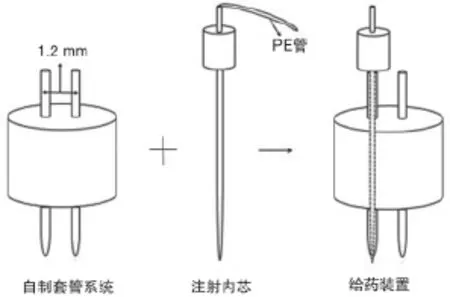
图3 自制给药系统装置给药过程示意图
1.1.1.5 套管系统高温消毒
1.1.2 其他器材 微量给药泵;颅骨钉,直径1.4 mm,长度2.5 mm(瑞沃德,型号62512)
1.2 实验用品 灭菌棉球;用新洁而灭浸泡消毒过的手术器械;石蜡油;灭菌黑墨水。
1.3 手术方法 (1)雄性SD大鼠(体重250 g左右),1%戊巴比妥钠腹腔注射麻醉(40 mg/100 g)[10]。(2)将动物固定于立体定向仪上,齿杆前上缘低于耳杆中心3.3 mm。头顶皮肤剃毛,消毒。(3)切开颅顶皮肤筋膜,以无菌干棉球涂擦颅骨表面清楚暴露Bregma点,并用蓝墨水标记。进针点定位于Bregma点前2.6 mm,矢状缝两侧各0.6 mm,见图4。在拟埋管及固定颅骨钉处(直径1 mm左右)钻孔,共钻5孔,注意将颅骨钻透但不要伤及脑实质。在埋管部位钻孔完成后可见清亮的脑脊液流出[4]。(4)用消毒棉球止血,干燥
术野。选用直径为1.4 mm,长度为2.5 mm的颅骨钉。将装有堵丝的自制套管系统垂直固定于立体定向仪的纵向坐标上,精确定位于Bregma点向前2.6 mm,旁开0.6 mm处。将管道埋入与颅骨紧密相贴。再次干燥术野。再在术野表面滴涂石蜡油封闭并保护脑组织。之后采用牙托水泥将套管,颅骨,颅骨钉紧密粘合[3]。将粉剂和溶剂按比例混合后凝固时间为5~10 min。应避免粘和物体表面有水,否则粘和不牢。(5)待牙托粉自凝塑料完全凝固后松开固定管道的装置。(6)术后腹腔注射青霉素20万单位/只,防止感染。(7)将大鼠放回笼,休养5~7 d,体重恢复后再进行后续实验。(8)给药时将内芯取出,给药针从套管进入给药。给药结束后将内芯插入。一次给药结束,可多次给药。

图4 给ACC埋置双导管的平面位置示意图
2 结果
药物被准确注射到目的脑区,即双侧前扣带皮层,实验过程中大鼠状态良好,行为反应如预期。
3 讨论
在研究神经功能活动的环路时,需要对双侧核团或脑区进行同步干预。在脑立体定位仪的定标下将带内芯的导管埋置后,用牙托水泥和小螺丝将管道的外露部分固定于颅骨表面。本实验自行制作设计的装置既能够将药物注射入特定的目的区域,从而圆满完成试验任务,又能够降低所花费的费用。埋管5~10 d后手术应激已消失,血脑屏障已修复。此时在动物清醒状态下将内芯抽出,将一连接有微量给药泵的内针即给药针插入管道到达目的部位注射给药后将内针抽出,再插入内芯封闭管道以再次给药[11-13]。此法基本避免了应激及其他因素的干扰,从而使得结果更加可信。
术后大鼠对埋置导管的耐受好,行为无异常。术后7 d拔出堵丝仍可见脑脊液流出[14]。取材时未见管道移位和周围出血的现象。需要注意的有以下几个方面。(1)预试验阶段曾腹腔注射10%的水合氯醛(0.3 mL/100 g)麻醉动物,但实验动物腹胀率高,死亡率高。解决办法是使用另一种麻醉剂即戊巴比妥钠溶液腹腔注射。术前要禁食8 h,麻药剂量要进行精确地计算,在本实验中实验者使用1%戊巴比妥钠0.45 mL/100g。(2)动物买来后一定要在在实验室适应3~5 d后再手进行手术,保持其正常的生命活动状态。(3)在实验过程中出现1~2只行为极其癫狂的大鼠,在把实验大鼠断头处理后,观察ACC区域,偶尔可见脓液存在,说明出现了颅内感染,解决办法是术前术中用的器械必须要严格地进行消毒,术后腹腔注射青霉素20万单位/(次·只)进行抗炎或用青霉素粉末敷于颅脑表面亦可达到相同效果。(4)在室温低于20 ℃的情况下,若是大鼠进行手术,在进行手术过程中大鼠呼吸抑制状态不佳,甚至死亡;解决办法是手术过程中及术后至大鼠苏醒一定要将温度保持在37 ℃左右,可借助电暖宝,鼠被等手段。(5)手术过程中脑立体定位仪的准确性很重要,因为管道相对于大鼠的侧脑室仍很粗,埋管位置与预定位置若有偏差可能会伤及脑内组织或是其他核团。以上实验过程的埋管数据是根据Paxinos和watson图谱决定的,适用于250~270 g左右体重的SD大鼠[11]。埋管旁开的位置为0.6 mm。(6)在手术过程中,术中用牙科钻将标记点钻开至硬脑膜,这个过程一定要轻慢,用针尖刺破硬脑膜至看到澄清脑脊液流出。用力不能过大,过大会损伤颅脑组织影响动物的判断力进一步影响实验效果。(7)在见到称其脑脊液流出之后下管之前要滴石蜡油封闭,因为石蜡油有两个作用,一是石蜡油可防止水分蒸发,对脑细胞有保护作用,二是石蜡油有润滑作用,有利于下管。(8)牙托粉将2颗螺丝和导管包裹固定在一起固定[11-14]。(9)因为核团区域小,药物吸收慢,所以在给药过程中,给药速度一定要慢,一般控制在1 μL/5 min,注药结束后要停留5~10 min再将注射内芯移除,这样有利于药物被充分吸收[10]。(10)术后颅脑顶部装有套管装置的大鼠要单笼饲养[10]。(11)大鼠术后恢复过程中始终要给套管插上堵丝,防止脑脊液返流堵塞套管,而且还要经常拔出堵丝保持管道通畅,便于笔者反复多次给药。
综上所述,本实验室成功的自行设计制作了双侧间距固定为1.6 mm的套管系统,恰好能够精准插入笔者试验的目标脑区即前扣带皮层,进而注射给药。此设计成本低,简单易操作,通过本方法,笔者可以根据实验的具体需求调节双管套管之间的距离以及套管的长度,以满足不同实验特定脑区的给药需求。
[1]张玉秋.痛情绪和相关记忆产生的神经机制[J].自然科学进展,2005,15(12):1409-1415.
[2] Zhang Y,Meng X.Electroacupuncture alleviates affective pain in an inflammatory pain rat model[J].European Journal of Pain,2012,16(4):
170-181.
[3] Zhang Y,Meng X Z.Acupuncture alleviates the affective dimension of pain in a rat model of inflammatory hyperalgesia[J].Neurochem Res,2011,36(5):2104-2110.
[4]董榕,张敏.侧脑室注射R-α-四基组胺对哮喘豚鼠呼吸道P物质样免疫反应物的影响[J].中国组织化学与细胞化学杂志,2003,12(2):166-170.
[5] Cao H,Gao Y J.Activation of extracellular signal-regulated kinase in the anterior cingulate cortex xontributes to the induction and expression of affective pain[J].The Journal of Neuroscience,2009,29(10):3307-3321.
[6] Dai R P,Li C Q.Biphasic activation of extracellular signal regulated kinase in anterior cingulate cortex distinctly regulates the development of pain-related anxiety and mechanical hypersensitivity in rats after incision[J].Anesthesiology,2011,115(45):604-613.
[7]高永静,赵志奇.前扣带皮层与痛觉信息加工[J].生理科学进展,2003,34(4):293-297.
[8]任文华.大鼠前扣带皮层吻侧部NMDA受体在痛厌恶情绪形成中的作用[D].上海:复旦大学,2007.
[9] Zhang L,Zhang Y Q.Anterior cingulate cortex contributes to the descending facilitatory modulation of pain via dorsal reticular nucleus[J].European Journal of Neuroscience,2005,22(14):1141-1148.
[10] Gao Y J,Ren W H.Contributions of the anterior cingulate cortex and amygdala to pain-and fear-conditioned place avoidance in rats[J]. Pain,2004,110(15):343-353.
[11] Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].Six edition.New York:Carlifomia Aeademic Press,2007:48-124.
[12] Joshua P,Johansen K,Howard L,et al.The affective component of pain in rodents: direct evidence for a contribution of the anterior cingulate cortex[J].PNAS,2001,98(14):8077-8082.
[13]于海明,王百忍.大鼠侧脑室置管方法的改良[J].神经解剖学杂志, 2005,20(2):207-211.
[14]靳艳卿,段世明.侧脑室注射河豚毒素和藜芦定对大鼠异氟醚MAC的影响[J].中华麻醉学杂志,2000,20(5):305-307.
The Cannulation and Administration Techniques with Home-made Double Cannula in the Anterior Cingulate Cortex in Rats
/FENG Xiao-pu, LAN K un,ZHANG Xiao-yi,et al.//Medical Innovation of China,2014,11(18):042-045
Objective:To catheter and administrate in bilateral anterior cingulate cortex (ACC) with homemade double cannula in rats in our experiment.Method:Firstly the double cannulas were made by ourselves, then under the guidance of the stereotaxic instrument, a double cannula was implanted in ACC region on the top of rats’skull, and was fixed with denture base resins and bolts. When the body weight of rats returned to normal after surgery, the needle connecting with the micro-injector was inserted into cannula, then the reagent was slowly pushed into ACC region by syringe pump. After the administration was finished, behavioral test could be started. Used this technique, local application of reagent in brain region might be repeated for many times. Result:The reagent was injected accurately into the bilateral ACC region. And during the experiment, the behavioral responses of rats were as desired. Conclusion:Home-made double cannula get a good effect in the experiment. The making process is simple, economic and reliable.
Anterior cingulate cortex ; Double cannula; Implanted tube; Rats
10.3969/j.issn.1674-4985.2014.18.014
2014-04-21) (本文编辑:蔡元元)
国家自然科学基金资助项目(81371254)
①山西医科大学 山西 太原 030001
张宇
First-author’s address:Shanxi Medical University,Taiyuan 030001,China

