颅内少突-星形细胞瘤的MRI影像学评价*
高明郭爱菊
颅内少突-星形细胞瘤的MRI影像学评价*
高明①郭爱菊②
目的:探讨颅内少突-星形细胞瘤的MRI特征和诊断价值。方法:对18例经手术病理证实的颅内少突-星形细胞瘤患者进行MRI影像回顾性分析。结果:(1)18例患者均行MRI平扫及增强检查,病灶多位于大脑半球且同时累及灰白质(86.95%),额叶8例,颞顶叶1例,顶枕叶2例,颞枕叶2例,岛叶2例,小脑1例,胼胝体及左侧侧脑室1例,第三脑室1例;多发病灶4例,单发病灶14例;WHO-2级10例,WHO-3级8例(间变性)。(2)MRI表现:肿瘤内部多见大小不等坏死灶或囊变区(86.95%),T1WI及T2WI信号不均匀,增强扫描病灶呈明显不均匀强化,实性部分轻至中度强化,囊变区无强化。结论:颅内少突-星形细胞瘤MRI影像学表现有一定特征性,但与少突胶质瘤鉴别比较困难,而囊变或坏死的发现有可能成为鉴别诊断的关键。MRI检查可明确病灶部位及范围,结合临床可以倾向性诊断。
少突-星形细胞瘤; 灰白质; 磁共振成像; 囊变; 坏死
混合性胶质瘤为起自神经上皮组织的一组恶性肿瘤,由于包含了少突胶质细胞、星形细胞和室管膜细胞等多种细胞成分,因此病理类型较多,其中少突-星形细胞瘤最常见[1]。近年来,少突胶质瘤及少突星形细胞瘤的正确诊断越来越受到神经医学界的重视[2-3]。因为相对于星形细胞瘤来说,大多数少突胶质瘤患者对放化疗敏感,生存期也较长,未能发现肿瘤组织中的少突胶质成分,可能会使患者接受不恰当的治疗或延误治疗。并且因少突-星形细胞瘤内含有少突细胞成分和星形细胞成分以及两者比例不同,影像学表现各异,使得术前正确诊断率较低[4]。本组收集2012年3月-2013年3月收治的18例经手术病理证实且MRI影像资料完整的少突-星形细胞瘤病例进行回顾性分析,总结其MRI影像特点,旨在进一步加深对于本病影像学特征的认识,提高影像诊断率。
1 资料与方法
1.1 一般资料 本组18例脑少突-星形细胞瘤患者均经手术病理证实,其中男11例,女7例,年龄2~62岁,平均33岁。就诊时主诉:抽搐、癫痫样发作4例,头痛8例(伴恶心呕吐4例),四肢无力、反应迟钝各1
例,星形细胞瘤术后复发演变为少突-星形细胞瘤3例,外伤后偶然发现1例。
1.2 影像学检查 所有患者均行MRI平扫及增强扫描。MRI采用Siemens TrioTim 3.0 T超导磁共振扫描仪行常规MRI平扫(T1flair、T2WI和DWI、SWI)及T1flair增强扫描,专用头颅线圈,行横轴位T1flair(TR 220 ms/TE2.46 ms),T2WI(TR 3000 ms/TE 113 ms),矢状位SE T1flair(TR 220 ms/TE 2.46 ms),SWI(TR 27 ms/TE 20 ms)。增强扫描采用静脉团注Gd-DTPA,剂量为0.1 mmol/kg,作轴位、矢状位SE T1flair扫描,采用256×256矩阵。
1.3 图像分析 由2名高年资神经影像学医师联合分析肿瘤的形态、部位、病变范围、肿瘤边界、信号特点、瘤周水肿、强化程度等信息。
2 结果
2.1 病灶的基本影像特征
2.1.1 发生部位 18例患者共23个病灶,其中位于大脑半球20个(额叶8个,颞叶3个,顶叶3个,枕叶4个,岛叶2个),占86.95%,肿瘤累及脑灰白质,靠近脑表面,边界不清;胼胝体及侧脑室1个(4.35%),第三脑室1个(4.35%),小脑1个(4.35%)。
2.1.2 病灶形态 分为不规则团块状、类圆形及类椭圆形,边界不清,本组以不规则团块状多见(图1、图6、图7),共12个(52.17%);其次为类圆形6个(26.09%)(图4、图5);类椭圆形为5个(21.74%)(图2、图3)。
2.1.3 水肿范围 以瘤水肿最大厚度小于3 mm为轻度水肿,瘤水肿最大厚度大于3 mm为中重度水肿,本组23个病灶9例瘤周中重度水肿(39.13%),其中5例为间变性;4例瘤周轻度水肿,其中2例为间变性;10例瘤周无水肿(43.48%),其中1例为间变性。
2.2 病灶的MRI信号特征 所有患者均行MRI平扫及增强检查,23个病灶平扫T1WI呈高低混杂信号4个(17.39%),呈等低混杂信号18个(78.26%),呈低信号1个(4.35%),T2WI呈稍高信号或高信号19个(82.61%),T2WI呈高低混杂信号4个(17.39%);增强扫描肿瘤实性部分明显不均匀强化13个(56.52%),轻度不均匀强化4个(17.39%),无明显强化6个(26.09%)。肿瘤内部可见坏死灶或囊变区共20个病灶(86.95%),坏死灶或囊变区大小不一(图6、图7);无坏死者2个(8.70%)(图5);钙化或出血5个(21.74%)(图1、图6)。
图8为本组1例病理结果,少突星形细胞瘤(WHO-Ⅲ级),免疫组化:GFAP(+/-)、oligo-2(+)、Neu N(-)、NF(-)、Ki67(约20%)、SYN(弱+)、CgA(-)、CK(-)、CD99(-)、EMA(-)、S-100(+/-)。
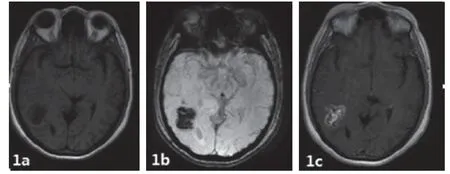
图1 右侧颞叶少突星形细胞瘤WHO-Ⅲ级,T1WI呈等低混杂信号,SWI示弥漫性低信号,提示瘤内钙化及出血,增强后明显不均匀强化
3 讨论

图3 胼胝体及左侧侧脑室少突星形细胞瘤WHO-Ⅱ级,类椭圆形长T1信号影,其内信号不均,未见明显强化

图4 小脑蚓部少突星形细胞瘤WHO-Ⅱ级,T1不规则团片状混杂信号影,增强明显不均匀强化
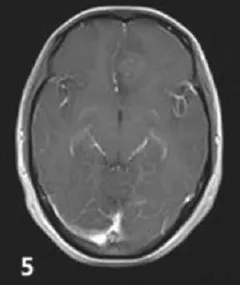
图5 左侧额叶少突星形细胞瘤WHO-Ⅱ级,团片状稍长T1信号影,增强轻度不均匀强化
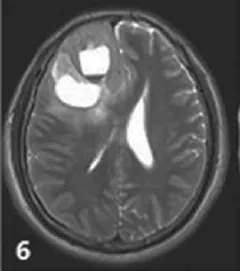
图6 右侧额叶少突星形细胞瘤WHO-Ⅲ级,团片状高、等、低混杂T2信号影,内见液液平面,提示囊变、坏死、出血
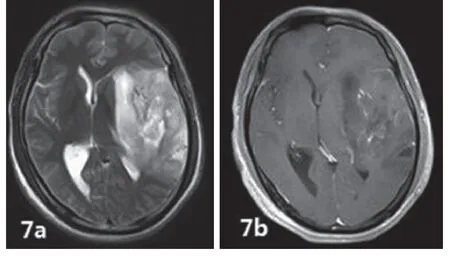
图7 左侧颞叶少突星形细胞瘤WHO-Ⅲ级,不规则团块状等、长混杂T1及T2信号影,不均匀中度强化,内见小灶性坏死、囊变
3.1 少突-星形细胞肿瘤的基本特征 少突星形细胞瘤被界定为同一肿瘤组织中同时含有瘤样少突胶质细胞和星形细胞两种成分,从肿瘤的组织形态特点出发,少突星形细胞瘤可分为二相型及弥漫型两种类型,二相型是指星形细胞及少突胶质细胞成分分别独立存在于同一肿瘤组织中,两者之间有明显分界;而在弥漫型肿瘤中,这两种细胞成分相互渗透,混合生长,没有分界[5]。少突-星形细胞瘤细胞形态类似少突胶质细胞瘤和弥漫型星形细胞瘤,组织学上多数相当于WHOⅡ级,但是本组18例患者中有8例为WHOⅢ级(其中5例为星形细胞成分发生间变性转化,3例为少突胶质细胞成分发生间变性转化),临床工作中值得注意。2007年WHO中枢神经系统肿瘤病理分类将Ⅲ级间变性胶质瘤分成3个亚型,即AO、AOA及AA。其中AOA作为一种混合型胶质瘤,由于缺少客观的分子诊断依据,临床上在该亚型的病理诊断上存
在很大程度的主观性,从而造成了临床上对Ⅲ级间变性胶质瘤个体化治疗的错误指导[6]。有研究表明,不同病理学专家在AOA形态学病理诊断的一致率极低[7-8]。因为临床活检的肿瘤标本往往只是肿瘤的一小部分,不能代表全部肿瘤组织。因此所截取的肿瘤标本中星形细胞成分占多大比例才可诊断为少突星形细胞瘤各家意见各不相同,从1%到25%,甚至50%,很明显这些诊断标准带有很强的主观性[9-10]。AOA病理诊断上的主观性势必会导致其临床治疗上的差异,从而导致其预后的异质性。Winger等[11]与Miller等[12]发现,AO患者的预后显著优于AOA及AA(P<0.05),而AOA与AA患者预后差异无统计学意义(P>0.05)。然而,Tortosa等[13]及Shirai等[14]发现AOA患者的预后与AO比较差异无统计学意义(P>0.05)。因此本病术前影像学诊断的正确分型对临床诊疗有重要的提示意义。

图8 本组1例病理结果
3.2 脑内原发性少突-星形细胞瘤的MRI特征 少突星形细胞瘤可发生于脑内任何部位,好发于幕上,以额叶最多见,其次为颞叶、顶叶、丘脑、胼胝体、脑室、桥小脑角区及脑干[15],而且常跨叶生长,累及多个脑叶,其位置一般浅表,皮层常受累,这可能是OA易发癫痫症状的基础。本组病例中,8例(34.78%)少突星形细胞瘤位于额叶(图5~6),再次证明了额叶最多见这一点。
总结少突星形细胞瘤的MRI表现如下:(1)定位与形态:大脑半球较多见,好发于额叶,临近脑表面,灰白质均有受累。瘤体一般呈不规则团片状或呈类圆形、椭圆形,边界不清,可有明显水肿或无水肿。(2)大体结构:肿瘤可为囊实性或实性病灶,本组20个病灶(86.95%)有不同程度囊变或坏死区,坏死灶或囊变区位于中央者多较小,与实性成份分界不清,位于外周者多较大(图6~7),与实性成份分界较清晰;(3)信号与血供:肿瘤T1及T2信号不均匀,增强扫描病灶实性成分多数呈轻度或明显不均匀强化,少数无明显强化,少数伴有脑膜强化,囊变或坏死区无强化,部分病灶有钙化,少数可以合并出血。
3.3 鉴别诊断
3.3.1 少突胶质细胞瘤 发病部位与本病相仿,边界一般较清,信号较均匀,病灶周围水肿少见或不明显,囊变或坏死相对少见,曲条状钙化多见。White等[16]认为少突胶质瘤较为特征性的强化方式为结节样强化。少突-星形细胞瘤一般肿瘤体积较大,内部信号不均匀,常可有囊变或坏死,偶见条片状钙化,增强后呈多不均匀明显强化或不强化,病灶周围水肿较常见,卢晓丹等[17]认为,癫痫发生率、囊变、水肿明显、占位效应明显、环形强化及明显强化,在OA级别判定时有一定的参考价值。此外,据李威等[18]报道认为,OA2的钙化更常见且形态多样,可为斑片状、条带状或细小点状,而AOA多为斑片状和点状;均与典型的OD常见而经典的脑回样及条带状钙化灶略有不同;并且OA占同期颅内胶质瘤的构成比明显高于OD,当两者鉴别诊断困难时应倾向于OA的诊断。
3.3.2 低级别星形细胞瘤 多位于脑白质深部,MRI信号多较均匀,增强后无或轻度强化,无或轻度瘤周水肿;间变性星形细胞瘤,MRI信号多不均,囊变多见,增强后明显不均匀强化,可有中、重度瘤周水肿,钙化相对少见。与本病鉴别关键在于病灶的位置及强化程度。
3.3.3 节细胞胶质瘤 主要见于儿童及青少年,主要见于幕上大脑半球,以颞叶最常见,肿瘤常见囊变,甚至完全囊变,可仅由单个或多个囊组成,囊壁出现钙化结节常提示该肿瘤,囊壁轻中度强化,肿瘤边界常清晰。赵殿江等[19]认为,儿童或青少年患者、临床表现为癫痫、发生于脑皮层、尤其是位于颞叶的肿瘤,如影像表现为囊性或囊实性、无水肿或轻度水肿、有钙化、结节有强化,高度提示节细胞胶质瘤。与本病鉴别关键在于病灶的强化程度及边界关系。
3.3.4 颅内单发淋巴瘤 大多位于大脑半球,靠近脑表面或中线,多呈长圆形、类圆形或不规则团块状,T2WI呈等或稍高信号,DWI呈高信号,增强扫描大多数病灶呈明显较均匀强化,部分可有小片状坏死、囊变,较大肿块可呈“握拳状”强化,肿瘤边缘多见“脐凹征”、“缺口征”或“尖角征”[20]。与本病鉴别关键在于病灶信号的均匀程度、强化程度及DWI高信号。
3.3.5 胚胎发育不良性神经上皮瘤(DNET) 好发于儿童及青少年,颞叶多见,累及皮质,有时见多发小囊变区,肿瘤通常不强化。武春雪和高培毅[21]认为,当患者年龄较小、病变可观察到多囊或脑回样结构、可见“三角征”、边界清晰、T2WI上呈高信号、无瘤周水肿或占位效应时,诊断更倾向于DNET。与本病鉴别关键在于病灶强化方式及程度。
3.3.6 脑实质型室管膜瘤 脑实质型室管膜瘤分为囊性、囊实性、实性,当病变位于侧脑室三角区附近,与脑室关系密切,瘤周水肿较轻且表现为实性时应想到脑实质内室管膜瘤的可能。与本病鉴别关键在于病灶和脑室间的关系密切与否。
总之,少突-星形细胞肿瘤多位于大脑半球,靠近脑表面,灰白质同时受累,常见钙化和囊变,MRI表现有一定特征性,但与少突胶质瘤鉴别相对困难,而囊变或坏死区有可能成为鉴别诊断的关键。结合临床及影像学表现,MRI可以做出倾向性诊断。
[1]章翔,易声禹,李安民,等.混合型胶质瘤的诊断与治疗[J].第四军医大学学报,1995,16(3):214-217.
[2]Central Brain Tumor Registry of the United States.Statistical report:primary brain tumors in the United States,1995-1999[R].Chicago,IL:Central Brain Tumor Registry of the United States,2002.
[3]Burger P C,Vogel F S,Seheithauer B W.Surgical pathology of the nervous system and its coverings[M].4th ed.New York,NY:Churchill Livingstone,2002:1-5.
[4]李少朋,钱银锋,余永强,等.少突-星形细胞肿瘤的CT和MRI表现[J].中国医学影像技术,2011,27(6):1125-1128.
[5]Kleihues P,Cavanee W K.Pathology and genetics of tumors of the central system.World Health Organization Classification of Tumors[R]. Lyon:IARC Press,International Agency for Research on Cancer (IARC),2000.
[6]蒋海辉,任晓辉,张哲,等.间变星形细胞少枝胶质细胞肿瘤分子病理亚型分类研究[J].中华外科杂志,2013,51(12):1104-1109.
[7]Kros J M,Gorlia T,Kouwenhoven M C,et al.Panel review of anaplastic oligodendroglioma from European organization for research and treatment of cancer trial 26 951:assessment of consensus in diagnosis, influence of 1p/19q loss, and correlations with outcome[J].J Neuropathol Exp Neural,2007,66(6):545-551.
[8]Smith J S,Perry A,Borell T J,et al.Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas,astrocytomas,and mixed oligoastrocytomas[J].J Clio Oncol,2000,18(3):636-645.
[9]Reifenberger G,Kros G M,Burger P,et al.Oligoastroeytoma.In:Kleihues P,Cavenee W K,eds.Tumours of the Nervous System. Pathology and Genetics[M].Loyon:IARC Press,2000:55-67.
[10] Krouwer H G,van Duinen S G,Kmaphorst W,et al.Oligoastroeytmoas:a clinicopathological study of 52 cases[J].J Neurooncol,1997,33(3):223-238.
[11]Winger M J,Macdonald D R,Cairncross J G.Supratentorial anaplastic gliomas in adults.The prognostic importance of extent of resection and prior low-grade glioma[J].J Neurosurg,1989,71(4):487-493.
[12]Miller C R,Dunham C P,Scheithauer B W,et al.Significance of necrosis in grading of oligodendroglial neoplasms:a clinicopathologic and genetic study of newly diagnosed high-grade gliomas[J].J Clin Oncol,2006,24(34):5419-5426.
[13]Tortosa A,Vinolas N,Villa S,et al.Prognostic implication of clinical,radiologic,and pathologic features in patients with anaplaslic gliomas[J].Cancer,2003,97(4):1063-1071.
[14]Shirai K,Suzuki Y,Okamoto M,et al.Influence of histological subtype on survival after combined therapy of surgery and radiation in WHO grade 3 glioma[J].J Radiat Res,2010,51(5):589-594.
[15]刘才保,肖华亮,陈金华,等.脑少突胶质肿瘤MRI表现与病理组织学分级的关系[J].第三军医大学学报,2011,33(22):2402.
[16]White M L,Zhang Y,Kieby P,et al.Can tumor contrast enhancement be used as a criterion for differentiating tumor grades of oligodendrogliomas?[J].AJNR Am J Neuroradiol,2005,26(4):784-790.
[17]卢晓丹,陈燕萍,周和秀,等.37例少突星形细胞瘤临床及MRI表现与病理分级关系[J].临床放射学杂志,2013,32(5):617.
[18]李威,张云亭,陈述花,等.混合性胶质瘤的影像学表现[J].临床放射学杂志,2004,23(2):104.
[19]赵殿江,朱明旺,杜铁桥,等.脑节细胞胶质瘤的MRI表现及鉴别诊断[J].中国医学影像技术,2010,26(9):1667-1669.
[20]郭爱菊,高明.脑原发性淋巴瘤的MRI影像学特征[J].中国医学创新,2013,10(30):91-92.
[21]武春雪,高培毅.脑内胚胎发育不良性神经上皮瘤与低级别星形细胞瘤的MRI比较研究[J].放射学实践,2012,27(3):279-283.
Evaluation of MRI Image of Intracranial Oligoastrocytomas
/GAO Ming,GUO Ai-ju.//Medical Innovation of China,2014,11(18):001-005
Objective:To investigate MRI features and diagnostic value of oligoastrocytomas.Method:MRI findings pathologically proved oligoastrocytomas of 18 patients were retrospectively analyzed.Result:(1)18 patients underwent plain and enhanced MRI examination,lesions located in the cerebral hemisphere and at the same time more involvement of gray matter(86.95%),frontal lobe in 8 cases,1 case of temporal lobe,occipital lobe in 2 cases,temporal and occipital lobe in 2 cases,2 cases of insular lobe,1 case of cerebellum,1 case of corpus callosum and the left lateral ventricle,1 case of the third ventricle.4 cases with multiple lesions,14 cases with single lesion.In 18 cases,10 of oligoastrocytomas were proved to be WHO gradeⅡ,8 of oligoastrocytomas were proved to be WHO grade Ⅲ.(2)MRI manifestation:Ranging from the size of the focal necrosis or cystic area were often seen in tumors(86.95%),T1WI and T2WI signal were not uniform,enhanced scan showed obvious heterogeneous enhancement,the solid part of light to moderate enhancement,cystic areas without enhancement.Conclusion:It is difficult to differentiate oligo-astrocyte mixed gliomas with pure oligodendrogliomas,because both of them have similar imaging manifestations.However,a suggestive diagnosis can be made when both clinical data and imaging features are taken into account,especially when cystic degeneration or necrosis has been found.
Oligoastrocytomas; Gray and white matter; Magnetic resonance imaging; Cystic degeneration; Necrosis
10.3969/j.issn.1674-4985.2014.18.001
2014-03-26) (本文编辑:欧丽)
国家重点专科建设基金资助(132102310063)
①河南省人民医院 河南 郑州 450003
②河南省中医院
郭爱菊
First-author’s address:The People’s Hospital of Henan Province,Zhengzhou 450003,China

