有氧运动联合膳食控制对2型糖尿病大鼠血液流变学的影响及其机制
梁廷方,单承湘
(1.扬州职业大学体育学院,江苏扬州 225012;2.扬州大学体育学院,江苏扬州 225009;3.扬州市育才小学西区校,江苏扬州 225000)
糖尿病(diabetes mellitus,DM)是一组由遗传和环境因素相互作用而引起的临床综合症,它以高血糖为特征,可导致多种并发症。由于糖、脂肪和蛋白质代谢紊乱,患者可出现微血管病变和微循环障碍[1]。研究表明,血液流变学改变引起的组织缺氧等可能与微血管病变的发生和发展有关。而糖尿病病人血液流变性的改变主要表现在红细胞数量增加、红细胞聚集性增强和红细胞变形性的降低[2]。虽然运动和膳食控制是治疗2型糖尿病(Type 2 diabetes mellitus,T2DM)的重要手段,但是长期的有氧运动和膳食控制对糖尿病机体血液流变学的影响的研究目前甚少。本研究通过给大鼠喂饲高脂膳食的基础上腹腔注射小剂量的STZ复制T2DM大鼠模型,并给予有氧运动锻炼或/和膳食控制,13周后测定血液流变性以及血糖(Fasting plasma glucose,FPG)、糖化血清蛋白(Glycated Serum Proteins,GSP)、甘油三酯(Triglyceride,TG)和总胆固醇(Total cholesterol,TC)的含量,旨在探讨有氧运动联合膳食控制对T2DM大鼠血液流变学的影响,并探讨血液流变学改变的机制,为进一步探讨T2DM的运动和膳食干预的机制提供实验依据。
1 材料与方法
1.1 实验动物与分组
清洁级雄性SD大鼠62只,购于上海斯莱克实验动物有限责任公司[生产许可证号 SCXK(沪)2007-0005,合格证号0045386],6周龄,体重160~200g。随机抽取8只大鼠作为正常对照组(C组),喂以标准普通饲料。其余54只喂以高脂高糖饲料。7周后,禁食10h,按30μg/kg体重的剂量腹腔注射1%STZ溶液。注射7天后,空腹尾静脉采血,用快速血糖仪测定大鼠空腹血糖,以血糖≥7.8 mol/L作为T2DM大鼠的入选依据,有39只大鼠建模成功。然后将T2DM大鼠随机分成DM对照组(DMC,n=9)、DM+运动锻炼组(DME,n=10)、DM+膳食控制组(DMD,n=10)和 DM+运动锻炼 +膳食控制组(DMED,n=10)4组。大鼠分笼饲养,每笼4只,饲养温度25℃±2℃,光照时间12 h左右,每天更换一次垫料,保持笼内干燥。
1.2 实验方案
C组:国家标准齿类饲料饲养,不进行游泳运动锻炼;DMC组:喂饲高脂高糖饲料,不进行运动锻炼;DME组:在喂饲高脂高糖饲料的同时,在每天下午进行60min无负重游泳运动,每周运动6天。第1周进行适应性游泳训练,第一天运动时间为15min,以后每天递增10min~20min,经1周增加至每天60min,以后每周维持此运动量,持续运动12周;DMD组:喂饲与DM组等量的标准饲料,不进行运动锻炼;DMED组:在喂饲与DM组等量标准饲料的同时,再按照DME组的运动方案进行运动锻炼。运动时注意大鼠状态,以防止溺水死亡,并及时捞出大鼠粪便,以保持游泳池水清洁。游泳池为100cm×70cm×60cm的长方体,水深50cm,水温32℃ ±1℃。高脂高糖饲料按照66.5%基础饲料、10%猪油、2.5%胆固醇、1%猪胆盐和20%蔗糖的配方由南京安立默生物科技公司加工制作。每天分2次定时喂食,实验过程中由于操作不当,DMED组和DMD组分别有2只和3只大鼠死亡。
1.3 实验取材
动物在末次运动锻炼结束后,禁食12h,第二天晨依次按50mg/kg的剂量腹腔注射2%的戊巴比妥钠进行麻醉后,从腹主动脉取血5ml,首先将2ml的血液放入肝素抗凝管中,轻轻摇匀,在2h内测定血液流变学的指标。其余血液注入无菌玻璃试管中,在1h内,4℃,4000r/min离心10min后,分离血清,在2h内测定FPG、GSP以及血液中TG和TC含量。
1.4 指标测试
血液流变学指标采用LBY-N6A型旋转式黏度计测定;FPG采用葡萄糖氧化酶法测定,TG、TC和GSP采用酶比色法测定,仪器为日立全自动生化分析仪。
1.5 统计学分析
使用SPSS13.0统计软件处理数据,结果用均数±标准差表示,DMC组与 C组之间采用独立样本 t检验,DMC、DME、DMD、DMED4组进行双因素方差分析,P≤0.05有显著性差异,P≤0.01有非常显著性差异。
2 结果
2.1 各组大鼠血液流变学指标的变化
2.1.1 各组大鼠不同切变率下全血粘度值的变化
由表1可见,T2DM建立后第13周,与C组相比,DMC组大鼠不同切变率下的全血粘度值均有所升高,其中切变率为30和切变率为5时的全血粘度值差异显著(P=0.01)。双因素方差分析显示,12周的游泳训练可使T2DM大鼠切变率为1时的全血粘度显著降低(P<0.01),其它切变率下的全血粘度有所降低,但无显著性差异;而膳食控制对T2DM大鼠不同切变率下的全血粘度无显著性影响,有氧运动和饮食控制对切变率为1时的全血粘度具有显著的交互作用(P<0.05)。
2.1.2 各组大鼠血浆粘度、ESR、全血还原粘度的变化
由表2可见,T2DM建立后第13周,与C组相比,DMC组大鼠血浆粘度、全血高切还原粘度显著升高(P<0.01,P<0.05)、全血低切还原粘度有所升高,但无显著性差异,ESR显著降低(P<0.05)。双因素方差分析显示,12周的游泳训练可使T2DM大鼠高切还原粘度和低切还原粘度极显著降低(P<0.01),ESR显著升高(P=0.05);血浆粘度有所降低,但无显著性差异。膳食控制可使T2DM大鼠ESR有所升高,血浆粘度及全血高切、低切还原粘度有所降低,但差异不显著。有氧运动联合饮食控制对进一步降低T2DM大鼠血浆粘度、全血高切、低切还原粘度,进一步升高ESR,具有显著的交互作用。
2.1.3 各组大鼠红细胞压积、聚集指数、刚性指数、变形指数的变化
由表3可见,T2DM建立后第13周,与C组相比,DMC组大鼠红细胞聚集指数、刚性指数均显著性升高(P<0.01,P<0.05),红细胞变形指数显著降低(P<0.05),红细胞压积没有显著性差异。双因素方差分析显示,12周的游泳训练或膳食控制后T2DM大鼠红细胞聚集指数显著降低,但红细胞压积、红细胞刚性指数和红细胞变形指数均无显著性变化。有氧运动联合饮食控制对降低红细胞聚集指数和升高变形指数具有显著的交互作用(P<0.01)。
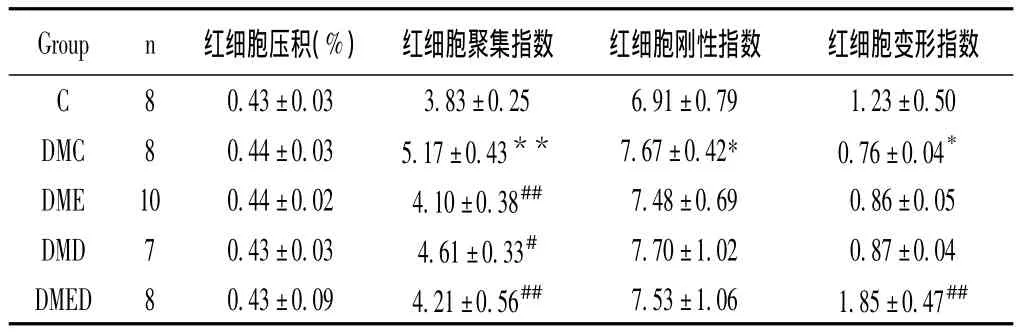
表3 各组大鼠红细胞压积、聚集指数、刚性指数、变形指数的变化
2.2 各组大鼠FPG、GSP和TG、TC含量的变化
由表4可见,T2DM建立后第13周,与C组相比,DMC组FPG、GSP以及TC、TG含量均极显著性升高。双因素方差分析显示,12周的游泳训练能显著降低T2DM大鼠FPG、GSP和TC含量,但不能显著降低TG含量。膳食控制均能显著降低T2DM大鼠血清GSP、TG和TC含量。有氧运动联合膳食控制对进一步降低T2DM大鼠血清TC含量具有显著的交互作用,但对进一步降低T2DM大鼠FPG、GSP和TG含量均没有显著的交互作用。
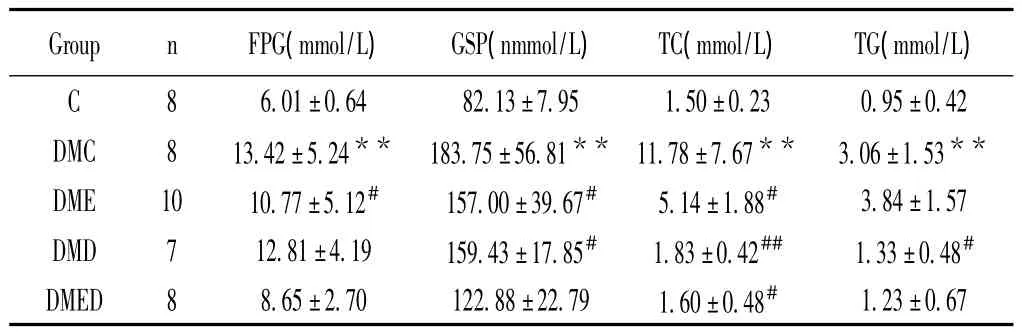
表4 各组大鼠FPG、GSP和TG、TC含量的变化
3 讨论
3.1 T2DM血液流变学的变化及其有氧运动和膳食控制的干预作用
血液的流变特性及其在各种生理和病理情况下的改变,是心血管系统,特别是心脏动力功能和组织供氧的决定因素之一。不少研究证明,糖尿病患者出现不同程度的高粘滞血症[1-4]。为了进一步研究T2DM患者血液流变学的变化,本研究给SD大鼠喂饲高脂膳食并结合小剂量的STZ建立大鼠的2型糖尿病模型,测定了血液的流变学指标。结果发现,T2DM模型建立后第13周,与C组大鼠相比,DMC组大鼠在不同切变率下的全血粘度均有所升高,其中切变率为30和切变率为5时的全血粘度有显著差异(P<0.05)。而血浆粘度、全血高切还原粘度显著升高(P<0.01,P<0.05),ESR显著降低(P<0.05),全血低切还原粘度有所升高,但无显著性差异。与此同时,DM组大鼠红细胞聚集指数、红细胞刚性指数均有显著性升高(P<0.01,P<0.05),红细胞变形指数显著降低(P<0.05)。由于高切变率下的全血粘度主要是由红细胞变形性产生,高切粘度高反映红细胞变形能力或弹性差或血管壁硬化、毛糙;低切变率下的全血粘度主要是红细胞聚集决定的,低切粘度高反映红细胞的聚集性增高;而血浆蛋白的含量尤其是纤维蛋白含量决定血浆粘度的高低,纤维蛋白原增多特别是其活性增强时,能直接提高血浆粘度。红细胞聚集指数表示红细胞聚集程度,是反映红细胞聚集性及程度的一个客观指标。全血还原粘度是指全血粘度与血细胞容积浓度之比,意义与全血低切粘度相同。红细胞变形能力对组织吸氧有着独特而重要的作用,只有红细胞变形能力处于良好状态时,红细胞才能通过比其直径小的毛细血管,红细胞携带氧的功能才能充分发挥出来[5-7]。从而说明,T2DM患者在一定程度上出现高粘滞血症,表现为高粘、高聚和高凝状态。
众多研究证明有氧运动和膳食控制是治疗T2DM的重要手段,但有氧运动和膳食控制干预对T2DM血液流变学的影响的相关研究比较少见。张见平等研究了运动治疗对糖调节受损患者血液流变学和甲襞微循环的影响,结果发现,糖调节受损患者经过6个月的运动治疗和适当的饮食控制,血糖、全血粘度、红细胞压积、纤维蛋白原和甲襞微循环加权积分值均较干预前显著降低。提示运动治疗可有效降低糖调节受损患者血粘度,改善自身微循环,延缓糖尿病和并发症的发生[8]。为了研究有氧运动和膳食控制对T2DM大鼠血液流变学的干预作用及其交互作用,本研究采用交互设计的实验方案,在T2DM大鼠建模成功后,对其分别进行了12周、每天60min无负重的游泳锻炼、膳食控制和游泳锻炼联合膳食控制。通过双因素方差分析可知,12周的游泳训练可使T2DM大鼠全血低切粘度(切变率为1s-1)、全血高切、低切还原粘度、红细胞聚集指数显著降低,ESR显著升高(P=0.05),其它流变学指标虽有改善,但无显著性差异(P<0.05);膳食控制可使T2DM大鼠血浆粘度和红细胞聚集指数显著降低,其他指标都有所改善,但无显著性差异。有氧运动联合饮食控制对进一步降低T2DM大鼠全血低切粘度、血浆粘度、全血高切、低切还原粘度以及细胞聚集指数,进一步升高ESR和红细胞变形指数,具有显著的交互作用。从而表明在T2DM的治疗中,长期的有氧运动锻炼对改善T2DM大鼠的血液流变性具有较好的作用,单纯的膳食控制对改善T2DM患者血液流变学特性的效果并不显著,与此同时,有氧运动联合膳食控制对改善T2DM大鼠血液流变性的效果比单纯运动或膳食控制干预更好。因此,长期的有氧运动联合膳食控制能显著改善T2DM患者血液流变学指标,尤其是能显著改善红细胞聚集性和变形能力,对防治T2DM及其慢性病变的发生发展,减少和减轻T2DM患者血管并发症的发生,有着十分重要的意义。
3.2 有氧运动和膳食控制改善T2DM血液流变学的机制
不少研究表明,糖尿病患者血液流变学的改变与糖脂代谢紊乱有关[9-18],高血糖和高血脂可直接影响血液的流速及血液的粘滞性和凝聚性,是冠心病、动脉硬化、脑梗塞等疾病的危险因素。由于糖为碳水化合物,本身具有高粘度,又带有少量电荷基团,吸附于红细胞表面,使表面电荷减少,红细胞与血浆之间电动电位降低,从而导致血浆粘度升高[12]。另外,长期的高血糖致使蛋白质非酶糖基化反应加速,一方面可以改变红细胞膜上的脂蛋白成分,另一方面红细胞内大量的血红蛋白被糖基化形成糖化血红蛋白,使红细胞的弹性降低和脆性增加,导致变形能力下降[13-15]。与此同时糖化血清蛋白含量增高,容易吸附于红细胞表面,使红细胞膜电性受到破坏,红细胞表面负电荷减少,使红细胞呈缗钱状排列,聚集性增强,从而促进红细胞的聚集,导致血液粘滞性增高。这些变化可明显增大血流阻力,导致血流减慢和红细胞代谢异常,血液运输营养物质和氧的功能减低,引起组织缺氧。组织缺氧一方面使红细胞代偿性增生,造成全血粘度的增高[16]。另一方面促使大量脂肪酸和氨基酸从脂肪组织和肌肉组织中动员出来,刺激肝脏合成纤维蛋白原[3]。血浆中纤维蛋白原增加,凝血功能相对亢进,导致血浆黏度增加,进一步加重了红细胞聚集,是导致血液低切粘度增加的主要原因[15]。血液中TG、TC含量的升高,一方面可引起细胞膜的脂质构成发生变化,尤其是胆固醇/磷脂比值增加,致使红细胞膜硬度、厚度增加,导致红细胞变形能力下降,致使血黏度增加;另一方面使红细胞和血小板表面电荷下降,红细胞聚集性增强,串联成堆成簇,引起血液粘度增高[17,18]。为了进一步研究有氧运动和膳食干预影响糖尿病机体血液流变学的机制,本研究在给大鼠喂饲高脂膳食的基础上联合注射小剂量的STZ成功复制了T2DM大鼠模型,并给予有氧运动或/和膳食控制,在测定血液流变性的基础上测定了FPG、GSP、TG和TC含量。结果发现,T2DM建立后第13周,DMC组FPG、GSP以及TC、TG含量均极显著性地高于C组。通过双因素方差分析可知,有氧运动能显著降低T2DM大鼠FPG、GSP和TC含量,但不能显著降低TG含量。膳食控制均能显著降低T2DM大鼠血清GSP、TG和TC含量。有氧运动联合膳食控制对进一步降低T2DM大鼠血清TC含量具有显著的交互作用;虽然使T2DM大鼠FPG、GSP和TG含量进一步降低,但没有显著的交互作用。由于血清中葡萄糖含量极不稳定,易受饮食、药物、情绪等诸多因素影响,有时不能客观反映人体内葡萄糖真正水平,而人体中的葡萄糖与血清蛋白发生非酶促反应,形成结构稳定的糖化血清蛋白,由于白蛋白的半衰期为17~20d,因此,糖化血清蛋白可以反映测定前2~3周内的平均血糖水平,不受即时血糖浓度的影响,可作为评价糖尿病近期内控制的一个灵敏可靠的指标[19]。因此,糖尿病机体出现了严重的糖脂代谢的紊乱,而有氧运动和膳食控制可以显著地改善糖尿病大鼠的糖脂代谢,从而进一步说明,糖脂代谢的紊乱是导致糖尿病大鼠高粘滞血症的重要机制,长期的有氧运动和膳食控制可以通过改善糖尿病机体的糖脂代谢紊乱改善血液的流变性。
4 结论
4.1 2型糖尿病大鼠血液出现高粘滞血症,表现为浓、凝、聚、粘状态。有氧运动可以改善2型糖尿病大鼠的血液流变性,降低血液的高粘滞状态;单纯的膳食控制对改善2型糖尿病大鼠的血液流变性效果不大;有氧运动联合膳食在一定程度上对改善2型糖尿病大鼠的血液流变性效果更大。
4.2 糖脂代谢的紊乱是导致糖尿病大鼠高粘滞血症的重要机制,长期的有氧运动和膳食控制可以通过改善糖尿病机体的糖脂代谢紊乱改善血液的流变性。
[1]吕程,史敬林.II型糖尿病患者血液流变性的变化及意义[J]. 微循环学杂志,2001,11(2):51
[2]黄萍,李德奎,冯景,等.血液流变学检测指标在糖尿病防治中的作用[J].中国血液流变学杂志,2006,16(2):284-285
[3]姚颖,张蔷.2型糖尿病患者血液流变学分析[J].中国慢性病预防与控制,2011,19(4):420-421
[4]张凤侠,赵玉秋,石豪,等.糖尿病血液流变学指标检测分析[J]. 中国误诊学杂志,2011,11(10):2308
[5]叶望云.血液流变学与微循环[J].微循环杂志,2000,10(4):19-22
[6]吴洪,叶森,初晶学.69例脑梗死死亡患者的血液流变学分析[J]. 中国微循环,2004,8(2):107-108
[7]杨东晓,杨春晓,姒惠.脑梗死患者血液流变学测定及分析[J]. 中国血液流变学杂志,2006,16(1):75-76
[8]张见平,许玲华,武焱旻,等.运动治疗对糖调节受损患者血液流变学和甲襞微循环的影响[J].中国血液流变学杂志,2008,18(3):363 -364
[9]杨洪彩,王晓华.糖尿病患者血液流变学和血糖的相关性分析[J]. 中华实践医学杂志,2005,27(4):235-239
[10]尹俊清,段玉蚕.糖尿病患者血糖浓度对血液流变学的影响[J]. 山西职工医学院学报,2010,20(4):28-29
[11]李苏亮.糖尿病患者血糖浓度对血流变学指标的影响[J]. 中国血液流变学杂志,2008,18(3):415-417
[12]孙朝晖,张洪福,张卫云,等.高血糖对血液流变学指标中黏度的影响[J].中国血液流变学杂志,2007,17(1):132-134
[13]高颖,周燕雯.社区患者血糖浓度与糖化血红蛋白、血脂和血液流变学的相关性[J].中国现代医生,2011,49(35):9-11
[14]李志勇,陈德智,程昌琴,等. HbA1c与血脂、血液流变学的相关性探讨[J]. 重庆医学,2011,40(20):2041-2042
[15]谢晓民.2型糖尿病患者全血黏度、血浆黏度、空腹血糖、糖化血红蛋白及血清瘦素的相关性分析[J].河北中医,2011,33(1):156 -157
[16]曾玉宇.糖尿病患者血液流变学指标分析[J].上海预防医学,2004,16(12):593 -595
[17]李欣.糖尿病患者的血液流变学与血脂检测分析[J].吉林医学,2011,32(3):465
[18]何英武.糖尿病患者血液流变学的临床分析[J].实用医技杂志,2007,14(1):44-45
[19]吴仕君.血糖、GSP、HbA1c联合检测在糖尿病控制中的应用[J]. 中国医药指南,2012,10(12):734-735

