南烛叶中乌饭成分的水提工艺优化及色素环境稳定性研究
陆芝娟,周 兵,李英华
(浙江经贸职业技术学院,浙江杭州 310018)
近年来,合成色素的非法或超标使用引发了诸多食品或化妆品安全事故。因此,开发研制天然色素,并利用天然色素代替人工合成色素已经成为食品、化妆品行业的发展新趋势[1]。目前,食品中的色素添加中,天然色素所占比例不足20%,因此越来越多的科研工作者研究从天然植物中提取天然色素并研究它们的稳定性[2-4]。南烛又称乌饭树(VacciniumbracteatumThunb)为杜鹃花科植物,在我国分布极广[5]。据本草记载乌饭叶应用历史悠久,能够益精气、强筋骨、明目、益肠胃和补骨髓等,并有报道指出乌饭叶具有促进视红素再合成、Vp样机能、改善血液微循环、抗溃疡、抗炎症、抗衰老、止泄、抗菌等多种生理活性[6-7]。乌饭树叶含有花青素、无羁萜、表无羁萜醇、β-谷甾醇、熊果酸、蓝黑色素、异荭草素、对羟基桂皮酸、内消旋肌醇、α-亚麻酸、乌索酸、齐墩果酸、三十一烷和鞣质等多种活性成分[8-9]。迄今为止,国内外关于南烛叶的研究尚未引起足够重视,尚属于未开发的植物资源。研究表明,乌饭色素是水溶性色素[10],故笔者以水为提取剂,通过单因素试验设计方法对南烛中乌饭色素的提取工艺进行优化,并研究色素不同应用环境的稳定性,以期为南烛的进一步开发利用提供依据。
1 材料与方法
1.1材料
1.1.1研究对象。南烛叶为采自浙江宁波郊区的山上的南烛灌木的枝叶。
1.1.2主要仪器。78HW-1数显恒温磁力搅拌器,购自杭州仪表电机有限公司;HH-2恒温水浴锅和Agilent 8453E紫外分光光度计,均购自Agilent公司;PHS-2C pH计,购自上海雷韵试验仪器制造有限公司。
1.1.3主要试剂。大米,购自杭州联华超市的五常米;NaOH、HCl等均为分析纯,水为娃哈哈纯净水,市售。
1.2方法
1.2.1南烛叶提取方法。将采集3 d以内的新鲜南烛叶用蒸馏水洗净后,用剪刀剪成0.5 cm宽、2.0 cm长的细条。称取一定质量的叶条于已经在水浴锅中预热至设定温度的一定体积的纯净水中,启动搅拌,并安装好冷凝回流装置,搅拌浸出一段时间后过滤,取滤液稀释至一定体积测定吸光度,以吸光度来代表色素的提取得率。
1.2.2单因素考察。(1)提取温度对乌饭成分提取得率的影响。精确称取洗净切好10.000 g乌饭叶,按料液比1∶10(W/V,g/ml,下同)加入蒸馏水,在温度为75、80、85、90、95和100 ℃下提取 90 min,过滤,取续滤液0.1 ml稀释到50 ml的容量瓶中,摇匀,在317 nm波长下测定吸光度,考察温度对提取得率的影响。(2)提取时间对乌饭成分提取得率的影响。精确称取10.000 g乌饭叶,按料液比1∶10(g/ml)加入蒸馏水,在85 ℃下浸提,时间分别为30、60、90、120和150 min,过滤,取续滤液0.1 ml稀释到50 ml的容量瓶中,摇匀,在317 nm波长下测定吸光度,考察时间对提取得率的影响。(3)料液比对乌饭成分提取得率的影响。精确称取10.000 g乌饭叶,在85 ℃下浸提,时间为90 min,按料液比分别为1∶5、1∶8、1∶10、1∶12和1∶15加入蒸馏水,过滤,取续滤液0.1 ml稀释到50 ml的容量瓶中,摇匀,在317nm波长下测定吸光度,考察料液比对提取得率的影响。
1.2.3工艺扩大对提取乌饭成分得率的影响。分别精确称取5.000、10.000、20.000、50.000和100.000 g乌饭叶,在85 ℃,时间为90 min,料液比位1∶10下浸提,取0.1 ml稀释到50 ml的容量瓶中,摇匀,进行测定,考察工艺扩大对提取乌饭成分的影响。
1.2.4乌饭色素成分环境稳定性研究。按照单因素试验中最佳提取工艺条件提取乌饭成分,冷却,分成4份,1份用盐酸调pH至4,1份用NaOH调pH至11,1份在85 ℃下加热,1份在室温下,分别于1、2、3、4和5 h测定其吸光值,观察乌饭成分在不同pH值和不同环境下的稳定性。并将试验溶液与大米共煮,观察煮熟后大米变黑的情况来验证乌饭成分的稳定性。
2 结果与分析
2.1单因素考察试验
2.1.1提取温度对乌饭成分提取得率的影响。图1表明,随着温度的增加,乌饭成分的提取得率增加。当温度超过85 ℃时,吸光度随温度的增加而下降。可能是由于温度高于85 ℃时,其稳定性下降所导致。

图1 提取温度对乌饭成分提取得率的影响
2.1.2提取时间对乌饭成分提取得率的影响。图2表明,从30~90 min,乌饭成分提取得率呈上升趋势。当超过90 min时,提取得率呈现稳定趋势。因此确定提取乌饭成分的最佳时间为90 min。

图2 提取时间对乌饭成分提取得率的影响
2.1.3提取料液比对乌饭成分提取得率的影响。图3表明,随着料液比的增加,乌饭成分的提取得率增加。当料液比为1∶10时,乌饭成分的提取得率最高;之后随着料液比的增加,提取得率变化不明显。因此确定乌饭成分提取的最佳料液比为1∶10。

图3 料液比对提取乌饭成分提取得率的影响
2.2工艺扩大对提取乌饭成分提取得率的影响图4表明,在试验范围内,随着提取工艺的放大,乌饭成分的提取得率变化不大。说明在工艺放大过程中,乌饭成分的提取得率基本未受影响,该提取工艺可以进行放大生产。
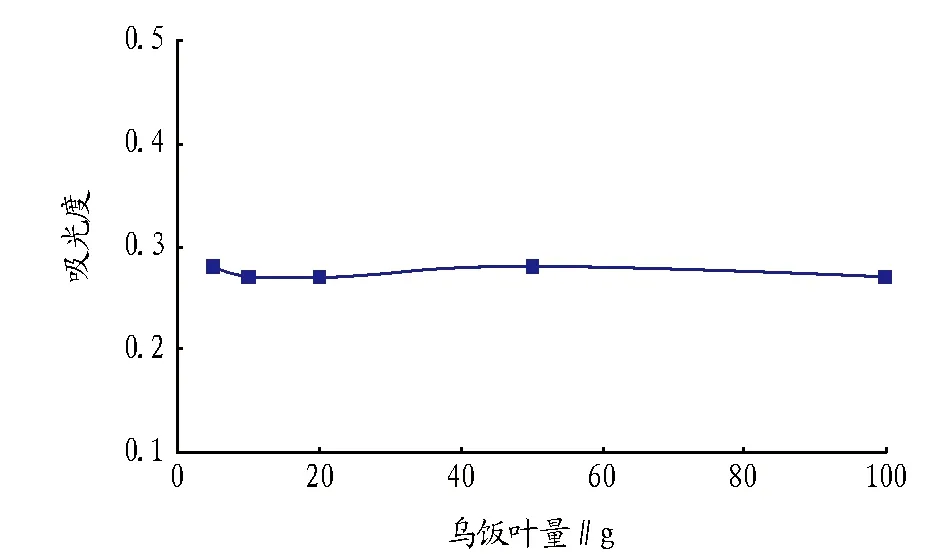
图4 工艺放大对提取乌饭成分提取得率的影响
2.3乌饭叶中乌饭成分的稳定性研究图5表明,在酸性溶液条件下,乌饭叶中的乌饭成分在3 h内稳定性较好;4 h后,其吸光度开始下降。在碱性溶液条件下,乌饭叶中的乌饭成分稳定性较差,随着时间的变化,吸光值逐渐降低。在室温条件下的稳定性大于85 ℃。和大米共煮后的试验现象也证明了乌饭成分在酸性条件、室温条件的乌饭效果要优于85 ℃条件,而碱性条件下的乌饭成分没有乌饭效果。因此,建议乌饭成分宜保存于室温和中性环境中,而碱性条件会破坏乌饭成分的乌饭效果。
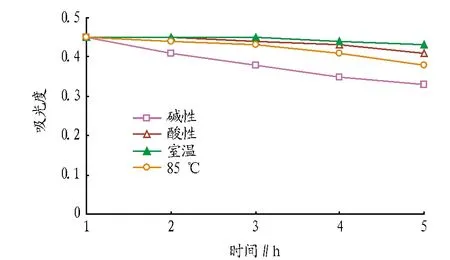
图5 不同环境下的乌饭成分稳定性
3 结论
南烛叶中乌饭成分的最佳提取工艺参数为:料液比1∶10 g/ml,提取温度85 ℃,提取时间为90 min;且工艺放大对产品提取得率影响不大。色素溶液在酸性和室温条件下较为稳定,而在高温和碱性条件下稳定性较差,在碱性环境中乌饭效果丧失。乌饭色素不宜在高温和碱性环境中保存。该研究为乌饭色素的开发利用奠定了理论基础。
[1] 杜鹃,吴津蓉,石秀花.玫瑰色素的化学成分研究[J].食品研究与开发,2012,33(4):137-143.
[2] 蓝德均,崔旭梅.大叶红草色素水提取工艺优化及色素环境稳定性研究[J].安徽农业科学,2012,40(26):13095-13096.
[3] 曾庆祝,陈陆欣,方细绢,等.苋菜红色素提取工艺及稳定性研究[J].广州大学学报:自然科学版,2012,11(4):25-30.
[4] 方樟彩,徐国华,钱超,等.辣椒红色素制备新工艺研究[J].高校化学工程学报,2012,26(1):105-111.
[5] 郝娟娟,冯建元,丁雨龙,等.不同种源乌饭树树叶营养成分比较[J].林业科技开发,2010,24(3):105-107.
[6] 王立,张雪彤,姚惠源.乌饭树树叶及其提取物对视网膜光损伤的保护作用[J].西安交通大学学报:医学版,2006,27(3):285-287.
[7] 章海燕,王立,张晖.乌饭树树叶不同提取物抑菌作用的初步研究[J].粮食与食品工业,2010,17(1):34-37.
[8] 张琳,李宝国,付红伟,等.乌饭树叶黄酮苷类成分研究[J].中国药学杂志,2009,44(23):1773-1776.
[9] 杨晓东,肖珊美,徐友生,等.乌饭树叶挥发油的GC-MS分析[J].生物质化学工程,2008,42(2):23-26.
[10] 王立,姚惠源.大孔吸附树脂纯化乌饭树树叶黑色素的研究[J].天然产物研究与开发,2006,18(1):20-24.

