复方海藻膳食纤维对糖尿病小鼠降血糖作用的研究
李耀冬,叶 静,肖美添
(华侨大学化工学院,福建厦门361021)
糖尿病以糖代谢紊乱为主要表现,具有较高的 致残率,成为影响人类健康的主要疾病之一[1]。膳食纤维由Hipsley于1953年提出,在保持消化系统的正常功能上起着重要作用。膳食纤维可以有效控制糖尿病血糖水平,增加外周组织对胰岛素敏感性,尤以可溶性膳食纤维的作用更加明显。
江蓠膳食纤维是由海洋红藻江蓠提取的一种水溶性膳食纤维,由D-半乳糖和3,6-L-脱水半乳糖通过β-1,4和α-1,3糖苷键交替连接而成的复合多糖[2],相比其他来源膳食纤维含有更多的亲水基团,其可溶性膳食纤维含量达80%以上,属高可溶性膳食纤维。江蓠膳食纤维可于肠道内形成水凝胶,延缓食糜进入十二指肠,减慢糖的吸收速率[3]。
江蓠膳食纤维能够降低糖尿病模型动物血糖,改善糖耐量并提高机体的抗氧化能力[4-6]。中药成分黄酮、多糖能够有效降低血糖,改善葡萄糖耐量(OGTT),促进胰岛素合成与分泌[7-11]。海藻酸钠是由β-古洛糖醛酸和β-甘露糖醛酸以α-1,4和β-1,4糖苷键连接且具有多种生物活性的多糖可溶性盐,广泛用作食品添加剂。研究表明,海藻酸钠具有降血糖作用,且可改善糖耐量,控制体重下降[12-13]。
目前,国内外针对膳食纤维的研究较多,但未见海藻膳食纤维与中药复配物降血糖作用的报道。本工作以江蓠膳食纤维为主要成分,海藻酸钠为助剂,以桑叶、葛根、黄芪提取物为辅料,通过构建糖尿病小鼠模型,研究复方海藻膳食纤维对糖尿病小鼠的降血糖作用,为海藻膳食纤维的开发提供科学依据。
1 材料与方法
1.1 材料与仪器
动物 清洁级昆明种小鼠,雄性,6~8周龄,体质量18~20g,上海斯莱克实验动物有限公司提供,动物合格证号为SCXK(沪)2012-0002;四氧嘧啶 Sigma;盐酸二甲双胍 中美上海施贵宝制药有限公司;江蓠膳食纤维 福建金燕海洋生物科技股份有限公司;海藻酸钠 明月海藻集团;葛根、黄芪、桑叶 亳州市中药饮片厂;其余 均为分析纯。
TE313S-DS电子天平 德国赛多利科学仪器有限公司;UV-1800紫外可见光分光光度计 上海美诺达仪器有限公司;L-550离心机 湖南湘仪离心机有限公司;R-3旋转蒸发仪 瑞士BUCHI有限公司;FD-1B-80冷冻干燥机 北京博医康实验仪器有限公司;葡萄糖测定试剂盒、高密度脂蛋白胆固醇试剂盒、低密度脂蛋白胆固醇试剂盒、总胆固醇试剂盒、甘油三酯试剂盒 北京北化康泰临床试剂有限公司。
1.2 实验方法
1.2.1 中药材提取实验 葛根100g,添加70%乙醇水溶液1.0L,80℃水浴加热回流提取1h,3次,提取液合并过滤;桑叶100g,添加70%乙醇水溶液1.0L,80℃水浴加热回流提取1h,3次,提取液合并过滤;黄芪100g,添加蒸馏水1.0L,水浴加热回流提取1h,2次,提取液合并过滤。提取液浓缩,浸膏-70℃预冻24h,冷冻干燥48h[11-16]。
1.2.2 糖尿病模型制备与分组 健康雄性昆明种小鼠120只,适应性饲养7d,体重20~22g。禁食不禁水12h,经尾静脉注射(i.v.)以冰生理盐水新鲜配制的四氧嘧啶(60mg/kg,0.1mL/10g)。5h后,灌胃50%葡萄糖溶液(0.3mL/10g),防止小鼠因血糖浓度过低死亡,自由进食、饮水。5d后禁食不禁水12h,眼眶内静脉取血测定血糖。选取血糖浓度为16~25mmol/L的糖尿病小鼠,按空腹血糖水平随机分为5组,高剂量组(HFP)、中剂量组(MFP)、低剂量组(LFP)、阳性对照组(POC)与模型对照组(MOC),每组10只。另选取10只血糖正常(3~6.1mmol/L)小鼠设为空白对照组(BLC)。
1.2.3 糖尿病小鼠降血糖实验 高、中、低剂量组小鼠,每天分别灌胃高、中、低剂量的复方海藻膳食纤维(高剂量复配物:江蓠膳食纤维400mg/kg,海藻酸钠240mg/kg,葛根提取物100mg/kg,桑叶提取物140mg/kg,黄芪提取物186mg/kg;中剂量复配物:江蓠膳食纤维200mg/kg,海藻酸钠120mg/kg,葛根提取物50mg/kg,桑叶提取物70mg/kg,黄芪提取物93mg/kg;低剂量复配物:江蓠膳食纤维100mg/kg,海藻酸钠60mg/kg,葛根提取物25mg/kg,桑叶提取物35mg/kg,黄芪提取物46mg/kg)0.1mL/10g。阳性对照组灌胃200mg/kg盐酸二甲双胍(0.1mL/10g),空白对照组与模型对照组灌胃等剂量生理盐水(0.1mL/10g)。
1.2.3.1 指标的测定 正常进食、饮水,饲养30d后称量每组小鼠体重。禁食12h,眼眶内静脉取血,采用试剂盒分别测定空腹血糖(FBG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、甘油三酯(TG)。
1.2.3.2 口服葡萄糖耐量(OGTT)的测定 禁食12h,各剂量组给予不同浓度海藻膳食纤维复配物,阳性对照组灌胃盐酸二甲双胍,模型对照组、空白对照组给予等剂量蒸馏水。20min后灌胃葡萄糖(2.0g/kg),测定0、30、60、120min血糖[17],葡萄糖耐量曲线下积分面积(AUC)计算方法为:0.25×(0min血糖浓度+4× 30min血糖浓度+3×120min血糖浓度)[18]。
1.2.3.3 胰腺组织结构的测定 手术摘取各组小鼠胰腺,固定于10%福尔马林溶液,用于制作HE染色切片[19],光学显微镜下观察胰腺的组织化学结构。
1.3 统计学处理
实验数据采用PASW Statistics 18软件进行方差分析,所有数据以±s表示,组间比较采用t检验,差异显著性p<0.05。
2 结果与讨论
2.1 不同剂量复配物对小鼠空腹血糖(FBG)以及体重的影响
葡萄糖是胰岛β细胞功能的调节剂,同时也是胰岛素释放的主要引发剂和增强剂[20]。糖尿病患者血糖水平明显升高,长期高血糖不仅会对胰岛β细胞结构与功能造成损伤,而且与慢性并发症的发生与发展明显相关。长期高血糖会导致细胞膜葡萄糖转运体2(GLUT-2)数量减少,使胰岛素释放机制中关键成分磷酸化程度减弱,最终导致胰岛素释放减少[21]。长期高血糖也使胰岛β细胞内葡萄糖代谢发生障碍,氧化应激水平增高,导致胰岛β细胞凋亡增加[22-23],进一步加强高血糖毒性作用。不同剂量海藻膳食纤维复配物对空腹血糖(FBG)以及体重的影响如表1所示。
表1显示,实验前,与空白对照组小鼠相比,各组小鼠体重无显著性差异。各实验组小鼠血糖浓度与空白对照组小鼠相比,差异极显著,高、中、低剂量复配物组、阳性对照组、模型对照组间无显著差异,表明小鼠糖尿病造模成功。
实验后,与模型对照组小鼠体重相比,高剂量海藻膳食纤维复配物灌胃组体重增加明显,差异极显著;阳性对照组与中剂量海藻膳食纤维复配物灌胃组体重增加,差异显著;低剂量海藻膳食纤维复配物灌胃组体重与模型对照组无显著性差异。说明海藻膳食纤维复配物能够有效改善糖尿病小鼠体重减少的症状,且效果存在剂量依赖关系。与模型对照组空腹血糖浓度相比,高、中剂量海藻膳食纤维复配物灌胃组、阳性对照组空腹血糖浓度下降,差异极显著;低剂量海藻膳食纤维复配物灌胃组空腹血糖浓度下降明显,差异显著。
以上说明海藻膳食纤维复配物能够缓和糖尿病小鼠因糖代谢紊乱引起的体重减少症状,且可有效地控制糖尿病小鼠空腹血糖水平。降低高血糖对胰岛β细胞结构与功能的损害程度,延缓慢性并发症的发生与发展。
表1 不同剂量复配物对空腹血糖(FBG)以及体重的影响(±s)Table 1 The effects of different dose of compounds on the fasting blood glucose(FBG)and body weigh(±s)
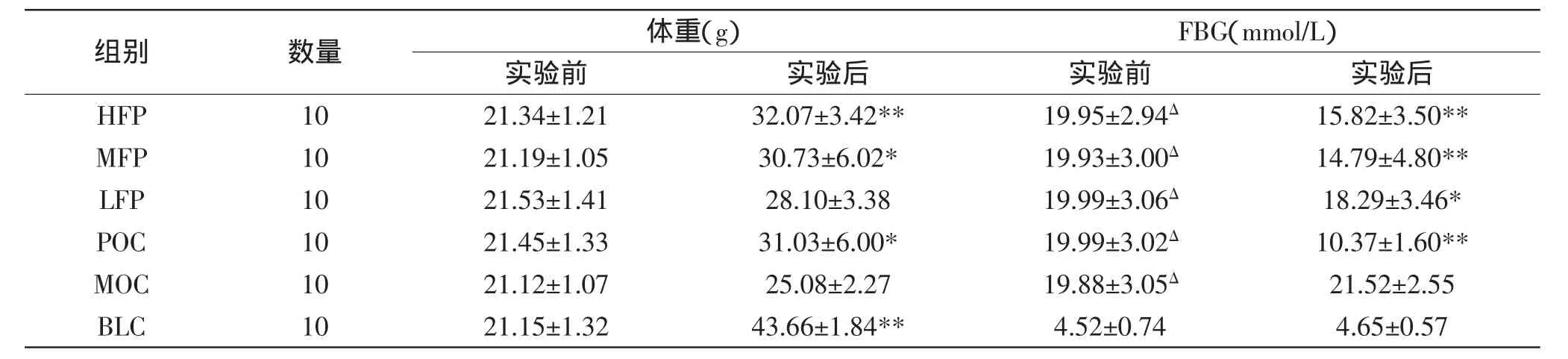
表1 不同剂量复配物对空腹血糖(FBG)以及体重的影响(±s)Table 1 The effects of different dose of compounds on the fasting blood glucose(FBG)and body weigh(±s)
注:*:与模型对照组相比,差异显著(p<0.05);**:与模型对照组相比,差异极显著(p<0.01),Δ:与空白对照组相比,差异极显著(p<0.01);表2、表3同。
组别 数量 体重(g) FBG(mmol/L)实验前 实验后 实验前 实验后HFP 10 21.34±1.21 32.07±3.42** 19.95±2.94Δ 15.82±3.50** MFP 10 21.19±1.05 30.73±6.02* 19.93±3.00Δ 14.79±4.80** LFP 10 21.53±1.41 28.10±3.38 19.99±3.06Δ 18.29±3.46* POC 10 21.45±1.33 31.03±6.00* 19.99±3.02Δ 10.37±1.60** MOC 10 21.12±1.07 25.08±2.27 19.88±3.05Δ 21.52±2.55 BLC 10 21.15±1.32 43.66±1.84** 4.52±0.74 4.65±0.57
2.2 不同剂量复配物对小鼠口服葡萄糖耐量(OGTT)的影响
糖尿病模型小鼠葡萄糖内稳态受损以及胰岛素敏感性降低,口服葡萄糖耐量测试(OGTT)可以表征胰岛β细胞功能和机体对血糖的调节能力以及高血糖对葡萄糖内稳态损害的大小,结果如图1所示。葡萄糖耐量曲线下积分面积见表2。
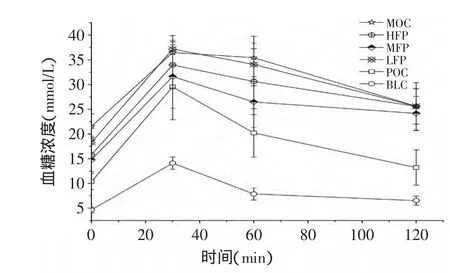
图1 各组小鼠口服葡萄糖耐量(OGTT)曲线Fig.1 Oral glucose tolerance(OGTT)curves of different group mice
图1可以看出,空白对照组小鼠血糖浓度于实验开始后30min达到最大值,并在120min内,血糖浓度恢复到基础水平。模型对照组小鼠在30~60min内,血糖浓度升至最高并保持稳定,120min时未有显著下降,表明糖尿病模型小鼠胰岛素分泌延迟,胰岛β细胞功能受损、机体对血糖的调节能力下降,葡萄糖耐量受损严重,葡萄糖内稳态紊乱。与模型对照组小鼠相比,阳性对照组葡萄糖耐量得到显著改善,高、中剂量复配物灌胃组葡萄糖耐量得到改善,并以中剂量复配物效果较佳。
表2 各组小鼠葡萄糖耐量曲线下积分面积(±s)Table 2 Integral area of each group mice under glucose tolerance curve(±s)
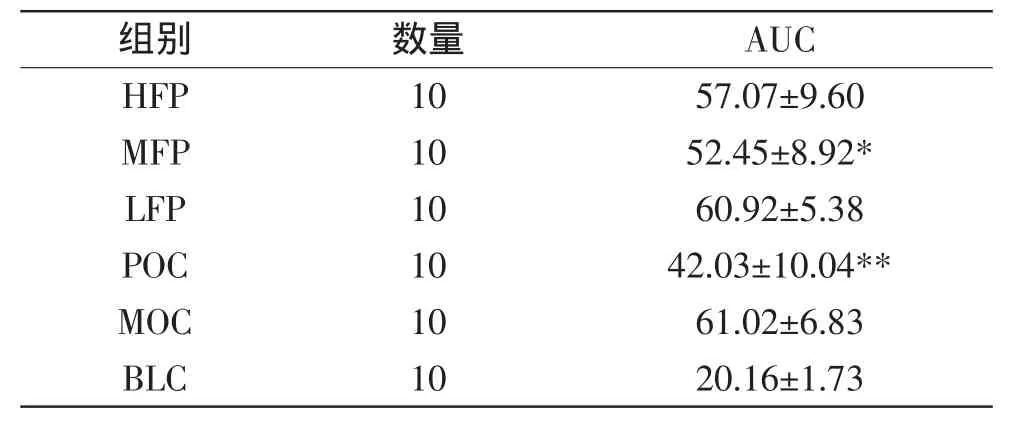
表2 各组小鼠葡萄糖耐量曲线下积分面积(±s)Table 2 Integral area of each group mice under glucose tolerance curve(±s)
组别 数量 AUC HFP 10 57.07±9.60 MFP 10 52.45±8.92* LFP 10 60.92±5.38 POC 10 42.03±10.04** MOC 10 61.02±6.83 BLC 10 20.16±1.73
表2显示,阳性对照组AUC与模型对照组小鼠相比明显减小,差异极显著;中剂量海藻膳食纤维复配物灌胃组AUC与模型对照组小鼠相比减小,差异显著。说明中剂量海藻膳食纤维复配物能够有效减慢葡萄糖的吸收速率,减轻胰岛负担,从而改善糖尿病模型小鼠葡萄糖耐量受损,改善葡萄糖内稳态。
2.3 不同剂量复配物对小鼠血脂的影响
Ⅰ型糖尿病以胰岛素分泌绝对不足为主要特征,四氧嘧啶特异性地破坏胰岛β细胞,造成胰岛素合成、分泌不足。胰岛素合成、分泌缺陷导致脂肪细胞内脂质分解,增高血脂水平并加重肝脏负担[24]。合理控制血脂水平可以减少对胰岛β细胞的损伤,海藻膳食纤维复配物对小鼠血脂水平的影响,见表3。
表3显示,与模型对照组小鼠相比:海藻膳食纤维复配物灌胃各组TC无显著差异;高剂量复配物灌胃组HDL-C差异极显著,中剂量复配物灌胃组HDLC差异显著,低剂量复配物灌胃组HDL-C差异不显著;高剂量复配物灌胃组LDL-C差异显著,中、低剂量复配物灌胃组LDL-C差异无显著性;高、中剂量复配物灌胃组TG差异显著,低剂量复配物灌胃组TG差异不显著;阳性对照组,LDL-C差异不显著,TC、HDLC差异显著,TG差异极显著;空白对照组LDL-C、TC、 TG、HDL-C差异极显著。
表3 不同剂量复配物对小鼠血脂的影响(±s)Table 3 Effect of different doses of compound on serum lipid profiles of mice(±s)

表3 不同剂量复配物对小鼠血脂的影响(±s)Table 3 Effect of different doses of compound on serum lipid profiles of mice(±s)
组别 数量 TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) TG(mmol/L)HFP 10 5.74±0.58 2.56±0.24** 2.71±0.34* 1.39±0.31* MFP 10 6.01±0.67 2.51±0.36* 3.02±0.36 1.43±0.28* LFP 10 6.20±0.91 2.24±0.44 3.10±0.59 1.62±0.45 POC 10 5.59±0.44* 2.53±0.33* 2.80±0.52 1.22±0.27** MOC 10 6.31±0.63 2.21±0.18 3.21±0.42 1.64±0.34 BLC 10 5.06±0.53** 2.65±0.14** 2.56±0.40** 1.03±0.39**
表3说明糖尿病模型小鼠血糖升高的同时,伴发严重的脂质异常代谢。盐酸二甲双胍可抑制游离脂肪酸从脂肪细胞中释出,而脂肪酸可能对胰岛β细胞的功能具有损害作用[18];盐酸二甲双胍通过降低脂质过氧化水平,减少对胰岛β细胞的损伤程度,并提高外周组织胰岛素敏感性[25]。高、中剂量复配物能够有效地降低糖尿病模型小鼠的血脂异常代谢水平。血脂水平与血糖的高低有着紧密的联系,特别是血糖水平直接影响TG水平的高低[26]。胰岛素可以通过激活脂蛋白脂肪酶(LPL)增加HDL-C的合成,且可促进受体载脂蛋白B(Apo-B)介导的LDL-C的分解作用,因此胰岛素分泌不足往往是导致糖尿病脂质代谢异常的主要原因[27-28]。海藻膳食纤维复配物可以降低血脂水平,减少脂质过氧化作用对胰岛β细胞的损害程度,促进胰岛素合成与分泌,起到降血糖作用。
2.4 胰腺组织HE染色
由于胰岛β细胞被特异性破坏,四氧嘧啶诱导的糖尿病小鼠胰腺组织经HE染色之后,显微镜下观察,可见“兰氏小岛”(islet of Langerhans)染色区域变小、边缘不规则、细胞核萎缩等。各组小鼠胰腺组织切片HE染色,显微镜检查,结果如图2所示。
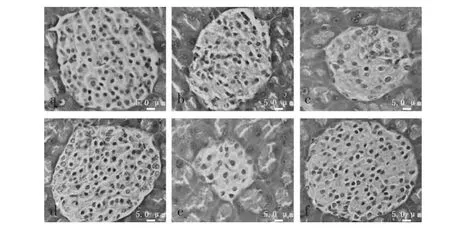
图2 小鼠胰腺组织学染色结果(200×)Fig.2 Results of histologically-stained islet in pancreas(200×)
光学显微镜下观察,空白对照组胰腺组织经HE染色,“兰氏小岛”(islet of Langerhans)边缘规则、完整,区域大小正常呈圆形或椭圆形,β细胞以及胞质内胰岛素分泌颗粒多,染色程度深。模型对照组胰岛β细胞以及胞质内胰岛素分泌颗粒严重减少,染色程度浅,“兰氏小岛”染色区域很小,边缘不规则。与模型对照组相比,海藻膳食纤维复配物灌胃各组、阳性对照组小鼠“兰氏小岛”染色区域明显增大,边缘较规则,特别是高、中剂量复配物灌胃组与阳性对照组β细胞增多,胞质内胰岛素分泌颗粒增加,染色程度较深。
HE染色结果表明,复方海藻膳食纤维可以降低四氧嘧啶对胰岛β细胞的损伤程度,修复胰岛β细胞的结构与功能,从而增加胰岛素合成与分泌。
3 结论
本实验以四氧嘧啶致糖尿病小鼠,对海藻膳食纤维复配物的降血糖效果进行了研究。实验结果表明,海藻膳食纤维复配物能够显著降低糖尿病小鼠血糖,减轻高血糖对机体的毒害作用;改善糖尿病小鼠葡萄糖耐量并缓解“三多一少”症状。其降血糖机制可能与复方海藻膳食纤维改善脂质异常代谢,促进胰岛β细胞修复与再生有关。
[1]Wild S,Roglic G,Green A,et al.Global prevalence of diabetesestimates for the year 2000 and projections for 2030[J].Diabetes Care,2004,27(5):1047-1053.
[2]Marinho-Soriano E,Bourret E.Polysaccharides from the red seaweed Gracilaria dura(Gracilariales,Rhodophyta)[J].Bioresource Technology,2005,96(3):379-382.
[3]刘成梅,李资玲,梁瑞红,等.膳食纤维的生理功能与应用现状[J].食品研究与发,2006,27(1):122-125.
[4]Maeda H,Yamamoto R,Hirao K,et al.Effects of agar(kanten)diet on obese patients with impaired glucose tolerance and type 2 diabetes[J].Diabetes,Obesity and Metabolism,2005,7(1):40-46.
[5]薛长湖,徐强,赵雪,等.琼胶低聚糖清除自由基的活性[J].水产学报,2003,27(3):283-288.
[6]肖美添,叶静,汤须崇,等.江蓠藻膳食纤维的降血糖及抗氧化作用[J].华侨大学学报,2009,30(6):665-667.
[7]曾明,陶凯忠,郑水庆,等.葛根提取物抗糖尿病大鼠氧化应激的实验研究[J].华北国防医药,2006,18(6):393-395.
[8]陈玲玲,刘炜,陈建国,等.桑叶黄酮对糖尿病小鼠调节血糖的作用机制研究[J].中国临床药理学杂志,2010,26(11):835-838.
[9]俞灵莺,李向荣,方晓.桑叶总黄酮对糖尿病大鼠小肠双糖酶的抑制作用[J].中华内分泌代谢杂志,2002,18(4):313-315.
[10]李超,潘建明,罗新,等.桑叶提取物对糖尿病小鼠糖耐量的影响[J].海南医学,2012,23(3):24-26.
[11]魏炳栋,陶浩,陈群,等.植物多糖体外清除羟自由基的抗氧化性能研究[J].饲料研究,2011(8):1-3,6.
[12]李八方,陈桂东,毛文君.几种膳食纤维对实验性糖尿病大鼠治疗效果的比较研究[J].营养学报,1998,21(1):5.
[13]郝翠.系列海洋寡糖衍生物的制备及其抗2型糖尿病作用机理研究[D].青岛:中国海洋大学,2011.
[14]张喜梅,李琳,陈玲,等.葛根总黄酮提取工艺研究[J].现代食品科技,2008,24(1):42-45.
[15]刘杰,潘见,张文成,等.富含黄酮和生物碱的桑叶提取物的提取工艺研究[J].食品科学,2009,30(12):52-56.
[16]徐青梅.黄芪多糖的提取工艺研究[J].应用化工,2012,41(2):311-313.
[17]Otto M,Breinholt J,Westergaard N.Metformin inhibits glycogen synthesis and glyconeogensis in cultured rat hepatocytes [J].Diabetes,Obesity and Metabolism,2003,5(3):189-194.
[18]黄雨三.保健食品检验与评价技术规范实施手册[M]. 2003版,北京:中华人民共和国卫生部,2003:712.
[19]唐从国,郭周庆.如何做好一张HE染色切片[J].中国组织化学与细胞化学杂志,2012,21(4):428-429.
[20]霍娟.葡萄糖毒性与胰岛β细胞功能[J].微循环学杂志,2005,15(3):61-63.
[21]Thorens B,Wu Y J,Leahy J L,et al.Loss of GLUT2 expression by glucose-unresponsive beta-cells of db/db mice is reversible and is induced by the diabetic environment[J].Journal of Clinical Investigation,1992,90(1):77-85.
[22]Federici M,Hribal M,Perego L,et al.High glucose causes apoptosis in cultured human pancreatic Islets of Langerhans[J]. Diabetes,2001,50(6):1290-1301.
[23]Liu K,Paterson AJ,Chin E,et al.Glucose stimulated protein modification by O-linked GlcNAc in pancreatic β-cells:linkage of O-linked GlcNAc to β cell death[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(6):2820-2825.
[24]Brown W V.Lipoprotein disorders in diabetes mellitus[J]. Medical Clinical of North America,1994,78(6):143-161.
[25]Lupi R,Del Guerra S,Fierabracci V.Lipotoxicity in human pancreatic islets and the protective effect of metformin[J]. Diabetes,2002,51(1):134-137.
[26]Markku L.Epidemiology of diabetic dyslipidemia[J].Diabetes Reviews,1995,15(3):408-422.
[27]Goldberg I J.Diabetic dyslipidemia:causes and consequences [J].Journal of Clinical Endocrinology and Metabolism,2001,86(2):965-971.
[28]Niemeijer-Kanters S D,Banga J D,Erkelens D W.Lipidlowering therapy in diabetes mellitus[J].Netherlands Journal of Medicine,2001,58(5):214-222.

