不同冻藏温度下鲣鱼暗色肉的品质分析研究
章茜琳,李向阳,刘书来,丁玉庭
(浙江工业大学生物与环境工程学院,浙江杭州310014)
鲣鱼(Katsuwonus pelamis)属鲈形总目、金枪鱼亚目、金枪鱼科、舵鲣亚科、鲣属,主要分布于中西太平洋海域,比黄鳍金枪鱼更加低廉但捕获量较高,其年产量约100万吨,通常被用于制作金枪鱼罐头,在日本料理中也很常见[1-2]。鲣鱼的肌肉由普通肉与暗色肉构成,其暗色肉主要分布于鱼骨周围及少量鱼表皮以下,约占鱼肉13%~16%[3],具有一定的利用潜力,但因其品质劣于普通肉,通常作为罐头加工的下脚料而废弃。国外已采用-30~-40℃的冷库用于鱼的冻藏,其保鲜品质更好,国内水产冷库温度设置在-18℃。本研究主要考察不同冷藏温度(-18、-25、-33℃)下挥发性盐基氮(TVBN)、K值、组胺等鲣鱼暗色肉的鲜度指标变化,分析鱼肉肌原纤维易碎度(MFI)和剪切力的变化规律,并结合肌红蛋白氧化和脂肪氧化探究长期的低温储藏下鲣鱼暗色肉品质的变化规律,为生产加工提供理论参考。
1 材料与方法
1.1 材料与仪器
鲣鱼 规格(2.0±0.1)kg,由上海开创远洋公司“金汇”6号围网渔船于北纬0°32′,东经164°28′捕获,通过船载冷盐水冻结至鱼体中心温度-18℃,转至船载干仓暂存,并运至实验室;高氯酸、氢氧化钠、盐酸、硼酸、酚酞、甲基红、次甲基蓝、碳酸氢钠、丹酰氯(dansyl chloride纯度≥99.0%)、氢氧化铵(25%~28%)、乙酸铵、磷酸氢二钠、磷酸二氢钠、氯化钾、五水合硫酸铜、酒石酸钾钠、氢氧化钠、EDTANa2、硼酸、硼酸钠、硫代巴比妥酸、三氯乙酸等 均为分析纯试剂;甲醇、乙腈、丙酮、盐酸组胺、ATP、ADP、AMP、IMP、HxR、Hx等 均为色谱纯。
752N型紫外可见分光光度计 上海精科仪器有限公司;Waters2695型高效液相色谱仪 美国waters公司;TAXT Plus型物性仪 英国Stable Micro System公司;HH-2型数显恒温水浴锅 上海司乐仪器有限公司;TGL-16M型高速台式冷冻离心机 长沙湘仪离心机有限公司。
1.2 实验方法
1.2.1 样品处理 选取表面完整,大小个体相近的鲣鱼样品,分批储藏于-18、-25、-33℃温度下9个月,每月取样分析其暗色肉的挥发性盐基氮值(TVBN)、K值、组胺含量、肌原纤维易碎度(MFI)、剪切力、硫代巴比妥酸(TBARS)、高铁肌红蛋白比率品质指标。鱼体取样后在4℃下解冻10h,解剖后选取暗色肉为实验对象,各个指标在每一个鱼体取样位置固定,并进行重复(不同鱼体)与平行实验。
1.2.2 TVBN的测定 采用SC/T 3032-2007方法。
1.2.3 K值的测定 采用王远红[4]和Ryder[5]的高效液相色谱法并稍作修改,采用外标法定量,K值(%)= 100×(INO+HX)/(ATP+ADP+AMP+IMP+INO+HX)。
1.2.4 组胺的测定 采用GB/T 20768-2006方法。
1.2.5 MFI的测定 采用丁玉庭等[6]的方法制备肌原纤维悬浮液,并将悬浮液蛋白质浓度调整为(0.5± 0.05)mg/mL,立即取10mL在540nm下测定吸光度,MFI=OD540nm×200。
1.2.6 剪切力的测定 采用Brauer J等[7]方法。测试鱼肉尺寸为:2cm长×1cm宽×2cm高,平行实验6次。
1.2.7 TBARS的测定 采用GB/T 5009.181-2003方法。
1.2.8 高铁肌红蛋白比率的测定 采用董庆利等[8]方法,为了操作方便,本实验采用2g样品于16mL试剂中提取。
1.2.9 数据分析 数据处理采用软件SPSS 17.0和Excel,表述形式为±sD(n=3,6),差异性分析采用多重比较方法。
2 结果与讨论
2.1 鲜度品质的变化
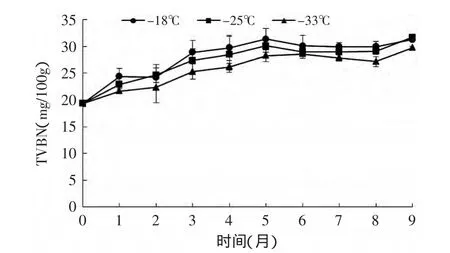
图1 不同冻藏温度下鲣鱼暗色肉TVBN随时间的变化Fig.1 Changes of TVBN content of dark muscle under different temperatures during frozen storage
TVBN值反映了水产品蛋白质的变化,是判断其鲜度的主要化学指标之一[9]。如图1所示,不同温度下鲣鱼暗色肉的TVBN随冻藏时间的延长而逐渐升高,且在第5月后其变化趋于平缓。GB 2733-2005卫生标准[10]规定:TVBN超过30mg/100g为腐败品质,本实验原料样品暗色肉TVBN已达到(19.32±0.56)mg/100g,Oyelese O A等[11]的研究结果显示鲣鱼普通肉TVBN在储藏初期要低得多。对于不同的冻藏温度,温度越低,TVBN值升高则相对缓慢,-18℃、-25、-33℃下储藏的鲣鱼暗色肉品质分别在第3月、第4月、第5月开始不被接受。由于鲣鱼在稳定的低温环境下长期储藏,其微生物水平和蛋白酶的活性增长缓慢,各个温度下冻藏五个月后挥发性盐基氮的增长均不明显(p>0.05)。
K值是评判水产品鲜度的常用指标,在日本,它通常用来评定刚捕获鱼的新鲜程度[12]。图2反映了鲣鱼暗色肉在不同温度下9个月冻藏期间的K值变化,随着冻藏时间的增加,不同温度下鲣鱼的暗色肉K值逐渐增加,但不同温度对其影响不显著(p>0.05)。与冰鲜(0℃)储藏[13]相比,在-18、-25、-33℃冻藏下的鲣鱼暗色肉K值增长速率相对缓慢。
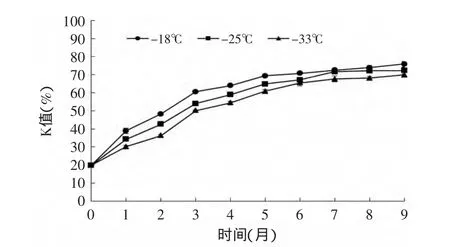
图2 不同冻藏温度下鲣鱼暗色肉K值随时间的变化Fig.2 Changes of K-value of dark muscle under different temperatures during frozen storage
组胺是鲣鱼品质控制的关键指标,人体摄入超标可引起中毒。我国水产品卫生标准中组胺的限量标准为:鲐鱼类1000mg/kg,其他海水鱼类300mg/kg[8]。在低温冻藏下的鲣鱼暗色肉组胺含量的变化趋势如图3显示,在9个月内均随着时间的增加逐渐升高,并且在-18、-25、-33℃冻藏下鲣鱼暗色肉组胺含量均没有超过标准。另外Shakila R J等[14]认为组胺等物质对TVBN也有一定的影响。
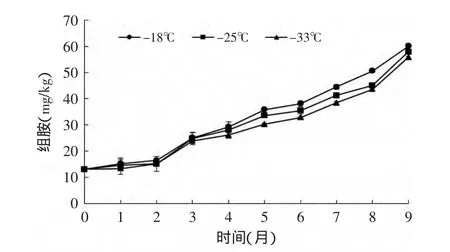
图3 不同冻藏温度下鲣鱼暗色肉组胺含量随时间的变化Fig.3 Changes of histamine content of dark muscle under different temperatures during frozen storage
2.2 肌肉纤维品质的变化
肌肉纤维结构I带中Z线的降解导致肌原纤维的碎化,通常采用MFI(myofibril fragmentation index)作为评判鱼肉肌纤维蛋白品质变化的重要指标[15]。如图4所示,鲣鱼暗色肉的MFI呈上升趋势,这种变化与文献[16]研究结果相一致。-18、-25、-33℃下冻藏9个月时MFI分别升高了142.63%、142.17%、125.11%。然而在上升过程中温度对该指标的影响并不显著(p>0.05),但相对来说温度越低,MFI较低。能够和MFI一起评判肌肉纤维品质的指标是肌肉的剪切力,一般肌纤维结构破坏导致肌肉的剪切力下降。

图4 不同冻藏温度下鲣鱼暗色肉MFI随时间的变化Fig.4 Changes of MFI of dark muscle under different temperatures during frozen storage
由图5所示鲣鱼暗色肉在低温储藏过程中的剪切力呈下降趋势,这与Dennis G Olson等[17]研究的结果相似。-18、-25、-33℃下冻藏9个月时剪切力分别下降了77.85%、69.99%、69.13%。另外在图5中三个温度对该指标的影响不显著(p>0.05)。MFI上升和剪切力下降说明其变化趋势负相关。
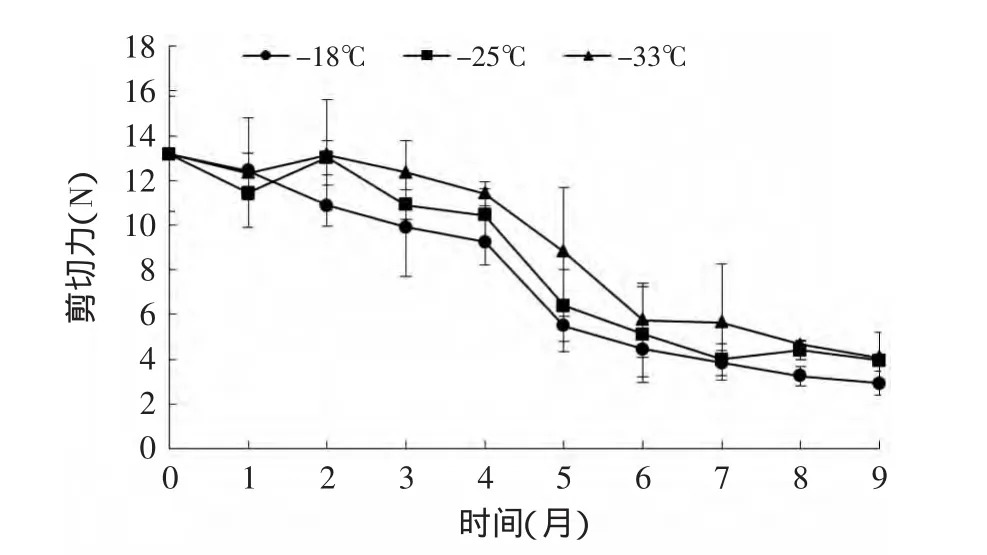
图5 不同冻藏温度下鲣鱼暗色肉剪切力随时间的变化Fig.5 Changes of shear force of dark muscle under different temperatures during frozen storage
2.3 脂肪氧化和肌红蛋白氧化率的变化
TBARS这一指标通常用来表示脂肪氧化水平。图6显示了鲣鱼暗色肉的TBARS随着冻藏期的变化趋势。在本实验中,第2、3、4、6、7、8、9月温度对TBARS有显著性差异(p<0.05)。TBARS在冻藏期间呈增长趋势,在第6个月之后趋于平缓,这种变化可能是因为丙二醛与蛋白质的降解产物发生交联作用[18]导致丙二醛含量的减少。有研究指出,肌红蛋白和脂肪氧化之间的关系密切,通常会影响食品的劣变[19]。脂肪氧化过程产生的自由基破环高铁肌红蛋白酶,同时肌红蛋白氧化成高铁肌红蛋白产生的Fe3+对脂肪氧化又有促进作用[20]。在图7中可看到鲣鱼暗色肉的高铁肌红蛋白比率随着时间而上升,不同温度之间高铁肌红蛋白比率差异不显著(p>0.05),并且在第2个月升高至最高值,之后不再继续升高。
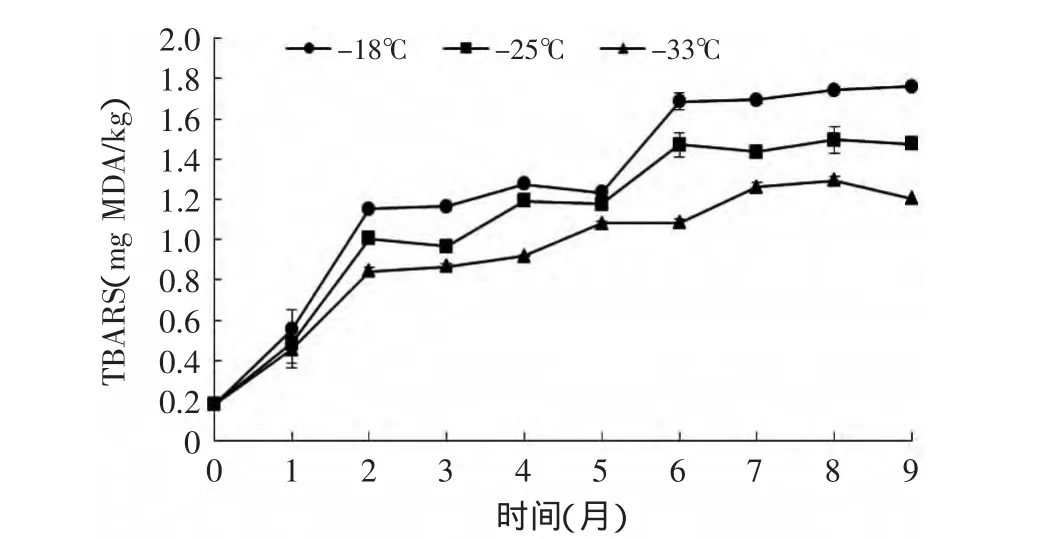
图6 不同冻藏温度下鲣鱼暗色肉TBARS随时间的变化Fig.6 Changes of TBARS content of dark muscle under different temperatures during frozen storage
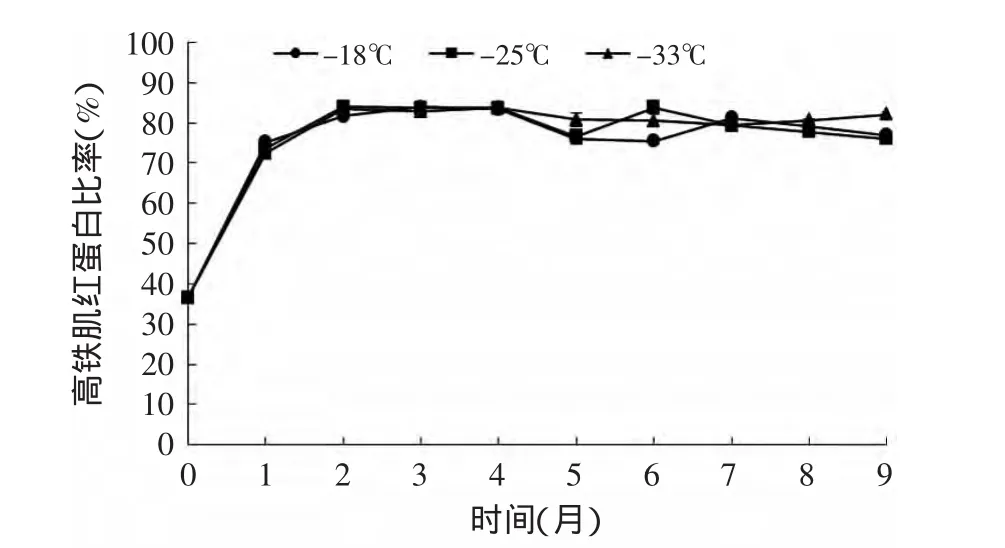
图7 不同冻藏温度下鲣鱼暗色肉高铁肌红蛋白比率随时间的变化Fig.7 Changes of MetMb rate of dark muscle under different temperatures during frozen storage
3 结论
鲣鱼在长期的低温冻藏条件下储存,各个品质指标的变化显示了暗色肉品质变化的趋势,而-18、-25、-33℃对不同指标有不同程度的影响。对于肌肉纤维的质地,冻藏温度的影响不明显,但是随着冻藏期其品质下降的趋势明显,说明在保证鲜度品质的情况下暗色肉的肌肉质地变化明显,从脂肪氧化和肌红蛋白氧化的变化规律中也可知暗色肉品质下降明显。鲜度品质是对其品质评判的关键,暗色肉在-18、-25、-33℃下冻藏时分别在第3、4、5个月后品质才开始不被接受,结合K值和组胺的变化,说明低温冻藏的鲣鱼暗色肉有加工利用的可能性,比如开发宠物食品等要求较低的加工来说还是具有一定价值。目前对鲣鱼的生产加工暗色肉通常被舍弃,在此研究中发现,在低温冻藏下鲣鱼中暗色肉也有被利用的可能。
[1]Herpandi N H,Rosma A,Wan Nadiah W A.The Tuna Fishing Industry:A New Outlook on Fish Protein Hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety,2011,10(4):195-207.
[2]叶泰豪,冯波,颜云榕,等.中西太平洋鲣渔场与温盐垂直结构关系的研究[J].海洋湖沼通报,2012(1):49-55.
[3]Hiratsuka S,Aoshima S,Koizumi K,et al.Changes of the volatile flavor compounds in dark muscle of skipjack tuna during storage[J].Nippon Suisan Gakkaishi,2011,77(6):1089-1094.
[4]王远红,徐家敏.食品检验与分析实验技术[M].青岛,中国海洋大学出版社,2006,9:14-15.
[5]Ryder J.Determination of adenosine triphosphate and its breakdown products in fish muscle by high performance liquid chromatography[J].Journal of Agriculture and Food Chemistry,1985,33:678-680.
[6]丁玉庭,刘化章,周晓云,等.猪PSE肉与正常肉的肌原纤维形态学比较研究[J].中国食品学报,2005,5(2):28-33.
[7]Brauer J M E,Leyva J A S,Alvarado L B,et al.Effect of dietary protein on muscle collagen,collagenase and shear force of farmed white shrimp(Litopenaeus vannamei)[J].European Food Research and Technology,2003,217(4):277-280.
[8]董庆利,郭黎洋,龚海斌,等.亚硝酸盐对猪肉腌制过程中颜色的影响[J].食品与发酵工业,2006,32(7):37-41.
[9]李志军,吴永宁,刘祥亮,等.不同贮存及加工条件对海产品中组胺与TVBN的影响[J].食品工业科技,2009,12:347-349.
[10]中华人民共和国卫生部.GB2733-2005鲜、冻动物性水产品卫生标准[S].北京:中国标准出版社,2005.
[11]Oyelese O A.Organoleptic and Chemical Studies on the Storage Characteristict of the Skip Jack Tuna(Katsuwonus pelamis)[J].Journal of Fisheries International,2006(2):127-131.
[12]Agustini T W,Suzuki T,Hagiwara T,et al.Change of K value and water state of yellowfin tuna Thunnus albacares meat stored in a wide temperature range(20℃-84℃)[J].Fisheries Science,2001,67(2):306-313.
[13]刘书臣,廖明涛,赵巧灵,等.不同贮藏温度下大目金枪鱼鲜度及组胺变化[J].食品与发酵工业,2013,39(5):213-218.
[14]Shakila R J,Vijayalakshmi K,Jeyasekaran G.Changes in histamine and volatile amines in six commercially important species of fish of the Thoothukkudi coast of Tamil Nadu,India stored at ambient temperature[J].Food Chemistry,2003,82(3):347-352.
[15]Davey CL,Dickson MR.Studies in meat tenderness 8 Ultrastructural changes during aging[J].Journal of Food Science,1970,35:56-60.
[16]Nafiseh Soltanizadeh,Mahdi Kadivar,Javad Keramat,et al. Comparison of fresh beef and camel meat proteolysis during cold storage[J].Meat Science,2008,80:892-895.
[17]Olson D G,STROMER M H.Myofibril fragmentation and shear resistance of three bovine muscles during postmortem storage[J].Journal of Food Science,1976,41(5):1036-1041.
[18]Sallam K I,Ahmed A M,Elgazzar M M,et al.Chemical quality and sensory attributes of marinated Pacific saury(Cololabis saira)during vacuum-packaged storage at 4℃[J].Food Chemistry,2007,102(4):1061-1070.
[19]Thiansilakul Y,Benjakul S,Richards M P.Isolation,characterisation and stability of myoglobin from Eastern little tuna(Euthynnus affinis)dark muscle[J].Food Chemistry,2011,124(1):254-261.
[20]林婉玲,曾庆孝,朱志伟,等.脆肉鲩冷藏保鲜过程中暗色肉颜色的变化[J].食品工业科技,2012,33(22):355-359.

