籽瓜多糖的超声波辅助提取工艺、分子量和抗氧化活性研究
宋 珅,刘 琴,殷振雄,赵保堂,张 继,2,*
(1.西北师范大学生命科学学院,甘肃兰州730070;2.甘肃特色植物有效成分制品工程技术研究中心,甘肃兰州730070)
籽瓜,是一种润肺、暖胃的保健食品,富含果酸、核黄酸、尼可酸等18种氨基酸、维生素及多种微量元素,具有利尿、润肺、健脾的功效,对糖尿病、肥胖症也有辅助医疗作用,籽瓜入药可作“白虎汤”药引[1-3]。刘长缀等[4]利用籽瓜瓤为原料,开发出一系列具有减肥降脂功效的籽瓜保健产品。王翠平[5]对籽瓜皮和瓢作了研究,表明籽瓜皮和籽瓜瓤具有一定的的清除DPPH·、OH·、ABTS·自由基能力和抑制肝癌细胞7721生长的活性,可以作为一种良好的天然抗氧化剂及抗肿瘤活性物质。多糖是一种具有多种功能的生物活性物质,研究结果表明,不同植物的多糖,具有不同的功能,如抗癌、防癌、抗病毒、抗衰老、降血糖、降血脂、抑菌等[6]。而现今对籽瓜的利用仅限于瓜子的生产,瓜瓤含有丰富的多糖[7],目前没有人对籽瓜瓤的多糖进行研究。鉴于对籽瓜多糖的提取和研究还未见报道,本文研究了籽瓜瓜瓤中籽瓜多糖的提取工艺、分子量以及抗氧化活性,是对籽瓜皮瓤的“废物利用”,既解决了籽瓜去籽后产生污染问题,又提高了籽瓜的经济效益和附加值,是籽瓜综合利用的有效途径之一,有很好的社会效益和经济价值[8],可为籽瓜的进一步开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
籽瓜 产自甘肃省白银市靖远县,新鲜籽瓜去皮去瓜子后,切碎,匀浆机6000r/min粉碎成汁,待用;氯仿(分析纯) 忠义化工;溴化钾(分析纯) 郑州双腾化工;K2SO4(分析纯) 禾泰化工有限公司;NaOH(分析纯) 天津凯信化工有限公司;H2O2(分析纯) 天津福辰化工;无水乙醇 天津精细化工厂;HCl(分析纯) 西安化学试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH)、四唑氮蓝(NBT)、还原型辅酶Ⅰ钠盐(NADH)、吩嗪硫酸甲酯(PMS) 美国Sigma;水杨酸(分析纯) 烟台双双化学试剂有限公司;三氯乙酸(分析纯) 天津市大茂化学试剂厂;K2HPO4、KH2PO4(分析纯) 上海化学试剂二厂;铁氰化钾(分析纯) 西安化学试剂厂。
BL320H型电子天平 日本岛津;JRA-6型数显磁力搅拌水浴锅 金坛市杰瑞尔电器有限公司;FSH-2A型可调高速分散器 常州华冠仪器制造有限公司;KQ-400GKDV型实验用超声仪 常州诺基仪器有限公司;TDL5M型台式大容量冷冻离心机 湘仪离心机厂;LGJ-185型真空冷冻干燥机 北京松源华兴科技发展有限公司;SB-35型旋转蒸发仪 日本EYELA;UV1000紫外可见分光光度计 Labtech;IS10型傅立叶红外光谱仪 美国Thermo;多角度激光光散射仪(λ=690nm,DAWN EOS,Wyatt Technology Co,) USA。
1.2 实验方法
1.2.1 超声波辅助提取籽瓜多糖的工艺 取一定量预处理后的籽瓜汁,以蒸馏水为溶剂,用KQ-400GKDV型实验用超声仪,恒定超声波功率为250W,在实验设定的温度和时间等条件下提取籽瓜多糖。提取液4000r/min离心10min,上清60℃减压浓缩至20mL,加入无水乙醇80mL,醇沉24h 5000r/min离心10min,取下层沉淀,-60℃冷冻干燥得到籽瓜粗多糖。籽瓜粗多糖经木瓜蛋白酶和Sevage偶联法脱去蛋白,60℃减压浓缩至10mL,加入无水乙醇40mL,醇沉24h,5000r/min离心10min,取下层沉淀,-60℃冷冻干燥得到籽瓜多糖。
1.2.2 单因素实验设计 固定条件液料比为1∶1(mL/g),提取温度为60℃,提取时间为60min,研究液料比1∶4、1∶3、1∶2、1∶1、3∶2(mL/g),提取温度20、30、40、50、60、70℃,提取时间15、30、60、90、120min对籽瓜多糖的得率的影响。实验重复三次。
1.2.3 响应面实验设计 在单因素实验基础上进行响应面实验,以确定提取时间、提取温度及液料比的最佳工艺,以多糖得率为指标,因素水平见表1。
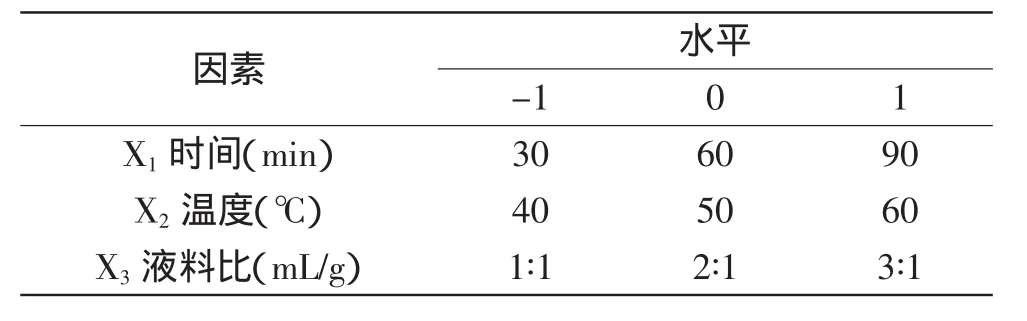
表1 实验因素、水平及编码Table 1 Experiment factors,levels and code
1.2.4 分子量的测定 采用体积排阻色谱-光散射联用(SEC-LLS)进行测定。多角度激光光散射仪λ= 690nm,校准常数=8.8500e-6;色谱柱型号为7.8mm× 300mm;溶剂为水。
1.2.5 多糖得率的计算 采用苯酚硫酸法测定总糖含量[9]。多糖得率计算公式如下:

1.2.6 籽瓜多糖的红外光谱分析 充分干燥的籽瓜多糖样品用KBr压片,400~4000cm-1波长范围内扫描,扫描次数16次,分辨率为4cm-1。
1.3 籽瓜多糖的抗氧化活性研究
1.3.1 对DPPH自由基的清除作用 将1mL不同质量浓度(0.02~2mg/mL)的多糖溶液、2mL DPPH(现用现配)溶液、2mL甲醇溶液充分混合均匀后在黑暗中静置30min,在517nm处测定吸光值。以VC作为阳性对照。每个样品重复三次,求平均值。DPPH自由基清除率公式如下:
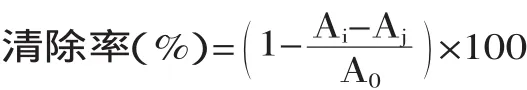
式中:A0表示无样品的DPPH溶液的吸光值;Ai表示待测样与DPPH混合溶液的吸光值;Aj表示不加DPPH的样品的吸光值。
1.3.2 对羟基(·OH)自由基的清除作用 将多糖溶于去离子水中,配制终浓度为0.02~2mg/mL的多糖溶液。将2mL的多糖溶液、2mL 6mmol/L的FeSO4溶液、H2O2溶液混匀后静置10min,再加入2mL 6mmol/L的水杨酸溶液,混匀,静置30min后,在510nm处测定吸光值。以VC作为阳性对照组。每个样品重复三次,求平均值。·OH清除率计算公式如下:
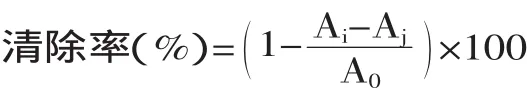
式中:A0表示无样品的混合反应液的吸光值;Ai表示待测样与混合反应液的吸光值;Aj表示不加水杨酸的样品溶液的吸光值。
1.3.3 对超氧阴离子(O2-·)的清除作用 PMS/NADH体系会产生超氧自由基,用NBT显色法测定。将多糖溶于去离子水中,使终浓度达0.02~2mg/mL。反应混合物中依次加入不同浓度的多糖溶液,Tris-HCl(16mmol/L,pH8.0),NADH(557μmol/L),NBT(108μmol/L)和PMS(45μmol/L),在25℃温浴5min,在560nm下测吸光值。以VC作为阳性对照组。每个样品重复三次,求平均值。O2-·清除率公式如下:
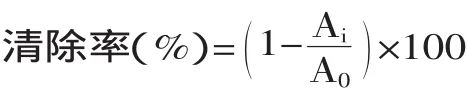
式中:A0表示无样品的混合反应液的吸光值;Ai表示待测样与混合反应液的吸光值。1.3.4 还原力的测定 不同浓度的多糖溶液(0.02~ 2mg/mL)1mL、2.5mL 0.2mol/L磷酸缓冲液(pH6.6)、2.5mL铁氰化钾(K3Fe(CN)6)溶液(1%)混合均匀,50℃水浴20min。加入的三氯乙酸溶液(10%)终止反应。加入蒸馏水和氯化铁(0.1%)混合均匀。在700nm下测吸光值。吸光值越高表示还原力越强。以VC作为阳性对照组。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 提取时间对籽瓜多糖得率的影响 由图1可知,在一定范围内,随着提取时间的延长,籽瓜多糖的得率先增大后减小,在60min时达到最大。这是由于超声波的空化效应增大了溶剂进入溶质内部的能力,使得多糖更容易从细胞中释放出来,使得整个提取时间缩短,提取率增高。处理时间短,多糖溶解不充分;时间过长,会造成多糖降解,甚至使其中的五碳环或六碳环裂解而转变为可溶于乙醇的单糖、寡糖或低聚糖,在醇沉过程中有所损失,最终会导致提取率的下降[10]。因此确定提取时间为60min。
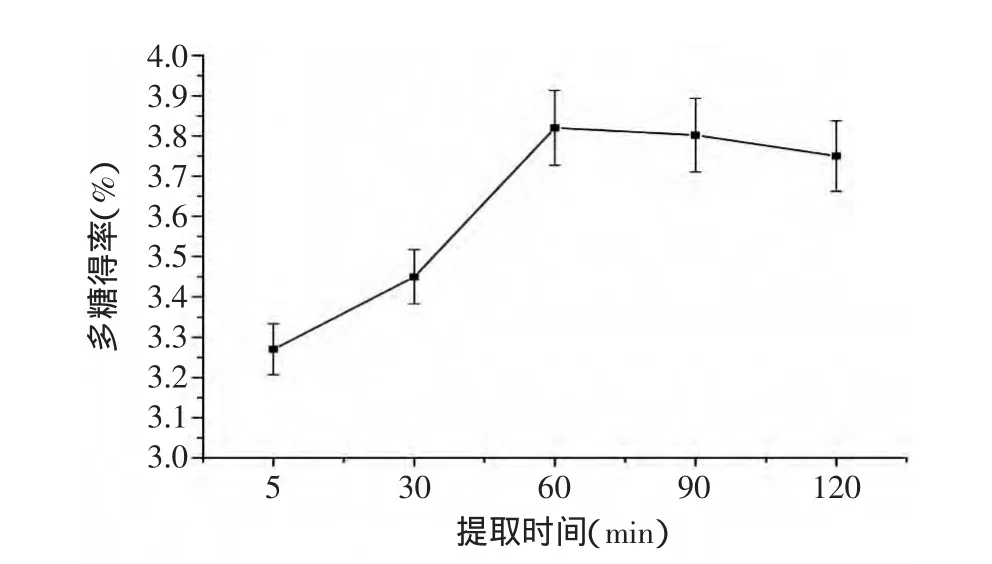
图1 提取时间对多糖得率的影响Fig.1 The effect of extract times on the yield of polysaccharide
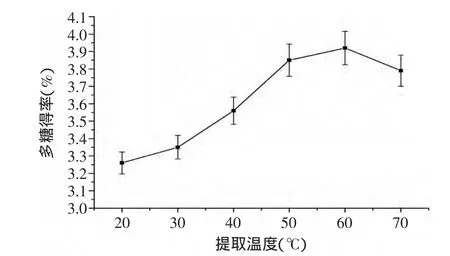
图2 提取温度对多糖得率的影响Fig.2 Effect of extraction temperature on the yield of polysaccharide
2.1.2 提取温度对籽瓜多糖得率的影响 由图2可知,温度对于籽瓜多糖的得率有着显著的影响。随着温度的增加,籽瓜多糖得率呈现先增加后减小的趋势,在20~60℃时,籽瓜多糖得率随温度的增加而增加,并且多糖得率在60℃时达到最大,在一定范围里,提取温度升高,有利于分子的运动和多糖的溶出;但温度过高则会影响到多糖的结构,反而会使多糖得率降低。因此最终确定适宜的提取温度是60℃。
2.1.3 料液比对籽瓜多糖得率的影响 由图3可知,随料液比的增加,籽瓜多糖得率呈现先增加后减小的趋势。这是因为,料液比低时,多糖溶解不充分,得率低;随着料液比增大,多糖充分溶胀,有利于多糖的溶出,使得率增加。但是,料液比过大,使后续提取过程中的浓缩时间增加,必然使多糖在浓缩过程中有较多损失,反而使多糖得率下降[11]。由图3可知,料液比在1∶2时,籽瓜多糖得率最佳,料液比可确定为1∶2。
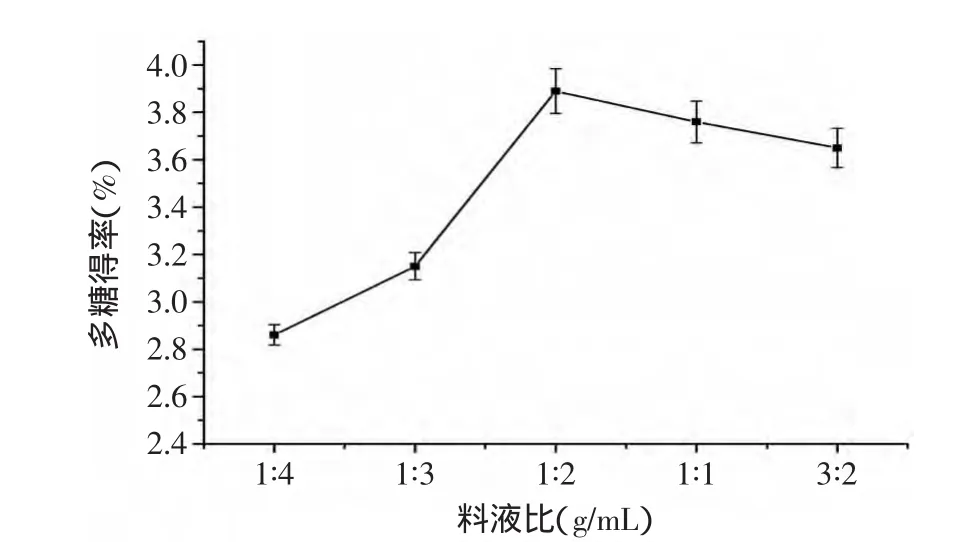
图3 料液比对多糖得率的影响Fig.3 The effect of ratio of material on the yield of polysaccharide
2.2 响应面法优化超声波辅助提取籽瓜多糖的工艺
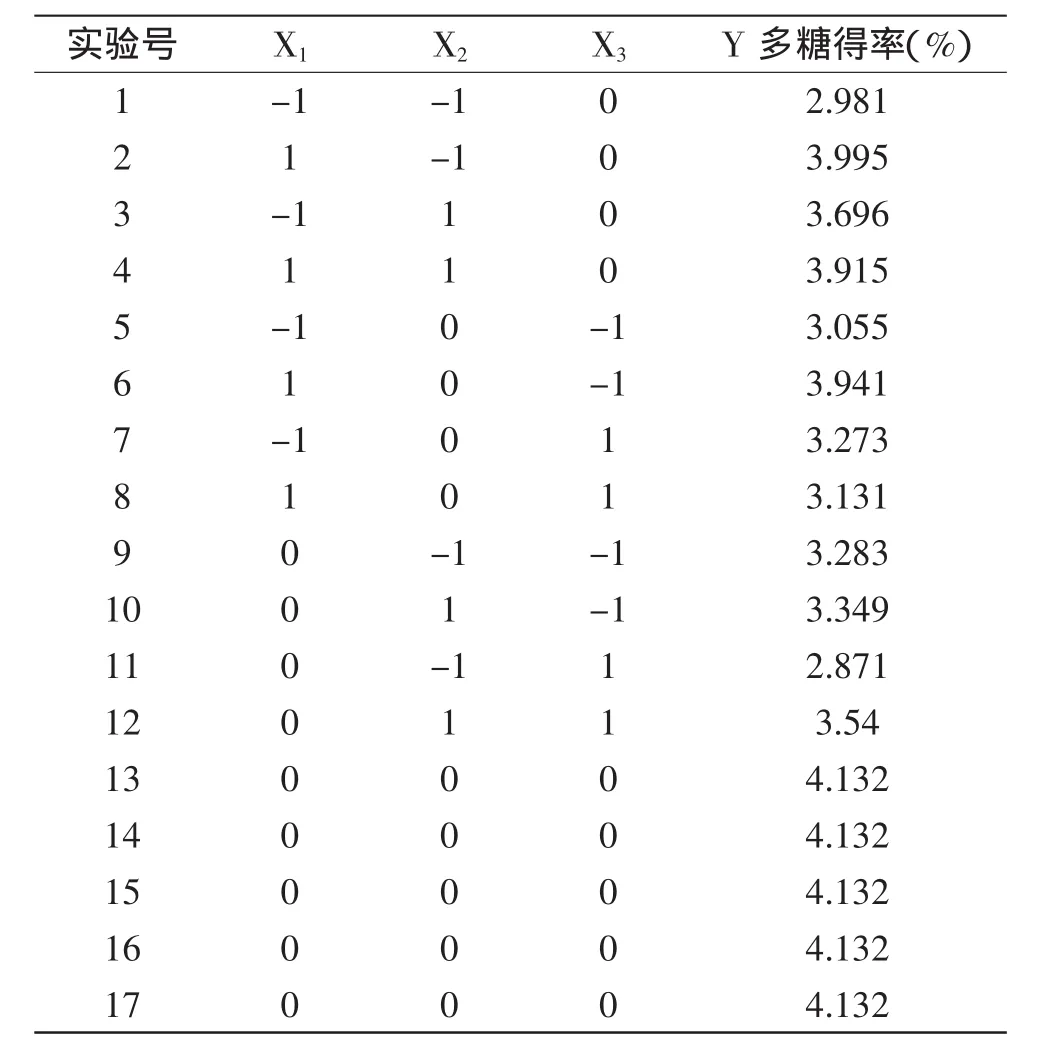
表2 响应面实验设计及结果Table 2 RSM design matrix and the responses
以籽瓜多糖得率为响应值Y,通过SAS软件对实验资料进行响应面分析,共17个实验点,其中12个为析因点,5个为零点,析因点为自变量取值在X1、X2、X3所构成的三维顶点;零点为区域的中心点,其中零点实验重复5次,用以估算实验误差。实验结果见表2,经二次回归拟合后求得响应函数,得到的回归方程如下:
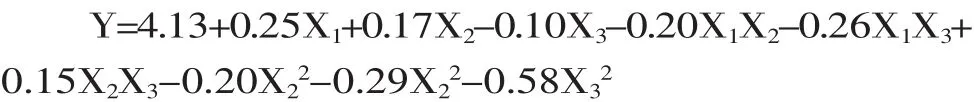
方差分析见表3。模型误差显著,失拟误差不显著,回归系数R2为0.9861,说明模型的拟合度很好,响应值的98.61%的是由于所选变量引起的,决定系数(R2adj=0.9683)接近于1,变异系数(C.V.=2.29%)很低,都说明模型相关性高,用该模型模拟真实的三因素三水平的分析是可行的[12]。可以用该模型方程来分析和预测不同提取条件下籽瓜多糖的得率的变化。
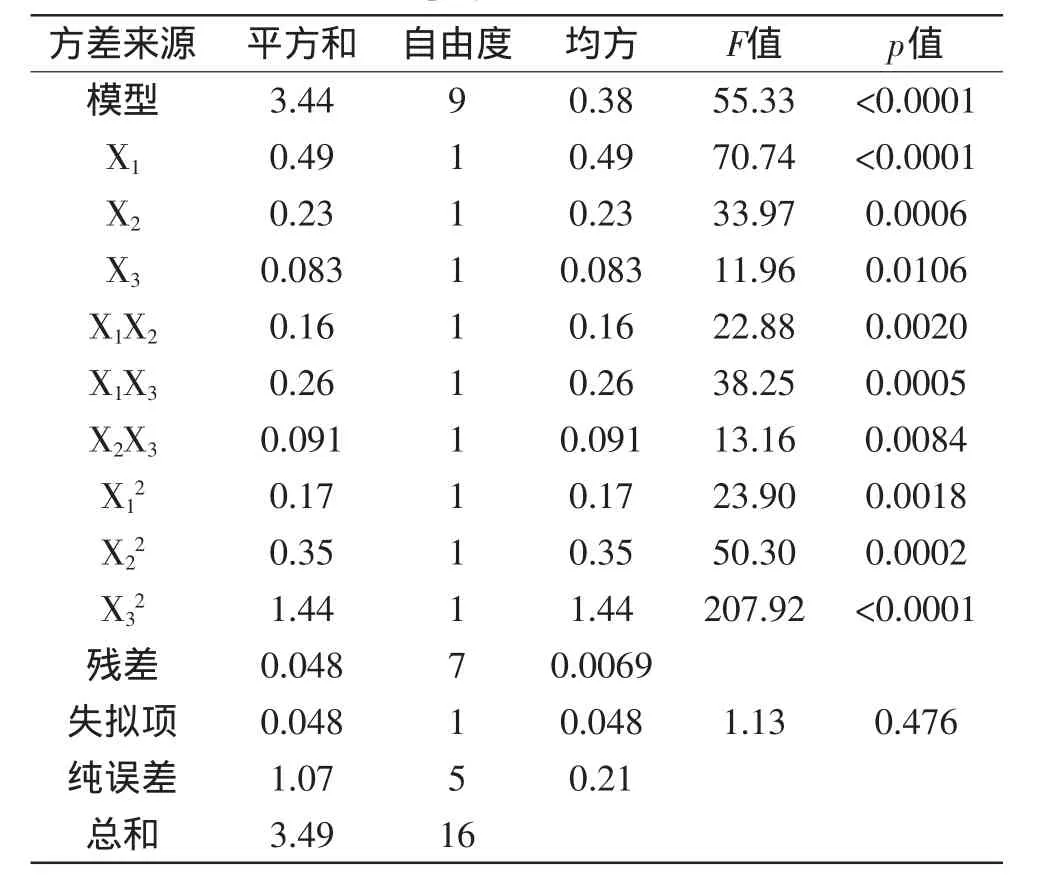
表3 多糖得率回归模型系数的显著性检验Table 3 Regression coefficient and ANOVA test of the yield of polysaccharide
由表3的分析结果可以看出三个因素对多糖得率影响的主次是X1>X2>X3,一次项X1、X2,二次项X12、X22、X32和交互项X1X2、X1X3、X2X3都是极显著的,X3为显著,表明各因素不是简单的线性关系,且对响应值的影响有明显的交互作用。
2.2.1 响应面结果分析 根据多糖得率Y的回归模型作出相应的响应面图4~图6。
图4显示的是提取温度与提取时间对籽瓜多糖得率的影响。当料液比为1∶1.72时,随着温度的升高,多糖得率呈现先升高再降低的趋势,提取时间越长得率越高,在料液比为1∶1.72,提取时间为85.18min,提取温度为49.34℃条件下,多糖得率达到最大(4.132%)。
图5显示的是提取温度为49.34℃条件下,料液比与提取时间的交互作用对多糖得率的影响。可以看出籽瓜多糖得率起初随着料液比和提取时间的增大而增加。当提取时间在85.18min内,多糖得率成指数增加,然而料液比对多糖得率的增加影响较小。
图6显示料液比与温度的相互作用较强,当提取时间为85.18min时,随着温度的升高、料液比的增加,多糖得率呈先升高后降低的趋势,在此条件下,料液比1∶1.72、温度49.34℃,多糖得率最高。
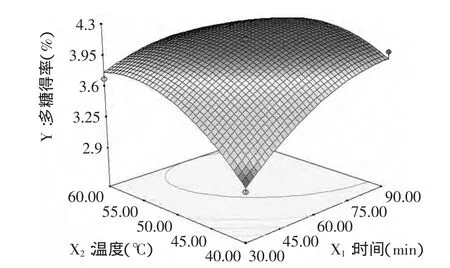
图4 温度、时间及其交互作用对得率影响的响应面图Fig.4 Response surface plot of the combined effects of temperature and time on the yield of polysaccharide
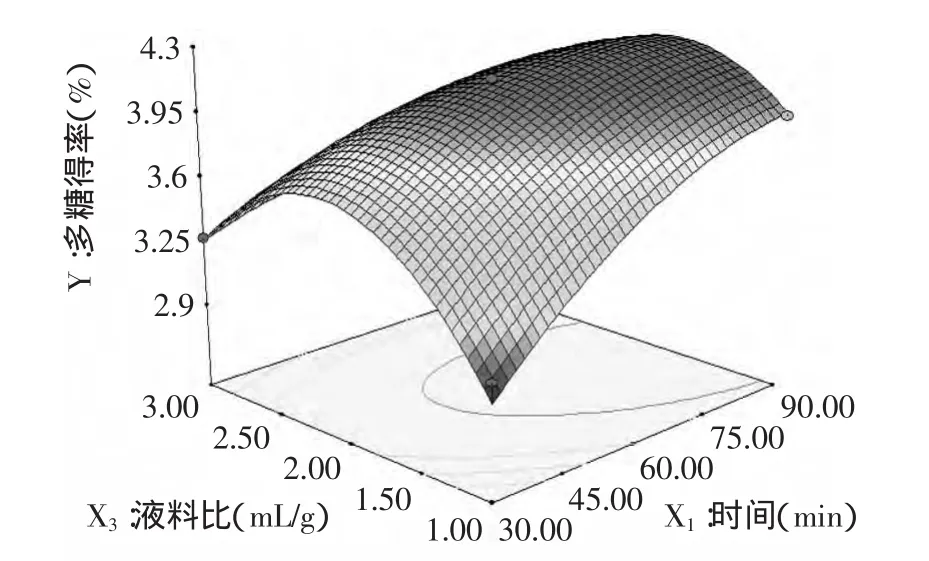
图5 时间、料液比及其交互作用对得率影响的响应面图Fig.5 Response surface plot and contour plot of the combined effects of time and ratio of material on the yield of polysaccharide
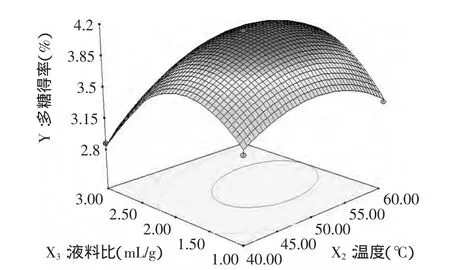
图6 温度、料液比及其交互作用对得率影响的响应面图Fig.6 Response surface plot of the combined effects of temperature and ratio of material on the yield of polysaccharide
2.2.2 优化提取参数和验证模型 由SAS分析得到籽瓜多糖的最佳提取条件为:超声波作用时间为85.18min,温度为49.34℃,料液比为1∶1.72(g/mL),理论最佳提取率为4.132%。为了检验响应面法的可行性,采用得到的最佳提取条件进行籽瓜多糖超声波辅助提取的验证实验,同时考虑到实际操作和生产的便利,因此将超声波辅助提取籽瓜多糖的各个实验因素条件修订为:时间为85min,温度为49℃,料液比为1∶1.7(g/mL)。经过5次平行实验,得到的平均得率为4.128%。

表4 最优条件与最优条件下的预测、实际值Table 4 Optimum conditions and the predicted and experimental value of response at the optimum conditions
2.3 籽瓜多糖的分子量测定

图7 籽瓜多糖的SEC-LLS检测结果图Fig.7 The result of SWP determined by SEC-LLS
籽瓜多糖的SEC-LLS色谱图如图7所示。色谱图显示单一峰值,表明样品的均匀性[13]。运用超声波辅助法提取的籽瓜多糖的分子量通过SEC-LLS最终确定为:重均分子量Mw=1.213×107,数均分子量为Mn= 1.089×106g/mol,分子量分布指数为Mw/Mn=11.136,表明分子量分布比较宽。
2.4 籽瓜多糖的红外光谱分析
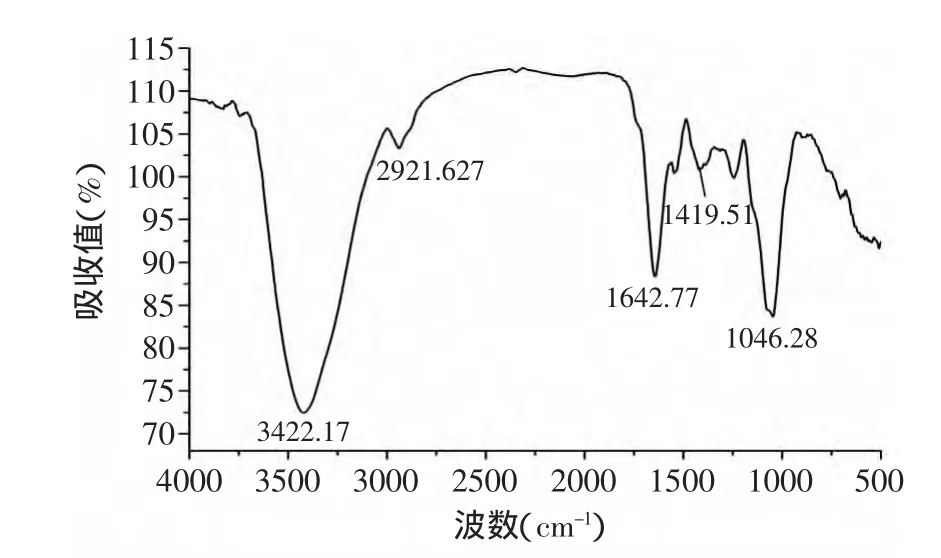
图8 籽瓜多糖的红外图谱Fig.8 FTIR spectra of Seed Watermelon polysaccharide
图8显示的是碳水化合物的光吸收特征。3422cm-1处为-OH伸缩振动峰,而2921cm-1和1419cm-1处的2组吸收峰分别代表了C-H的伸缩振动和变角振动,基本可以确认籽瓜多糖是糖类化合物[14]。1642.77cm-1处的吸收峰可能是-CHO中C=O的伸缩振动。1046.28cm-1处的吸收峰为C-O-H中的-OH的变角振动[15]。
2.5 籽瓜多糖的体外抗氧化活性评价
2.5.1 对DPPH自由基的清除作用 以抗坏血酸作对照,考察了籽瓜多糖对DPPH自由基的清除作用,结果如图9所示,与VC一样,籽瓜多糖对DPPH自由基的清除率随着浓度的增大而增强,存在浓度依赖性;当籽瓜多糖的浓度在0.01~0.32mg/mL的范围内,籽瓜多糖对DPPH自由基的清除率明显高于VC。籽瓜多糖浓度为1~5mg/mL时对DPPH自由基的清除率可达到68%。

图9 籽瓜多糖与VC对DPPH·自由基的清除能力比较Fig.9 Comparison of DPPH radical scavenging ability of SWP and VC
2.5.2 对羟基(·OH)自由基的清除作用 以抗坏血酸作对照,考察籽瓜多糖对羟基(·OH)自由基的清除作用,结果如图10所示。在所选浓度范围内,籽瓜多糖对羟基(·OH)自由基的清除率随着浓度的增大而增强,存在浓度依赖性,在浓度为5mg/mL时,籽瓜多糖的清除率达到75.35%。

图10 籽瓜多糖与VC对羟自由基的清除能力比较Fig.10 Comparison of hydroxyl radical scavenging ability of SWP and VC
2.5.3 对超氧阴离子(O2-·)的清除作用 以抗坏血酸作对照,考察籽瓜多糖对超氧阴离子(O2-·)的清除作用,结果如图11所示。在所选浓度范围内,籽瓜多糖对超氧阴离子(O2-·)的清除率随浓度的增加而增大。在浓度为5mg/mL时,籽瓜多糖对超氧阴离子清除率达到50%。
2.5.4 还原力 抗氧化剂的还原力与其抗氧化性之间存在一定的关系,抗氧化剂是通过自身的还原作用给出电子而清除自由基,还原力越强,抗氧化性越强。因此,可通过测定还原力来说明其抗氧化活性的大小。从图12可以看出,与VC相比,籽瓜多糖的还原力相对较弱,随着籽瓜多糖质量浓度的增加,其总还原力也逐渐增加,总体上呈现出一定的浓度依赖性。
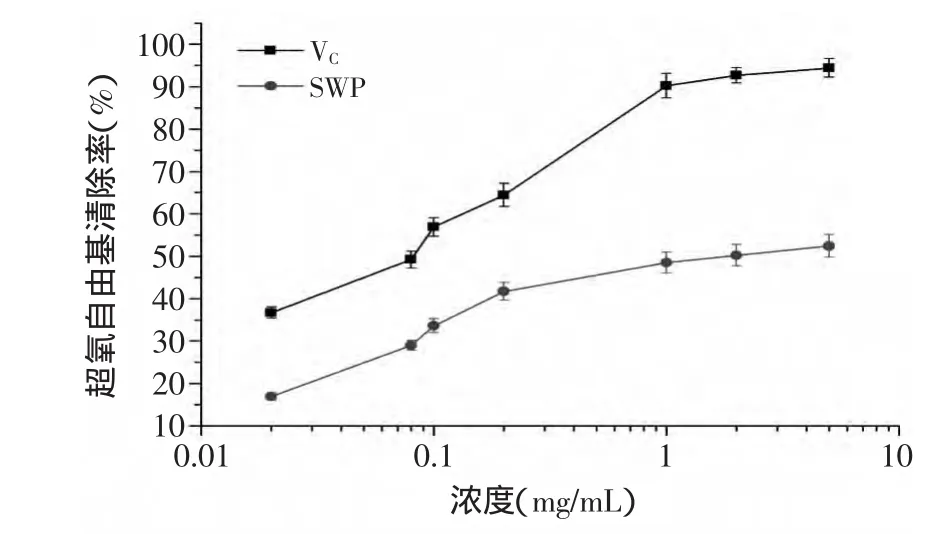
图11 籽瓜多糖与VC对超氧自由基的清除能力比较Fig.11 Comparison of Superoxide radical scavenging ability of SWP and VC
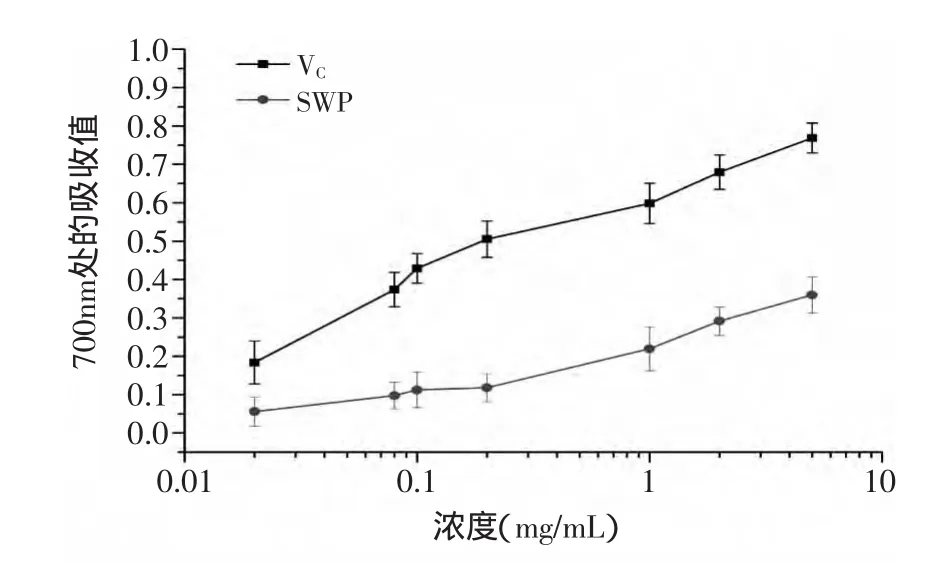
图12 籽瓜多糖与VC的还原力比较Fig.12 Comparison of of reducing power SWP and VC
3 结论
通过超声波辅助提取法提取籽瓜多糖,基于单因素实验,运用响应面法对籽瓜多糖提取时间、提取温度、料液比等实验条件进行优化,得到超声波辅助提取籽瓜多糖的最佳工艺条件为:时间为85min,温度为49℃,料液比为1∶1.7(g/mL)。在此条件下,籽瓜多糖的实际得率为4.128%,与预测值很接近。采用体积排阻色谱-光散射联用(SEC-LLS)测得籽瓜多糖的分子量为Mn=1.089×106g/moL。抗氧化评价结果显示,籽瓜多糖有显著的体外抗氧化活性,可以作为一种潜在的抗氧化剂应用于食品体系中,但籽瓜多糖可能的抗氧化机制还有待进一步研究。
[1]李金王,孙晓伟,杨来胜,等.兰州籽瓜[J].中国瓜菜,1989(2):8-9.
[2]甘肃省园艺学会瓜类专业委员会.对黑籽瓜生产与研究中一些术语与标准界定的意见[J].中国瓜菜,1999(2):31-33.
[3]马成广.籽瓜和兰州大片[M].中国土特产大全,1986:313-314.
[4]刘长缨,马永东,等.具有减肥、降脂功效的籽瓜渣保健食品:中国,CN 1465286[P].2004-01-07.
[5]王翠平.籽瓜抗氧化及抗肿瘤活性研究[J].安徽农业科学,2011,39(29):17833-17836.
[6]石蟲,陈靠山.植物多糖药理作用研究进展[J].曲阜师范大学学报,2005,31(3):100-103.
[7]郭华,侯冬岩,回瑞华,等.气相色谱-质谱法分析籽瓜中的化学成分[J].食品科学,2009,30(10):173-175.
[8]邵苗苗,李娜,赵兵,等.籽瓜养生保健作用研究[J].宁夏农林科技,2012,53(01):86-87.
[9]刘志明,唐彦君,吴海舟,等.苯酚-硫酸法测定葡萄酒中总糖含量的样品处理[J].中国酿造,2011,27(2):158-161.
[10]Baotang Zhao,Ji Zhang,Xiao Guo,et al.Microwave-assisted extraction,chemicalcharacterization ofpolysaccharidesfrom Lilium davidii var.unicolor Salisb and its antioxidant activities evaluation[J].Food Hydrocolloids,2013(31):346-356.
[11]Junlong Wang,Ji Zhang,Xiaofang Wang,et al.A comparison study on microwave-assisted extraction of Artemisia sphaerocephala polysaccharides with conventionalmethod:Molecule structure and antioxidantactivitiesevaluation[J]. International Journal of Biological Marchomolecules,2009(45):483-492.
[12]Yun-liang Yan,Chen-huan Yu,Jing Chen,et al.Ultrasonicassisted extraction optimized by response surface methodology,chemical composition and antioxidant activity of polysaccharides from Tremella mesenterica[J].Carbohydrate Polymers,2011(83):217-224.
[13]Sophie Aboughe Angone,Muriel Bardor,Eric Nguema-Ona,et al.Structural charac-terization of cell wall polysacchar ides from two plant species endemic to central Af-rica,Fleury aestuans and Phragmenthera capitata[J].Carbohydrate Polymers,2009(75):104-109.
[14]Sophie Aboughe Angone,Muriel Bardor,Eric Nguema-Ona,et al.Structural charac-terization of cell wall polysacchar ides from two plant species endemic to central Af-rica,Fleury aestuans and Phragmenthera capitata[J].Carbohydrate Polymers,2009(75):104-109.
[15]Kui Zhong,Qiang Wang.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrate Polymers,2010(80):19-25.
——兰州籽瓜

