两种国产乙型肝炎病毒核酸定量检测试剂的检测效能评价*
王洁,常静霞,张怡青,孟运运,汪茂荣
·乙型肝炎·
两种国产乙型肝炎病毒核酸定量检测试剂的检测效能评价*
王洁,常静霞,张怡青,孟运运,汪茂荣
目的比较两种国产不同核酸提取方法定量检测乙型肝炎病毒(HBV)核酸试剂的检测效能。方法选择经抗病毒治疗且HBV DNA载量在<1x104IU/ml的乙型肝炎患者血清标本36份,采用两种国产HBV核酸定量检测试剂盒平行检测HBV DNA,对阳性血清进行梯度稀释后再检测,从定量线性范围、准确性、灵敏度、特异性等方面比较两种试剂的差异。结果在36例临床血清中,14份经科华试剂检测的结果为<500 IU/ml,而圣湘试剂检测的结果仍>1.00×103IU/ml;对其中获得检测数据的31份标本进行两种试剂检测结果的相关性分析,发现一致性较好(r=0.817,P<0.05);两种方法检测乙型肝炎患者血清HBV DNA的阳性率分别为55.6%和94.4%,差异具有统计学意义(x2=12.07,P=0.000);对强阳性血清进行梯度稀释后定量检测显示,两种试剂检测水平的平均值与理论水平的线性相关性较好(湖南圣湘r=0.999,上海科华r=0.992),但圣湘所有检测的相对偏差均在±0.3logIU/ml之内,而科华有两次检测的相对偏差超出了±0.3logIU/ml范围,提示圣湘试剂检测结果更稳定,使用纳米磁珠核酸提取法的检测结果较煮沸法更加准确。结论以纳米磁珠为提取核酸方法不仅具有更广的线性范围,同时可显著提高国产HBV DNA检测试剂的灵敏度和准确性。
乙型肝炎病毒;核酸;国产检测试剂盒;效能
我国属于HBV感染高流行区,最近一次的全国乙型肝炎流行病学调查表明,HBsAg携带率已由1992年的9.75%降至2006年的7.18%,但总人数仍超过9000万[1~3],占全世界的1/4。我国已正式批准用于抗病毒治疗的核苷类药物有拉米夫定、阿德福韦酯、恩替卡韦和替比夫定。最重要和最直观的抗病毒疗效评价方法就是HBV核酸水平的显著下降,甚至转阴[4]。目前,国内普遍用于HBV核酸检测的方法为采用Taqman探针技术为基础的实时荧光定量PCR法,尽管试剂质量得到很大的改进,但在灵敏度、准确性及重复性等方面与进口优质试剂相比仍存在较大的差距。国产商品化HBV核酸检测试剂盒仍是基于即将废除的煮沸法提取核酸,最低检测限在500~1000 IU/ml之间,远不能满足临床准确诊断的需求。国际主流HBV DNA定量检测试剂的最低检测限已可达到9 IU/ml,如雅培公司的Real-Time HBV DNA assay。与国际主流试剂相比,国产试剂的检测灵敏度仅相差一个对数级。当HBV DNA处在1000 IU/ml以下水平时,国产试剂检测的结果对判断抗病毒治疗的疗效就有些困难[5]。然而,使用进口HBV核酸检测试剂的价格远远高于国产试剂。在国家“十一五”和“十二五”传染病防治重大专项等国家项目支持下,基于磁珠法的检测方法已逐渐应用于核酸(DNA和RNA)等多种生物物质的分离与纯化[6~8],与传统非磁性方法相比,步骤简单,无需离心,能够真正实现高通量自动化核酸提取,因而应用磁珠法核酸提取的国产HBV DNA定量试剂已成为主流研发的方向。该方法能够除去大多数干扰PCR的抑制因子,如蛋白质、多糖、酚类等物质[9],降低假阴性率。我实验室比较了湖南圣湘生物科技有限公司研发的新型HBV DNA定量试剂盒(磁珠法)和上海科华生物工程股份有限公司提供的HBV DNA定量试剂盒(煮沸法)的检测效能,现报道如下。
1 材料与方法
1.1 标本来源2013年1月~3月在我院接受抗病毒治疗的乙型肝炎患者36例,男24例,女12例;年龄19~72岁。所有患者的诊断均符合2010年修订的《慢性乙型肝炎防治指南》[10]。血标本无溶血、无脂血,抗-HAV、抗-HCV、抗-HEV、抗-HIV均为阴性。
1.2 血清HBV DNA检测使用美国应用生物系统公司(ABI)7300型实时荧光定量PCR仪和两种国产乙型肝炎病毒核酸定量检测试剂盒(湖南圣湘和上海科华)。以无抗凝剂干燥管抽取受试者静脉血4 mL,静置30 min,以3000r/m离心10 min,将血清转移至1.5 ml离心管,-20℃保存。应用上海科华定量试剂检测:严格按照说明书中“煮沸法-适用非毛细反应管类PCR反应管的操作步骤”进行操作,用ABI 7300 PCR仪自动扩增和检测核酸。该定量试剂对HBV DNA的最低检出限为500IU/ml。结果判定:HBV循环数(threshold cycles,Ct)>检测上限或未测出Ct数值为阴性,报告为<500IU/ml或低于检测下限;血清HBV DNA≧500IU/ml为阳性,检测结果在500~1.0×108IU/ml,报告具体数值;对>1.0×108IU/ml血清,则行进一步稀释,再检测。应用湖南圣湘定量试剂检测:采用磁珠法提取血清HBV DNA,用ABI 7300 PCR仪自动扩增和检测核酸。该试剂盒设置有HBV DNA内标准品,为TaqMan探针5′末端标记HEX荧光素,通过检测内标准品是否正常,来监测待测样本中是否具有PCR抑制物,避免PCR假阴性。同时设置有UNG酶+dUTP防污染措施,以排除假阳性结果。该试剂还设置有内参比荧光ROX,用于校正加样误差和管间差异,以提高定量的准确性。本试剂盒的最低检测下限为10IU/ml。结果判定:血清HBV DNA≧20IU/ml为阳性。对测定值在20~2.0×109IU/ml之间的血清,直接报告结果;当测定值>2.0×109IU/ml时,报告注明>2.0×109IU/ml。对需精确定量者,则对血清稀释1000倍后,再复测;对测定值≧10而<20IU/ml血清,同时内标检测为阳性且Ct≦40,表明病毒载量低,测定值仅供参考;对测定值<10IU/ml血清,同时内标检测为阳性且Ct≦40,则报告HBV DNA水平低于试剂盒检测下限。
1.3 统计学分析采用SPSSl7.0统计软件进行统计学分析,对两种国产试剂盒检测结果的相关性采用回归方程和直线相关分析,对检出阳性率进行x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两种试剂的检测结果两种国产试剂盒检测36例患者血清HBV DNA载量情况见表1。
2.2 两种不同核酸提取方法检测HBV DNA相关性分析采用两种试剂对36例临床血清样本进行检测,其中31例获得具体结果,另5例为一种或两种试剂检测为阴性。对31例阳性血清结果取对数值,应用SPSS17.0统计学软件进行相关性分析,并获得回归方程,见图1。

图1 两种试剂定量检测HBV DNA结果的散点图回归方程:Y=0.67x+0.39,r=0.817,P<0.05
2.3 两种不同核酸提取方法检测HBV DNA阳性率比较磁珠法(湖南圣湘)检测的阳性率明显高于煮沸法(上海科华,P<0.05,表2)。
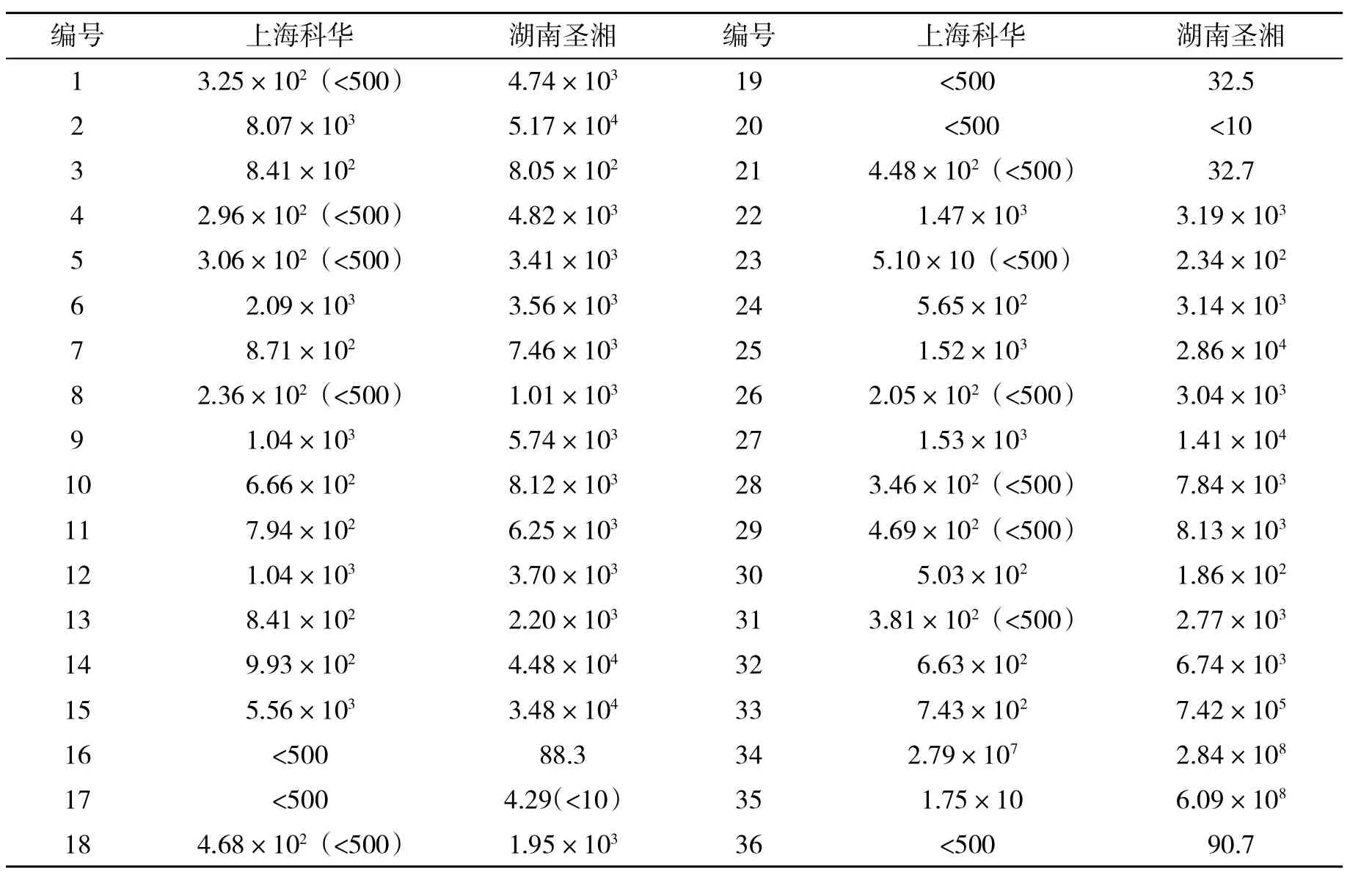
表1 两种试剂测定HBV DNA结果(IU/ml)
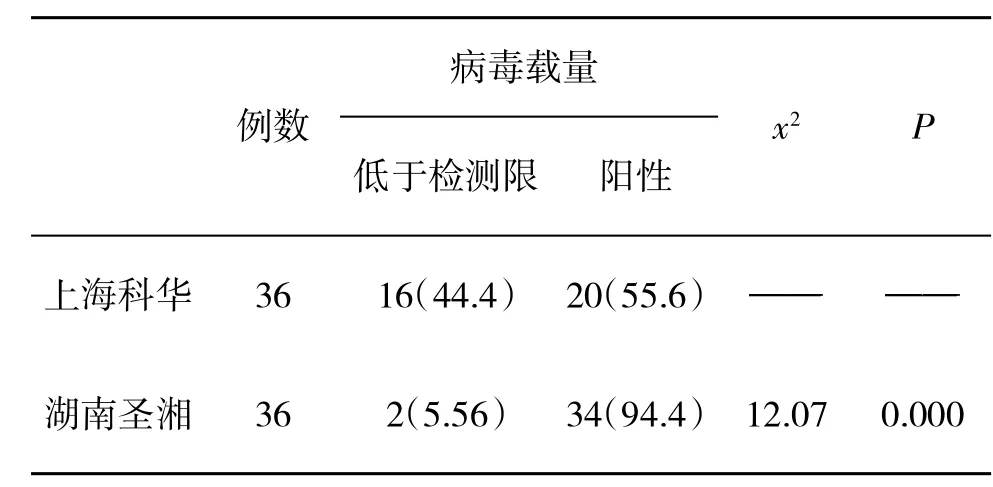
表2 两种试剂检测HBV DNA阳性率(%)比较
2.4 强阳性血清经梯度稀释后的检测结果分析对试剂盒提供的强阳性血清标准品(4.00×107IU/ml)进行稀释后,采用两种试剂各重复检测2次,以评价两种试剂检测的准确度。结果见表3。两种试剂检测水平的平均值与理论水平的线性相关性较好(湖南圣湘r=0.999和上海科华r=0.992),但圣湘所有检测的相对偏差均在±0.3 log IU/ml之内,而科华有两次检测的相对偏差超出了±0.3 log IU/ml范围,提示圣湘试剂检测结果更稳定。
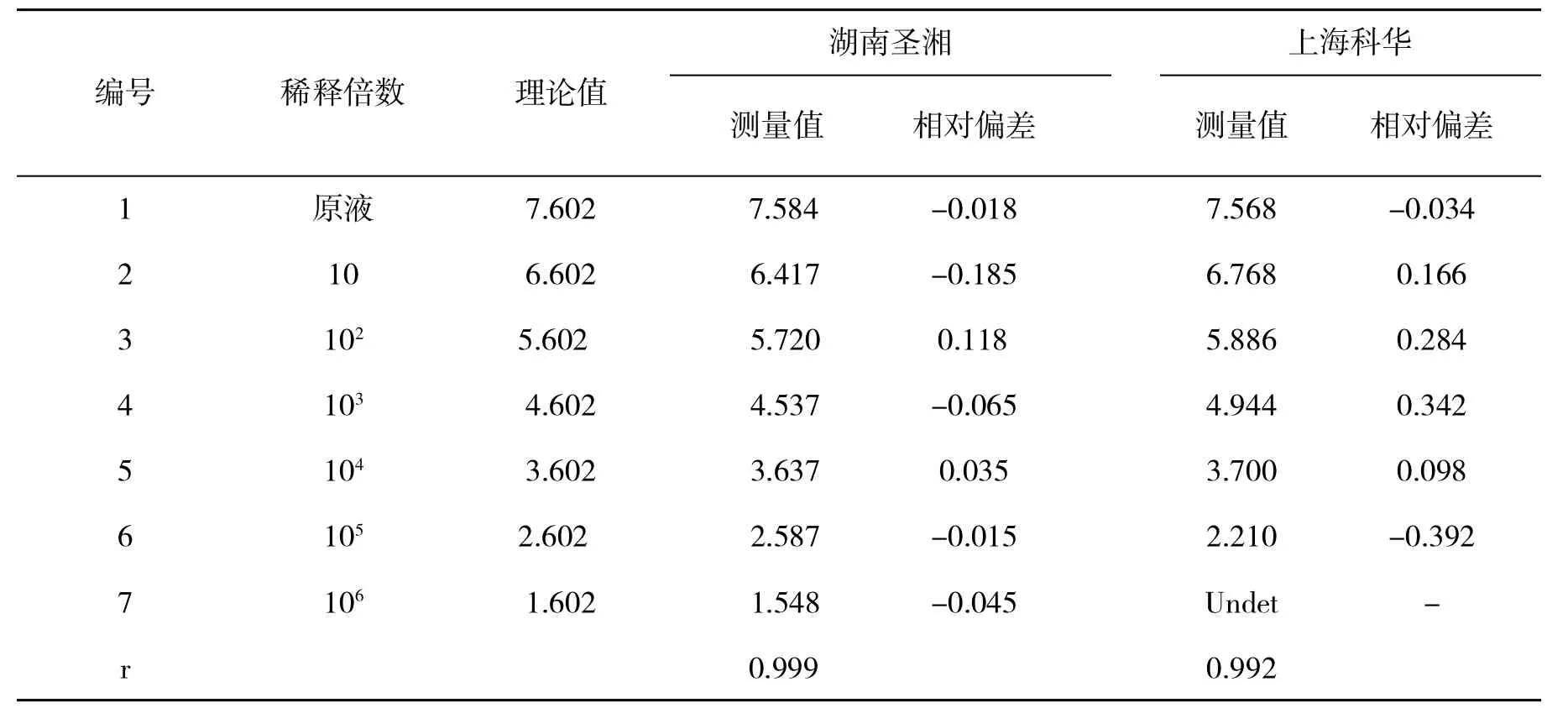
表3 强阳性标准血清经稀释后的检测结果(lg IU/ml)分析
3 讨论
HBV DNA定量检测对于分析HBV感染的疾病进展、抗病毒治疗的疗效评估及耐药检测均有重要意义。目前,国内生产的HBV DNA定量试剂盒有20余种,这些试剂的检测灵敏度和检测范围参差不齐,特别对于一些接受抗病毒治疗的慢性乙型肝炎患者,经国产试剂盒检测为“HBV DNA低于检测下限”,但经进口试剂仍可检测到HBV DNA,说明国产试剂的检测灵敏度较低。
有文献报道,在病毒水平为1.00×103~1.00×108IU/ml范围内,国产试剂检测结果的差异较小。本文发现81.7%的血标本经两种试剂检测结果一致。总体而言,科华试剂的检测结果普遍比圣湘试剂的检测结果低,在14例血标本,科华试剂检测的结果为<500 IU/ml,而圣湘试剂仍能检出定量水平(>1.00×103IU/ml)。
通过本实验发现,在低病毒载量时,不同国产试剂检测结果的差异较大,而湖南圣湘试剂表现出相对较高的灵敏度。两者的主要差异在于核酸提取方法的不同,传统的煮沸法提取核酸很可能造成核酸的损失,从而直接影响到检测结果。对强阳性样本经梯度稀释后进行的定量检测结果说明,圣湘试剂的定量结果更准确、更稳定。
综合评价,我们认为在检测HBV DNA时,采用磁珠分离法提取核酸优于煮沸法。分析造成目前国内常用的HBV DNA定量检测试剂盒检测质量不高的原因主要有以下几点:①加样量的差异。进口试剂以Roche和Abbott为例,两者血浆用量通常为850μl和200~500μl,纯化后的加样量均为50μl,而国产试剂,血清或血浆用量为100μl,在行PCR时的上样量仅为2μl,尽管这在一定程度上简化了操作程序,但可能导致了试剂灵敏度的降低和检测结果的不准确。圣湘试剂盒在这一方面做了一些改进,在一定程度上加大了血清用量和模板量,有利于阳性率的提高和结果的稳定;②核酸提取方法的差异。国内目前所采用的煮沸法,只是将核酸从病毒颗粒中释放出来,离心后则吸取上清用于扩增,中间并无任何纯化步骤,这就使离心后的上清中存在一定量的干扰物质,例如样本中血红蛋白和一些其他蛋白物质等,而血红蛋白可与聚合酶发生不可逆结合,抑制酶的活性,从而导致灵敏度降低,且影响试验的重复性,这也是目前主流国产试剂盒较大的弊端所在;③试剂的质量控制不足。常用的国产试剂盒采用的是外标,包括病毒外标和质粒外标。虽然病毒外标可以与待测样本平行参与提取和扩增过程,但却不能做到每管均得到控制。质粒外标并不参与核酸的前处理过程,因而无法监测核酸提取环节。圣湘采用的磁珠核酸提取法,能完全、特异地分离样本中的核酸,大大提高纯化效率及纯度,去除标本中蛋白及多糖类物质的干扰,为后续检测提供了质量保证,加样50μl也进一步保证了样本病毒的检出,特别是在低水平样本。同时,试剂盒采用的是内标,在试验的第一步样本提取时即加入,直到最后一步的样本扩增,实现了全程监控,有效地避免了因提取或扩增失败导致的假阴性结果。
由于本文只实验检测了一些低病毒载量标本,对于超高病毒载量(>2.00×108IU/ml)血清标本的检测还有待于研究。但是,我们已经看到了,将纳米磁珠核酸提取法与国产试剂结合后的优势,因为这样可以大大提高分析的灵敏度,扩大了检测的线性范围,提高了阳性检出率[5]。随着抗HBV药物的大规模推广使用,HBV DNA水平是一个很重要的监测指标,但往往因为HBV DNA检测结果报告为“低于最低检测限”,却并不是病毒得到了完全清除的指标,容易误导临床判断。检测本身对实验过程也提出了更高的要求,例如防止样本的交叉污染、产物气溶胶污染的控制等等。
[1]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[2]邓庆梅,高勇,何皖,等.原发性肝癌患者血清HBV标志物和HBV DNA测定的临床意义.实用肝脏病杂志,2012,15(5): 414-416.
[3]庄辉.加强乙型肝炎防治.北京大学学报,2009,41(3):259-262.
[4]Wong GL,Chart HL.Predictors of treatment response in chronic hepatitis B.Drugs,2009,69(16):2167-2177.
[5]楼滨,张杰,崔大伟,等.基于磁珠核酸提取方法对现有国产HBV DNA试剂盒分析灵敏度的改进.中华检验医学杂志,2010,33(10):913-917.
[6]李成德,黄晓佳,陈雄毅.不同核酸提取方法在HBV DNA荧光定量检测中的比较.国际检验医学杂志,2010,31:1361-1363.
[7]张琼予,丁梅,王保捷,等.DNA提取自动化T工作站在法医学领域的应用.中国法医学杂志,2010,25:4042.
[8]刘君,裴豪,陈燕燕,等,磁珠法检测抗酸杆菌的方法建立与临床应用.中华医院感染学杂志,2011,2l:4861-4863.
[9]Watson RJ,Blackwell B.Purification and characterization of acommon soil component which inhibits the polymeruse chainreaction.J Microbiol,2000,46(7):633-642.
[10]陈瑜.HBV感染标志物检测:过去、现在及展望.中华检验医学杂志,2010,33(2):189-192.
(收稿:2014-02-10)
(校对:陈从新)
Evaluation of two domestic kits for quantitative detection of serum hepatitis B virus nucleic acids
Wang Jie,Chang Jingxia,Zhang Yiqing,et al.Institute of Liver Disease,81st Hospital of PLA,Nanjing 210002,Jiangsu Province,China
ObjectiveTo evaluate the efficacy of two domestic kits using different nucleic acid extraction methods for quantitative detection of serum hepatitis B virus(HBV)nucleic acids.MethodsThirty-six serum samples from hepatitis B patients with HBV DNA levels<1x104IU/ml after antiviral treatment were collected and HBV DNA was detected by kits from two pharmaceutical Co..The quantitative linear range,accuracy,sensitivity and specificity of each kits were evaluated and compared.ResultsOut of 36 serum samples,the HBV DNA levels in 14 were<500 IU/ml by KELONG reagent,while they were>1.00×103IU/ml by San Xiang reagent;There was a good correlation in 31 samples by the two reagents(r=0.817,P<0.05);The positive rates ofserum HBV DNA were 55.6%and 94.4%,respectively,by the two kit detection(x2=12.07,P=0.000);We detected serum HBV DNA in some strong positive samples after serial dilution and the results showed a good linear correlation(San Xiang:r= 0.999,KELONG:r=0.992);The relative deviations by San Xiang kit repetition was within±0.3logIU/ml,while it was beyond±0.3logIU/ml in two detections by KELONG.ConclusionsThe findings in this study suggests that the San Xiang reagent is more stable as it use nanometer magnetic extraction,which might be superior to boiling method for DNA extraction because the magnetic nanoparticle has wider liner ranger and significantly improves the sensitivity and accuracy of HBV DNA detection.
Hepatitis B virus;Nucleic acids;Domestic kits;Efficacy
10.3969/j.issn.1672-5069.2014.04.009
国家十二五传染病重大专项课题(编号:2012ZX09303-001-002)
210002南京市南京军区解放军第81医院全军肝病中心
王洁,女,35岁,医学硕士,主管技师。主要从事病毒性肝炎实验室诊断研究。E-mail:wangjiej@126.com
汪茂荣,E-mail:maorongwang@gmail.com

