托伐普坦治疗顽固性腹水疗效及安全性分析*
郑俊福,张鑫,赵文敏,李鹏,范春蕾,李冰,李磊,董培玲,丁惠国
·肝硬化·
托伐普坦治疗顽固性腹水疗效及安全性分析*
郑俊福,张鑫,赵文敏,李鹏,范春蕾,李冰,李磊,董培玲,丁惠国
目的观察高度选择性血管加压素V2受体拮抗剂托伐普坦治疗顽固性腹水的疗效和安全性。方法在39例终末期肝病(20例肝硬化、19例肝硬化合并肝癌)引起的顽固性腹水患者,常规给予利尿剂(呋塞米80 mg/d;螺内酯160 mg/d)及白蛋白治疗的基础上,给予托伐普坦15 mg/d口服,治疗5~14 d。观察尿量、腹水消退、双下肢水肿改善及血清钠和肝功能变化情况。结果在托伐普坦治疗结束后24 h,患者平均尿量为(3533.3± 154.65)ml/d,明显高于治疗前(1851.3±167.12)ml/d(P<0.01);82.5%(32/39)患者腹水改善,2例I型肝肾综合征患者对托伐普坦治疗无明显效果;在21例低钠血症患者中,血清钠较治疗前[(128.1±4.25)mmol/L]明显上升[(132.9±4.1)mmol/l,P<0.01];治疗前后患者MELD评分[(37.5±5.6)对(38.1±5.7)]、血钾水平[(4.1±0.5)mmol/L对(4.2±0.6)mmol/L]无明显变化;该药的不良反应以口干、口渴为主,发生率为15.4%。结论托伐普坦对终末期肝病引起的顽固性腹水患者有一定的利尿作用,可同时纠正低钠血症,短期应用托伐普坦对肝功能无明显影响。
顽固性腹水;终末期肝病;托伐普坦;低钠血症
腹水是肝硬化等终末期肝病的常见并发症之一。在腹水的病因中,85%是由于肝硬化所致[1]。在肝硬化腹水患者中,10%~15%腹水患者发展为顽固性腹水。欧美指南对顽固型腹水的定义是指经过限盐(小于2 g/d)和利尿剂(呋塞米160 mg/d;螺内酯400 mg/d)等标准治疗至少1 w,或腹腔穿刺后大量放腹水后很快又早期复发,腹水仍不能消退或满意控制的临床状态[2,3]。顽固性腹水是终末期肝病患者常见的严重并发症之一,治疗困难,预后极差[1~3]。目前国外指南推荐顽固性腹水的治疗包括低钠饮食、足量的利尿剂、大量放腹水、经颈静脉门体静脉分流术(TIPS)及肝移植[2,3],仍缺乏有效的治疗方法。托伐普坦(tolvapta)是一种血管加压素V2受体拮抗剂。托伐普坦具有强大的促排水作用。Okita K et al[4]临床研究发现,托伐普坦对单纯性肝硬化腹水及低钠血症有较好的治疗效果。但是,托伐普坦对终末期肝病引起的顽固性腹水的疗效及安全性如何,国内外未见报告。本研究观察了托伐普坦治疗终末期肝病合并顽固性腹水患者的疗效及安全性。
1 对象与方法
1.1 研究对象2012年5月~2013年2月符合条件的39例终末期肝病(肝硬化20例或合并原发性肝癌19例)导致的顽固性腹水患者被纳入研究。诊断符合2010年慢性乙型肝炎防治指南及中国原发性肝癌诊疗规范(2011年版)[5,6]。顽固性腹水的诊断参考美国肝病学会2012年发布的腹水处置指南[3],结合我们临床经验行适当修改,即,①限制钠摄入(<6 g/d)、间断输注白蛋白(10~20 g/d)和大剂量利尿剂(呋塞米160 mg/d;螺内酯200 mg/d)治疗1 w;②或经治疗性腹腔穿刺放腹水(3000~5000 ml)后2 w腹水仍不能有效控制。排除心、肺、脑及严重血液系统疾病及合并严重的精神疾病。肝肾综合征诊断参考2007年国际腹水协会制定的肝肾综合征诊断与分型标准[7],即,①血清肌酐>1.5 mg/dl或48 h内较基线增加0.5 mg/dl;②除外休克及正在或最近应用过肾毒性药物;③除外肾脏器质性病变、尿蛋白阳性及红细胞>5个/HP和(或)异常肾脏超声影像。患者及家属给出知情同意书,本研究方案获得我院伦理委员会批准。
1.2 治疗方法在限制盐摄入(<6 g/d)、间断输注白蛋白(10~20 g/d)及常规利尿剂(呋塞咪40~80 mg/d,螺内酯80~160 mg/d)的基础上,给予托伐普坦(浙江大冢制药有限公司)15 mg/d口服,持续服用5~14 d后停药,随访1月。
1.3 观察指标记录24h尿量,晨起空腹测定腹围、体质量。采用170型电化学发光法测定乙型肝炎病毒标志物和丙型肝炎病毒标志物(Roche公司,德国);采用电化学发光法测定甲胎蛋白(雅培公司试剂,美国);使用全自动生化分析仪检测血清生化及肾功能指标(AU5400,奥林巴斯公司,日本)。
1.4 疗效评价①尿量显著改善:24 h尿量较治疗前增加大于1000 ml,尿量改善:24 h尿量较治疗前增加500ml~1000 ml,尿量无变化:24 h尿量较治疗前增加小于500 ml;②下肢水肿:选择双足中水肿程度较重一侧,检查部位选择胫骨嵴或足背。显著改善:完全看不到压痕为无水肿,改善:可见压痕为轻度水肿,无变化:明显压痕为重度水肿;③腹围:平卧以脐的水平位置绕腹一周测定腹围。显著改善:治疗后腹围减少2 cm以上,改善:腹围减少0~2 cm,无变化:无减少或增加。
1.5 统计学方法采用SPSS 16.0统计软件处理,计量资料以()表示,组间比较采用t检验,率的比较采用x2检验,P<0.05为有统计学意义。
2 结果
2.1 患者基本特征见表1。

表1 39例顽固性腹水患者临床基本特征(%)
2.2 疗效在托伐普坦治疗结束时,评价患者24 h尿量,下肢浮肿及腹围变化情况。患者24 h尿量为(3533.3±154.6)ml,明显多于治疗前的(1851.3± 167.1)ml(P<0.01);在39例患者中,治疗结束时32例(82.5%)腹水明显改善或改善;治疗开始时存在下肢水肿的24例患者在治疗结束时22例(91.7%)显著改善或改善;亚组分析发现,在治疗开始时合并肝癌的19例患者在治疗结束时16例(84.2%)腹水显著改善或改善;在治疗开始时合并肝肾综合征的9例患者在治疗结束时7例(77.8%)腹水显著改善或改善,但其中I型肝肾综合征患者在托伐普坦治疗后,对消退腹水无效(表2)。治疗前存在低钠血症患者21例(53.8%)。在低钠血症患者中,血清钠较治疗前明显上升(P<0.01,表3)。
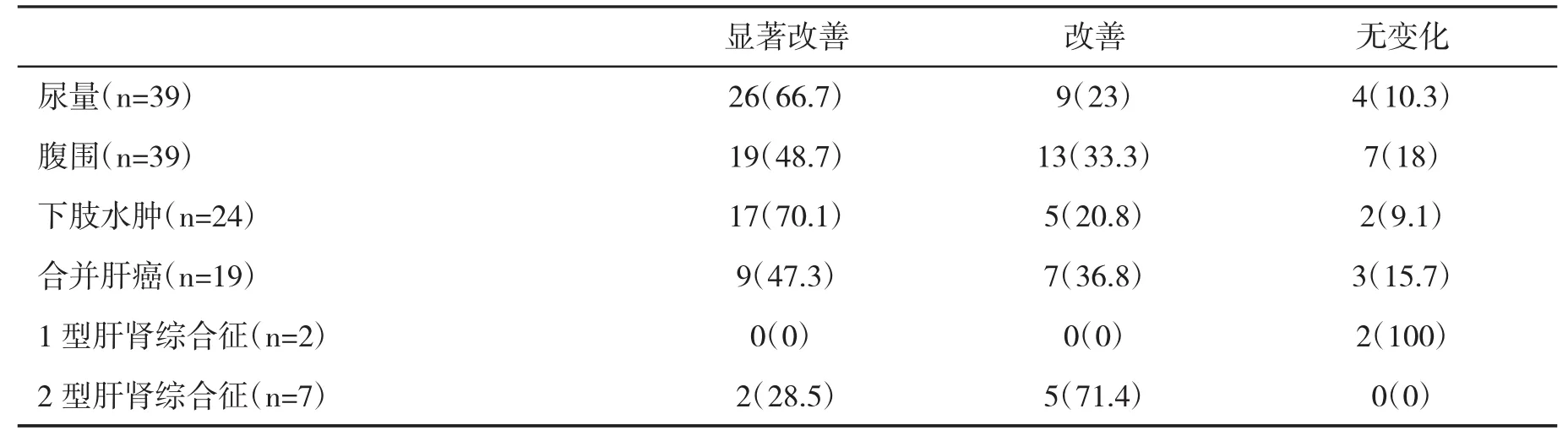
表2 治疗前后主要观察指标及特殊并发症改善情况(%)

表3 治疗前后血钠浓度比较
2.3 不良反应评价本组口干、口渴为主要不良反应,发生率为15.4%。13例肝性脑病患者在治疗后病情无加重,经脱氨灌肠等治疗,其中11例肝性脑病程度明显减轻。在9例肝肾综合征患者中2例1型肝肾综合征患者尿量无增加,肾功能持续恶化,在治疗结束3 d后死亡;在7例2型肝肾综合征患者中,5例肾功能好转。在39例患者中,11例在治疗结束1 m死亡,与应用药物无关,主要死因为在治疗前已经发生肝肾综合征、肝癌及肝硬化的并发症。本组患者治疗前后肝功能无明显变化(表4)。
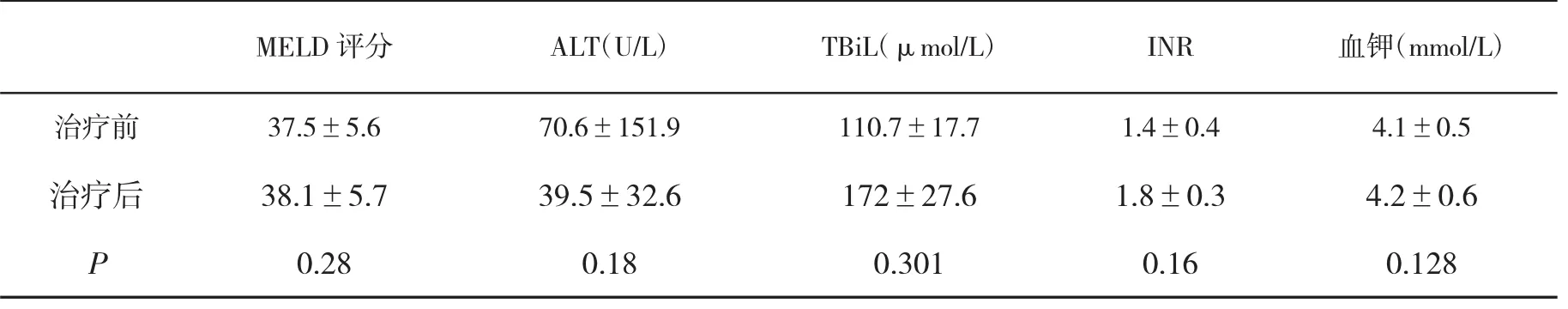
表4 治疗前后MELD评分、肝功能、凝血及电解质比较
3 讨论
肝硬化患者腹水的形成主要与两个发病机制有关[8,9]:即门脉高压和肾水钠潴留。门静脉压力水平不断增加的门脉血流代偿可引起门静脉高压逐渐形成,并将压力向后传导至内脏毛细血管,结果是多余的液体首先在腹腔积聚。门脉窦压力升高也与外周的尤其是内脏动脉血管的扩张有关,内脏动脉血管的扩张导致动脉供血局部内脏血流增加,进一步加重门脉高压,降低中心(或有效)循环血容量。第二个机制是肾水钠潴留,这也与门脉高压有关并且先于腹水出现,但对肾水钠潴留这一机制是有争议的:是门脉高压诱导的肝肾反馈作用[10~12]还是肝硬化腹水患者血流动力学紊乱,激活肾素-血管紧张素-醛固酮系统及交感神经系统?有人认为早期发生的水钠潴留并不是对于动脉血容量显著下降的反应[13~15]。
在失代偿晚期肝硬化,由于外周血管阻力进一步下降,易发生低血压,为维持血流动力学的稳定,机体往往通过两个机制形成代偿。一个是释放更多的血管收缩因子以增加外周血管阻力,另一个是增加心输出量以充满扩张的外周血管床[16,17]。随着肝硬化的进展和外周血管扩张到一定程度,心脏将不能代偿,这时,阻止动脉低血压发生只有通过进一步增加内源性血管活性物质,如交感神经系统、抗利尿激素和加压素的释放[18]。血管加压素(vasopressin,AVP)又称抗利尿激素(antidiuretic hormone,ADH),由下丘脑的视上核和视旁核的神经元分泌,与远曲小管和集合管上皮细胞管周膜上的V2受体结合后,增加管腔膜上的水通道,从而增加水的通透性,水通过管腔膜进入细胞后,自由通过基侧膜进入毛细血管而被重吸收,使尿液浓缩,尿量减少,肾小球-肾小管平衡被破坏,是肝硬化腹水发生的重要机制[18~21]。
如何减少肝硬化腹水患者的水钠潴留?螺内酯的代谢产物能竞争性地抑制醛固酮与远曲小管和集合管细胞质内的特异性受体蛋白结合,影响K+-Na+交换,发挥排Na+、排水、保K+作用。但是,螺内酯起效慢,用药2~4天后才起利尿作用。另一个常用的利尿剂,呋噻米作用于髓袢升支细胞,减少Cl-和Na+的重吸收,还可通过增加肾血流量而利尿。其利尿作用强大,口服吸收快,30分钟起效,1~2小时后达高峰,3~4小时作用消失。新的利尿药物托伐普坦不同于前面提到的两类利尿剂,其为高度选择性非肽类血管加压素V2受体拮抗剂,不激活肾素-血管紧张素-醛固酮系统或交感神经系统,利尿作用强,能增加尿液排出和抑制水的重吸收,对血清钾和尿液钠、钾浓度的影响并不显著,且能明显减轻患者体质量和水肿程度,有效纠正低钠血症[22~25]。
在肝硬化腹水患者中,10%~15%是因为利尿剂的尿钠排泄作用不足,或者更常见的是,由于利尿剂的严重副作用迫使病人不得不停用利尿剂,以致发展为顽固性腹水。许多顽固性腹水病人也伴随肾功能不全或肝肾综合征2型。目前国内外指南推荐顽固性腹水的治疗包括低钠饮食、足够的利尿剂量、定期大量放腹水或经颈静脉门体静脉分流术(TIPS)及肝移植。腹腔穿刺大量放液是治疗顽固性腹水最简便的方法,但放液后的最常见的并发症为“有效的”低血容量和肾损伤,这被叫做腹腔穿刺放液诱导的心功能不全(PICD),增加患者死亡的风险。在理论上,血浆扩容是预防PICD的有效方法。因为血管扩张是PICD发生的关键因素,推测血管收缩剂(如特力加压素或米多君)可预防PICD,但无临床证据的支持。一项随机对照试验证实TIPS较反复穿刺放液能有效控制腹水。然而,TIPS的置入加重了肝性脑病发生的可能[26]。因此,考虑到放置TIPS的许多禁忌证,使其的应用仍有争议。穿刺放液仍是治疗顽固性腹水的首选。临床研究发现,只有肝移植可能提高这些患者的生存率。大多数顽固性腹水的肝硬化病人伴有低钠血症及血管加压素的释放增加。最近一项多中心的RCT验证了satavaptan对肝硬化病人的排水作用。联合低剂量利尿剂,应用satavaptan治疗14天,加速了非难治性腹水的肝硬化病人的腹水消退[27]。托伐普坦是一类新的排水药物,也不同于satavaptan,临床应用经验尚不多,对顽固性腹水的疗效尚未见报告。
本组39例终末期肝病患者均有严重的肝硬化基础,其中19例合并肝癌,并存在多种肝硬化并发症,如并发肝性脑病13例,肝肾综合征9例,均存在顽固性腹水。在托伐普坦治疗后,90%患者尿量增加。其中对合并2型肝肾综合征的7例患者,尿量也有明显增加,对合并肝性脑病的13例患者的治疗是安全的,其中11例患者经针对肝性脑病的治疗,肝性脑病程度有所减轻,而4例尿量无增加的患者,其中2例为1型肝肾综合征,2例存在严重的腹腔感染,经积极抗生素治疗,腹腔感染仍不能控制,其余13例存在腹腔感染的患者,经有效抗生素治疗后,对托伐普坦治疗仍有尿量增加反应。因此,考虑托伐普坦对1型肝肾综合征患者无效,对存在腹腔感染患者的治疗效果差,应积极应用抗生素控制腹腔感染,当感染控制后可再应用托伐普坦治疗腹水。
本组外周浮肿缓解率达到91.6%,但只有19例(48.7%)患者同时腹水明显消退。因此,托伐普坦对增加晚期肝硬化患者尿量效果更明显,而腹水消退作用稍差。顽固性腹水的发生机制较为复杂,多认为与肝脏灭活作用减弱、有效循环血量显著减少、肾脏血流灌注不足、抗利尿激素和雌激素增多、激肽释放酶-激肽系统释放的胰激肽(赖氨酰缓激肽、血管舒张素)减少、前列腺素、心房利钠多肽(ANP)减少等体液性物质的形成和灭活异常有关[3]。因此,治疗顽固性腹水应多种药物联合应用。托伐普坦可明显提高合并低钠血症患者血钠水平,但对于血钠正常者无明显提升作用。
总之,托伐普坦对于终末期肝病合并顽固性腹水疗效显著,可同时纠正低钠血症,对肝功能无明显影响。由于病例数少,没有严格的对照,托伐普坦对于终末期肝病合并顽固性腹水的疗效及安全性仍需要临床大样本病例的验证。
[1]Schouten J,Michielsen PP.Treatment of cirrhotic ascites.Acta Gastroenterol Belg,2007,70(2):217-222.
[2]European Association for the Study of the Liver.EASL clinical practice guidelines on the management of ascites,spontaneous bacterial peritonitis,and hepatorenal syndrome in cirrhosis.J Hepatol,2010,53(3):397-417.
[3]Runyon BA.Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012.Hepatology,2013,57(4):1651-1653.
[4]Okita K,Sakaida I,Okada M,et al.A multicenter,open-label,dose-ranging study to exploratively evaluate the efficacy,safety and dose-response of tolvaptan in patients with decompensated liver cirrhosis.J Gastroenterol,2010,45(9):979-987.
[5]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[6]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肝胆病杂志,2011,27(11):1141-1159.
[7]Salerno F,Gerbes A,Gines P,et al.Diagnosis,prevention and treatment of hepetorenal syndrome in cirrhosis.Gut,2007,56(9):1310-1318.
[8]赵守松.肝肾综合征的研究现状.实用肝脏病杂志,2006,9(1): 58-61.
[9]乔飞,汪茂荣,何长伦,等.肝硬化顽固性腹水早期预测及相关因素分析.实用肝脏病杂志,2008,11(5):312-314.
[10]刘红虹,罗生强,福军亮,等肝硬化顽固性腹水的治疗新进展.实用肝脏病杂志,2011,14(4):317-320.
[11]Schrier RW.Pathogenesis of sodium and water retention in high-output and low-output cardiac failure,nephrotic syndrome,cirrhosis,and pregancy.N Engl J Med,1988,319:1127-1134.
[12]Lieberman FL.Overflow theory of ascites formation.Gastroenterology,1989,96:274.
[13]Gattoni A,Marotta F,Vangieri B,et al.Hepatorenal syndrome. Clin Ter,2004,155:375-389.
[14]Levy M,Wexler MJ.Hepatic denervation alters first-phase urinary sodium excretion in dogs with cirrhosis.Am J Physiol,1987,253:F664-F671.
[15]Kostreva DR,Castaner A,Kampine JP.Reflex effects of hepatic baroreceptors on renal and cardiac sympathetic nerve activity. Am J Physiol,1980,238:R390-R394.
[16]Bernardi M,Fornalè L,Di Marco C,et al.Hyperdynamic circulationofadvancedcirrhosis:are-appraisalbasedon posture-induced changes in hemodynamics.J Hepatol,1995,22: 309-318.
[17] Schrier RW. Decreased effective blood volume in edematous disorders:what does this mean ?J Am Soc Nephrol,2007,18:2028-2031.
[18] Leiva JG,Salgado JM,Estradas J,et al. Pathophysiology of ascites and dilutional hyponatremia:contemporary use of aquaretic agents. Ann Hepatol,2007,6:214-221.
[19] Lehrich RW,Greenberg A. Hyponatremia and the use of vasopressin receptor antagonists in critically ill patients. J Intensive Care Med,2012,27(4):207-218.
[20] Habib S,Boyer TD. Vasopressin V2-receptor antagonists in patients with cirrhosis,ascites and hyponatremia. Therap Adv Gastroenterol,2012,5(3):189-197.
[21] Yi JH,Shin HJ,Kim HJ. V2 receptor antagonist:tolvaptan. Electrolyte Blood Press,2011,9(2):50-54.
[22] Schrier RW,Gross P,Gheorghiade M,et al. Tolvaptan,a selective oral vasopressin V2-receptor antagonist,for hyponatremia. N Engl J Med,2006,355(20):2099-2112.
[23] Cárdenas A,Ginès P,Marotta P,et al. Tolvaptan,an oral vasopressin antagonist,in the treatment of hyponatremia in cirrhosis. J Hepatol,2012,56(3):571-578.
[24] Dasta JF,Chiong JR,Christian R,et al. Evaluation of costs associated with tolvaptan-mediated hospital length of stay reduction among US patients with the syndrome of inappropriate antidiuretic hormone secretion,based on SALT-1 and SALT-2 trials. Hosp Pract,2012,40(1):7-14.
[25] Cho C,Logan JL,Lien YH. Massive aquaresis after tolvaptan administration and albumin infusion in a patient with alcoholic cirrhosis. Am J Med,2012,125(1):e5-6.
[26]Salerno F,Merli M,Riggio O,et al.Randomized controlled study of TIPS versus paracentesis plus albumin in cirrhosis with severe ascites.Hepatology,2004,40:629-635.
[27] Wong F,Watson H,Gerbes A,et al. Satavaptan for the management of ascites in cirrhosis:efficacy and safety across the spectrum of ascites severity. Gut,2012,6(1):108-116.
(收稿:2014-05-08)
(校对:陈从新)
Efficacy and safety of tolvaptan in the treatment of patients with refractory ascites
Zheng Junfu,Zhang Xin,Zhao Wenmin,et al. Department of Gastroenterology and Hepatology,Youan Hospital,Capital Medical University,Beijing 100069,China
ObjectiveTo observe the efficacy and safety of highly selective vasopressin V2 receptor antagonist tolvaptan in the treatment of patients with refractory ascites.MethodsThirty-nine patients with endstage liver diseases and refractory ascites(20 patients with cirrhosis and 19 patients with hepatocellular carcinoma)were enrolled in this study.In additional to conventional diuretics(furosemide 80 mg/d and spironolactone 160 mg/ d)and albumin therapy,the patients received tolvaptan orally at dose of 15 mg/d for 5 to 14 days.The urine amount,ascites,lower extremity edema,serum sodium and liver function tests were observed.Results The average urine amount per day after tolvaptan treatment was[(3533.3±154.65)ml/d],significantly higher than the baseline [(1851.3±167.12)ml/d,P<0.01];Ascites was improved in 82.5%(32/39)of all patients,and in 84.2%of cirrhotic patients with hepatocellular carcinoma,but only in 77.8%of cirrhotic patients with hepatorenal syndrome;Two patients with hepatorenal syndrome type I were not responsive to tolvaptan treatment;The serum sodium levels increased to[(132.9±4.1)mmol/l]after treatment,significantly higher than in pre-treatment[(128.1±4.25)mmol/ L,P<0.01]in 21 patients with hyponatremia;MELD scores and serum potassium before treatment were(37.5±5.6)and(4.1±0.5)mmol/L,respectively,which were not improved after tolvaptan treatment[(38.1±5.7)and(4.2±0.6)mmol/L,respectively];Dry mouth and thirst were the main adverse effects in the patients receiving tolvaptan and the occurrence rate was 15.4%.ConclusionsTolvaptan is effective in correcting hyponatremia in patients with end-stage liver diseases and refractory ascites,without adverse effect on liver functions as a short-term application.
Refractory ascites;End-stage liver diseases;Tolvaptan;Hyponatremia
北京市卫生系统高层次卫生技术人才培养计划项目(编号:2013-3-072)
100069北京市首都医科大学附属北京佑安医院消化中心
郑俊福,男,35岁,硕士研究生,主治医师。主要从事传染病及肝病研究。E-mail:zhengjunfu1979@foxmail.com
丁惠国,E-mail:dinghuiguo@medmail.com.cn
Tel:010 83997155,Fax:010-63295525
10.3969/j.issn.1672-5069.2014.06.016

