孕期双酚A暴露对雄性子代大鼠生殖损伤的研究
靳冠通,李 健,陈耀星,王 曈
(1.河南科技大学动物科技学院,河南 洛阳471003;2.中国农业大学动物医学院,北京 海淀100193)
各种促凋亡信号(如环境不利因素、损伤、辐射、化疗药物、兴奋性氨基酸、死亡配体等)都引起细胞内源性或外源性活性氧(ROS)升高或氧化还原平衡改变,这可能作为信号触发凋亡信号转导途径。当凋亡启动后,ROS进一步升高可能加速凋亡过程[1]。目前发现细胞凋亡存在3条途径:线粒体通路、内质网通路和死亡受体通路均与ROS密切相关。研究证实,一些植物提取物和环境激素引发的生殖损害多与氧化应激有关[2-3]。精液中脂质过氧化物含量与精子运动力呈反比,同时精子顶体对活性氧(ROS)非常敏感,因此机体过氧化水平与雄性生殖密切相关[4]。双酚A(BPA)是在1963年为防止流产而合成的雌激素样化合物,但以后逐渐用于工业生产聚碳酸酯塑料、环氧树脂及阻燃剂等。由于BPA普遍存在于自然环境中,使人们时刻都暴露其中,对健康造成多种负面影响,尤其显著的是对生殖系统的损伤。本试验将揭示孕期双酚A暴露对雄性子代大鼠生殖功能的影响及途径,为防治雄性生殖疾病研究提供新思路和理论依据。
1 材料与方法
1.1 动物处理 妊娠0 d的雌性SD大鼠分别灌胃50μL含0、1、10mg/kg体重双酚A的橄榄油(n=5),每天1次,连续2周。分娩的雄性子代大鼠生长至8周龄,麻醉、处死,取睾丸、副睾、精囊腺及前列腺称重,制作切片。取附睾尾检测精子指标。睾丸匀浆后待测抗氧化指标。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(TAOC)、丙二醛(MDA)及一氧化氮(NO)测定试剂盒,购自安迪(北京)生物科技有限公司。
1.2 样本处理与检测-精子数量、活率、顶体完整及畸形率 稀释附睾尾精液,用血球计数器计数精子密度。精子抹片行Giemsa染色,观察畸形情况。精子数量以×106/mL表示,精子存活率、畸形率、顶体完整率分别以百分数(%)表示。
1.3 数据统计 以上数据用SPSS12软件包进行单因素方差分析(OneWay ANOVA),以平均值±标准差(Mean±SD)表示,P<0.01为差异极显著,P<0.05为差异显著。
2 结果
2.1 双酚A暴露对子代大鼠睾丸、副睾、精囊腺及前列腺的影响 如表1所示,对照组睾丸、附睾、精囊腺及前列腺的重量分别为3.12、1.09、1.31 g及0.83 g,10mg双酚A组睾丸、附睾、精囊腺、前列腺的重量分别下降52.88%、40.37%、40.46%、36.14%,差异极显著(P<0.01);1mg组变化不明显(P>0.05)。
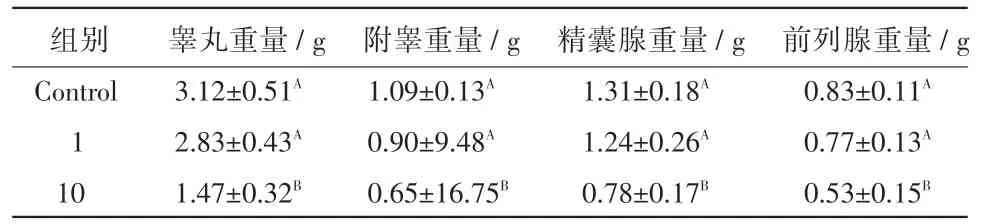
表1 双酚A暴露对子代大鼠睾丸、附睾、精囊腺及前列腺重量的影响
2.2 双酚A暴露对子代大鼠睾丸组织结的影响正常大鼠睾丸曲精小管排列整齐,结构清晰;间质组织充实。管壁中生精细胞轮廓清楚,层次分明;管腔内多充满长形精子细胞和发育成熟的精子。双酚A 10mg组曲精小管的管壁变薄,曲精小管内细胞排列紊乱,细胞分层减少,细胞间隙增大,管腔内有大量异常脱落的精母细胞和精子细胞,少见长形精子细胞和精子。
2.3 双酚A暴露对子代大鼠睾丸抗氧化能力的影响

图1 双酚A暴露对子代大鼠组织结构的影响
对照组SOD、GSH-Px、T-AOC的活性为156.73U/mL、31.53U/L、8.5U/mL,MDA、NO含量为3.04 nmol/mL、7.94μmol/L。10mg/kg体重双酚A组SOD、GSH-Px、T-AOC的活性为82.15U/mL、18.31U/L、4.46 U/mL,极显著下降(P<0.01);MDA、NO含量为5.24 nmol/mL、13.63μmol/L,极显著升高(P<0.01)。低剂量组变化不明显(P>0.05)。
3 讨论
大量研究证实,环境雌激素可造成很多雄性生殖系统疾病,胚胎期、出生前后或成年动物接触己烯雌(DES)均可导致雄性生殖损害[5],研究主要集中在自然流产、早产、死产、先天畸形、婴儿出生低体重发生率等,近年来由于雄性中介而导致雌性不良生育后果的研究日益增多[6]。张浩等对孕鼠第7~20天采用不同剂量壬基酚(NP)染毒,100、200ms/kg体重剂量组妊娠20 d和产后2 d的雄性子代睾丸PCNA表达显著低于对照组,而且,产后2 d雄性子代附睾PCNA和睾丸芳香化酶表达也显著低于对照组。间质细胞增殖能力下降将加剧类固醇激素合成分泌不足,并将影响到性成熟后的睾丸功能[7]。Fielden利用DES处理妊娠小鼠,高剂量组雌鼠生育指数、仔数出生数量、雄性比例均显著下降[8]。本试验结果显示,应用炔雌醚连续3周处理雄性小鼠导致睾丸、附睾、精囊腺和前列腺萎缩,重量均显著降低;配合睾丸组织结构,抑制器官发育及睾丸精子发生。氧化应激是组织损伤的途径之一[9],本研究发现双酚A降低抗氧化酶活性、升高脂质过氧化物丙二醛和活性氧一氧化氮含量,破坏抗氧化能力;最终造成精子品质下降。结果表明,孕期10mg/kg体重双酚A暴露致子代雄性大鼠生殖功能异常,其深层机制有待进一步研究。

表2 双酚A暴露对子代大鼠睾丸抗氧化能力的影响
[1]Junghans A,Sies H,Stahl W.Carotenoid-containing unilamellar liposomes loaded with glutat bione:amodel to study hydrophobichydrophilic antioxidant interaction[J].Free Radic Res,2001,33:801-808.
[2] 李健,司丽芳,位志国,等.辛基酚对成年雄性小鼠血浆与脾抗氧化功能的影响[J].动物医学进展,2012,33(3):29-32.
[3]Jian LI,HongweiWANG,Jiliang ZHANG,et al.Abnormal secre⁃tion of reproductive hormones and antioxidant status involved in quinestrol induced reproductive toxicity in adultmale rat[J].Tis⁃sue and Cell,2014,46(1):27-32.
[4]Williams A C,Ford W C L.Relationship between reactive oxygen species production and lipid peroxidation in human sperm suspen⁃sions and their association with sperm function[J].Fertil Steril,2005,83:929-936.
[5]Atanassova N,Mckinnell C,Walker M,etal.Permanenteffects of neonatal estrogen exposure in rats on reproductive hormone levels,sertoli cell number and the efficiency of spermatogenesis in adult⁃hood[J].Endocrinol,1999,140:5364-5373.
[6]林本成,袭著革.环境化学物对雄(男)性生殖损伤的评价指标及检测技术[J].生态毒理学,2007,2:381-389.
[7]张浩,詹立,吴德生.壬基酚对围产期子代雄性SD大鼠性腺组织PCNA和Aromatase表达的影响[J].四川大学学报,2006,37:23-26.
[8]Fielden M R,Halgren RG,Tashiro CH M,etal.Effects of gesta⁃tional and lactational exposure to Aroclor 1242 on sperm quality and in vitro fertility in early adult and middle-aged mice[J].Re⁃prod Toxicol,2001,15:281-292.
[9]刘克祥,管延杰,赵树臣,等.亚急性硒中毒对雄性小鼠睾丸能量代谢及抗氧化能力的影响[J].中国兽医杂志,2013,49(6):20-22.

