丁香叶水提物对猪链球菌体外生物被膜的作用
黄全勇,韩 强,陈俭清,赵玉林,闫清波,盛尊来,周永辉,李艳华
(东北农业大学动物医学学院,黑龙江 哈尔滨150030)
猪链球菌(S.suis)是一种重要的人畜共患病病原体,可感染猪导致脑膜炎、肺炎、关节炎、败血症等,其致病力强、病死率高,是引起猪呼吸道疾病和无名高热病的病原菌之一。近年来由于广谱抗生素的广泛应用,S.suis对抗生素的敏感性下降,致使S.suis感染率呈逐年上升趋势[1]。S.suis的耐药包括多个方面,而其能形成生物被膜(Biofilm,BF)是导致其耐药的原因之一[2],BF是细菌产生的多聚复合物基质将自身包绕,粘附于无活性物体或活体表面,形成的有一定结构的细菌群体;它可以抵抗宿主免疫力和抗生素抑菌杀菌作用,生物被膜内细菌容易对抗生素产生广泛的耐药性,造成感染难以治愈,反复发作[3]。国内学者证明,猪链球菌在体外可以形成生物被膜[4-5]。目前国内外
研究结果表明,14、15元环大环内酯类药物具有干预或者消除S.suis生物被膜的作用[3],但中药对S.suis生物被膜的干预或者消除作用鲜见报道。丁香叶具有清热解毒、抗菌、抗炎等作用[6],丁香叶的抗菌作用是否与其具有干预或者消除生物被膜的作用有关,值得探讨。本研究通过在体外建立S.suis生物被膜模型,观察了丁香叶水提物对S.suis生物被膜的作用,为其治疗S.suis生物被膜相关感染提供科学依据。
1 材料与方法
1.1 实验材料 S.suis(分离株)由中国农业科学院哈尔滨兽医研究所提供;丁香叶(东北农业大学院内自己采摘经鉴定为丁香叶);阿奇霉素(国药试剂公司);THB培养基(青岛高科园海博生物技术有限公司);琼脂;试剂:pH值7.4磷酸盐缓冲溶液、结晶紫、甲醇、冰乙酸、犊牛血清、FeCl3。材料:卡尔加里生物膜装置、96孔细胞培养板、0.22 μm滤膜。检测仪器:酶标仪(SN239591,美国Ep⁃och);扫描电镜(S-3400N,日本)。
1.2 试验方法
1.2.1 筛选试验菌株 参照周永辉[9]文献方法对菌株进行分离鉴定,首先将猪链球菌菌株于无菌条件下在THB琼脂平板上传代II代进行纯化分离,然后从THB琼脂平板上挑取单个菌落,接种于无菌THB液体试管中,37℃恒温培养箱中培养18 h后,比浊法将菌液浓度先调整为0.5麦氏管悬液(1.0×108CFU/mL),再用THB液体培养基稀释,使菌液浓度约为1×106CFU/mL。每孔200μL菌液加到卡尔加里装置底部板内,只含THB液体培养基的孔为对照组,37℃,45 r/min摇床上培养。参照Stepanovic[9]的方法测定生物被膜的形成能力。筛选出形成生物被膜能力强的菌株。
1.2.2 丁香叶水提物的制备 量取丁香叶50.002 g,粉碎后加蒸馏水500mL,温室浸泡过夜,煎煮1.5 h,倒出药液,纱布过滤,再加入蒸馏水300mL煎煮1 h,倒出药液同样过滤,合并药液并浓缩,滤液经冻干机冻干。精密称量冻干粉末1.0005 g,用4mL去离子水溶解,离心取上清液,用0.22μm滤膜过滤,保存在4℃备用。
1.2.3 丁香叶水提物、阿奇霉素对S.suis的最小抑菌浓度(MIC)的测定 试验操作及结果按照美国临床实验室国家标准委员会(NCCLS)推荐的标准微量稀释法进行判定[10]。
1.2.4 1/2MIC对S.suis生物被膜的干预作用 将浊度为0.5麦氏单位的菌液稀释到1.0×106CFU/mL,向卡尔加里生物被膜装置每孔中加菌液和丁香叶水提物共200μL(浓度1/2MIC),另设空白对照孔(只加培养基)、阴性对照孔(未加药的生物被膜生长对照)和阳性对照孔(浓度1/2MIC的阿奇霉素),每个样品5个重复。37℃,50 r/min摇床上孵育72 h,PBS清洗2次,固定,染色,测OD595值。
1.2.5 1/2MIC对S.suis生物被膜的消除作用 将浊度为0.5麦氏单位的菌液稀释到1.0×106CFU/mL,取200μL接种于96孔板中,37℃,50 r/min摇床上孵育72 h,PBS清洗2次,向卡尔加里生物膜装置每孔中加THB培养基和药液共200μL(1/2MIC),继续于37℃,50 r/min摇床上孵育72 h,PBS清洗3次,固定,染色,测OD595值。另设空白对照孔(只加培养基)、阴性对照孔(未加药的生物被膜生长对照)和阳性对照孔(1/2MIC的阿奇霉素)。
1.2.6 丁香叶水提物对S.suis生物被膜作用的形态学观察 首先从卡尔加里生物被膜装置上取下形成生物被膜的桩钉,并使用灭菌PBS(pH值7.2)轻轻洗涤三次以去除游离菌,用pH值7.2戊二醛固定,并置于4℃冰箱中固定1 h。依次用pH值7.2 PBS冲洗两次,每次均为0.17 h,再用50%、70%、90%进行脱水各一次,每次0.17 h,然后用100%乙醇脱水二次,每次0.17 h,最后100%乙醇与叔丁醇1∶1,纯叔丁醇各脱水一次后,每次0.25 h,用冷冻干燥仪对样品进行干燥4 h。样品表面在真空条件下镀一层厚100A的金属膜,SEM下观察。
1.2.7 统计学处理 采用SPSS 18.0软件对相关数据进行统计分析,结果用均值±标准差表示,统计资料的比较采用单因素方差分析,P<0.05有统计学意义。
2 结果与分析
2.1 丁香叶水提物对S.suis的最低抑菌浓度(MIC)试验结果 通过微量稀释法分别测定了阿奇霉素和丁香叶水提物对S.suis的最低抑菌浓度(MIC),MIC值为0.0078μg/mL和1562.5μg/mL。结果表明,猪链球菌对阿奇霉素比丁香叶水提物敏感,但两者均能抑制猪链球菌的生长。
2.2 1/2MIC丁香叶水提物对S.suis生物被膜的干预作用 用1/2MIC丁香叶水提物、1/2MIC阿奇霉素(阳性对照)分别和猪链球菌菌液共同培养72 h后染色,测OD595值,试验结果见图1,丁香叶水提物组OD595值(0.238±0.008)明显低于阴性对照组OD595值(0.525±0.014)但高于阳性对照组OD595值(0.205±0.004)差异极显著(P<0.01)。表明在1/2MIC时,丁香叶水提物对猪链球菌生物被膜形成抑制作用。
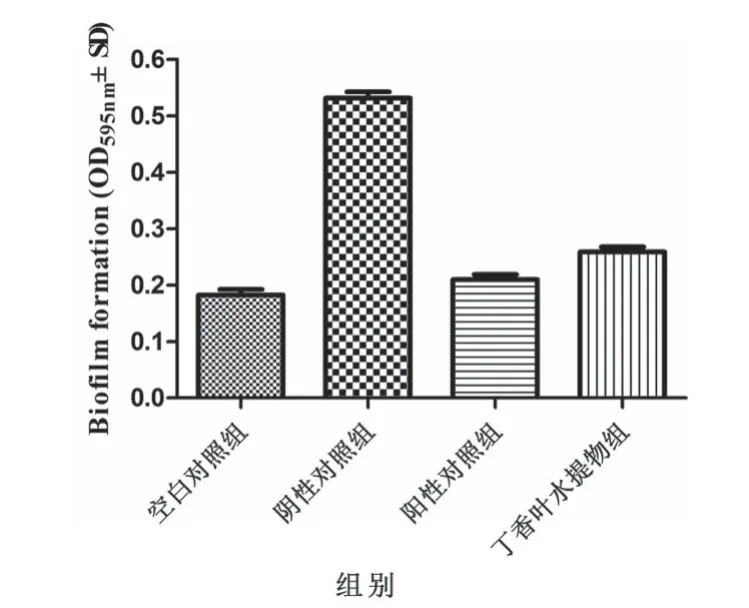
图1 对猪链球菌生物被膜干预的作用(n=5,±SD)
2.3 1/2MIC丁香叶水提物对S.suis生物被膜的消除作用 猪链球菌生物被膜在72 h成熟后,用1/2MIC浓度的丁香叶水提物、阿奇霉素(阳性对照)对其生物被膜消除,试验结果见图2,丁香叶水提物组OD595值(0.270±0.006)明显低于阴性对照组OD595值(0.531±0.016)但高于阳性对照组OD595值(0.222±0.042)差异极显著(P<0.01)。表明在1/2MIC时,丁香叶水提物对猪链球菌成熟生物被膜有消除作用。

图2 对猪链球菌生物被膜的消除作用 (n=5,±SD)
2.4 1/2 MIC丁香叶水提物对S.suis生物被膜作用的形态学观察 通过扫描电镜观察了丁香叶水提物在干预和消除生物被膜后的形态学,结果见图3。阴性对照组细菌镶嵌于生物被膜中,细菌周围有厚厚的黏液层,而丁香叶组及阳性对照细菌清晰可见,菌数减少,未见有黏液组成,表明丁香叶水提物有抑制生物被膜形成和对成熟生物被膜有消除的作用。
3 讨论
丁香叶具有抗菌消炎、清肝利胆之功效,主要应用于治疗急性痢疾、乙型肝炎、黄疸型肝炎、结膜炎等疾病。现代药理研究证明,丁香叶具有清热解毒、抗菌、抗炎、抗病毒、抗氧化、祛痰镇咳等功效[6]。但丁香叶对细菌生物被膜作用方面的研究尚无报道。

图3 药物对S.suis生物被膜作用的形态学观察
细菌生物被膜是由于单一或多种类细菌为了适应周围环境,吸附于异物或组织表面,繁殖并分泌大量多糖基质、纤维蛋白、脂蛋白等多糖蛋白复合物,使得细菌相互粘连、聚集、形成具有三维立体结构的膜样结构,是细菌微菌落聚集体。生物被膜的形成包括初始粘附阶段、表面微菌落的形成、分化成熟3个过程。生物被膜一旦形成,膜内细菌比浮游细菌耐药性增加100~1 000倍以上。生物被膜阻止和抑制巨噬细胞、白细胞、抗体及抗生素侵入生物被膜中杀灭细菌,导致感染反复发生,难以控制[10]。
此前有报道,阿奇霉素对猪链球菌生物被膜的形成具有较好的抑制作用[11]。故本试验采用阿奇霉素做为阳性对照,证实试验方法正确可行。本试验采用1/2MIC浓度对猪链球菌生物被膜进行干预与消除,结果显示,丁香叶水提物在1/2 MIC浓度对猪链球菌生物被膜有明显的干预与消除作用,扫描电镜下观察也表明丁香叶水提物在亚MIC浓度对猪链球菌生物被膜有明显的干预与消除作用。以上研究表明,丁香叶可以抑制猪链球菌的粘附,抑制猪链球菌生物被膜的形成和对成熟的生物被膜有消除作用。有关药理作用的研究表明,丁香叶生物活性较高,抗菌谱广,作用效果持久。由于它克服了抗生素毒副作用较大、易使微生物产生耐药性的弊端又具有抗菌和抗病毒的持久性,资源丰富,使用安全,所以在临床应用的前景乐观;尤其是通过本试验研究也证实,丁香叶等中药在临床治疗猪链球菌生物被膜相关感染性疾病方面,具有一定的应用价值。
[1] 闫清波,赵志惠,苑青艳,等.常用抗生素对东北地区猪源链球菌的体外抗菌活性研究[J].中国预防兽医学报,2007,29(12):977-979.
[2]Clifton-Hadley F A.Streptococcus suis type 2 infections[J].Br Vet J,1983,139(1):1-5.
[3]Grenier D,Grignon L,Gottschalk M.Characterisation of biofilm formation by a Streptococcus suismeningitis isolate[J].The Veteri⁃nary Journal,2009,179(2):292-295.
[4]汪洋.猪链球菌生物被膜形成机理与研究[D].南京:南京农业大学,2011.
[5]魏子贡.猪链球菌流行病学及其生物被膜形成机理研究[D].武汉:华中农业大学,2010.
[6]刘静.大环内酯类及β-内酰胺类药物对猪链球菌生物被膜的体外作用研究[D].哈尔滨:东北农业大学,2012.
[7] 李永吉,吕邵娃,王艳宏,等.朝鲜丁香叶药用研究进展[J].中医药信息,2003,20(1):22.
[8]周永辉,韩强,赵玉林,等.猪链球菌2型体外生物被膜培养条件的筛选[J].中国科技论文在线,2013.
[9]National Committee for Clinical Laboratory Standards Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically:approved standard M7-A5.Wayne,Pa:2000.
[10]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiterplate test for quantification of staphylococcal biofilm formation[J].J MicrobiolMethods,2000,40(2):175-179.
[11]屈常林,高洪,赵宝洪,等.细菌生物被膜与抗生素耐药机制研究进展[J].动物医学进展,2008,29(3):86-90.
[12]Zhao-Rong Lun,Qiao-PingWang,Xiao-Guang Chen,et al.Strep⁃tococcus suis:an emerging zoonotic pathogen[J].The Lancet Infec⁃tious Diseases,2007.7(3):201-209.

