几种中药单体促进阿霉素内化协同诱导白血病细胞凋亡
王长文,张秀荣,李 妍
(1.吉林医药学院公共卫生学院,吉林吉林132013;2.吉林医药学院药学院,吉林吉林132013;3.吉林医药学院检验学院,吉林 吉林132013)
阿霉素(Adriamycin,ADR)临床上用于白血病、淋巴瘤、乳腺癌和肝癌等肿瘤的治疗,是目前最常用的抗肿瘤药物之一。除具有骨髓抑制和胃肠道反应等毒性外,长期应用ADR还导致剂量依赖性心脏毒性效应,使其临床应用受限[1]。化疗药物与中药合理搭配可实现减毒增效、扶正怯邪和增强机体免疫力效应。近年来,筛选中药组方或单体成分,与化疗药物组合而建立减毒化疗方案研究受到重视。ADR属蒽环类抗肿瘤药,是P-gp等耐药分子的底物,被P-gp转运到细胞外,从而导致耐药[2]。ADR具有剂量依赖的心脏毒性,而通过促进ADR内化可减少ADR在非耐药的肿瘤治疗时药物的用量,减少其心脏毒性副作用的发生。本试验在已建立细胞内ADR含量检测方法的基础上,筛选可促进ADR内化,增强ADR抗肿瘤效应的中药单体。
1 材料与方法
1.1 材料 白血病细胞株HL60,购自美国典型生物收藏中心(Am erican type culture co llection,ATCC);RPM I-1640培养液,购自GIBICO公司;小牛血清,购自黄岩四季青生物试剂有限公司。阿霉素(Adriamycin,ADR)为Farmitalia Carlo Eeba公司产品。去甲斑蝥素(norcantharidin,NCTD),购自大连市医药科学研究所;β-榄香烯(β-elemene),购自大连金港制药厂;姜黄素(curcumin),购自国家标准物质中心;WST-1细胞增殖检测试,剂盒购自江苏碧云天生物技术公司。Annexin-V和PI双染凋亡检测试剂盒,购自eBioscinedce公司(美国);活化Cas⁃pase-3抗体、β-actin抗体、HRP标记的羊抗鼠、羊抗兔二抗,购自北京中杉金桥生物技术有限公司。
1.2 细胞培养和药物干预 HL60为悬浮生长细胞,采用含10%小牛血清1 640培养液,在37℃、5%CO2和饱和湿度下培养。将细胞用培养液调为3×105/mL,按3mL/孔接种于6孔板。加入不同浓度ADR(0、2.5、5和10μmol/L)和NCTD(0和7.5μmol/L),作用4 h后收集细胞,采用流式细胞术分析细胞内ADR的相对含量。为分析ADR和NCTD联合后,是否可协同抗肿瘤,取ADR和NCTD处理16 h后的细胞,分析细胞凋亡和活化Caspase-3表达。细胞接种于96孔板,加入不同浓度ADR(0、2.5、5μmol/L和10μmol/L)和NCTD(0和7.5μmol/L),处理72 h后,分析细胞增殖抑制率(in⁃hibition rate,IR)。采用不同浓度ADR和β-榄香烯(10 μmol/L)或姜黄素(15μmol/L)处理HL60细胞,相同的方法分析细胞内ADR相对含量、细胞凋亡、活化Caspase-3表达和IR。
1.3细胞内ADR的相对含量分析 本研究利用ADR发射的红色荧光,分析细胞ADR的相对含量[3]。
1.4 细胞凋亡 将细胞用PBS洗涤2次,用结合缓冲液调为2×106/mL的细胞悬液。取190μL细胞悬液,加入10μL FITC-标记Annexin-V,室温下避光反应15min;离心弃上清,加入结合缓冲液500μL,再次洗涤后,475μL结合缓冲液重悬细胞,接入PI溶液25μL,混匀后立即用流式细胞仪分析。
1.5 活化Caspase-3表达 收集细胞,参照文献[4]方法提取细胞总蛋白,变性的聚丙烯酰胺凝胶电泳分离蛋白,经转印电泳将蛋白转于PVDF膜[4]。室温下用含5%脱脂奶粉的TBS封闭膜小2 h,将膜与稀释的一抗(β-actin和活化Caspase-3抗体)在4℃条件下反应过夜。次日,室温下用0.5%Twee-20/TBS洗3次后,加入二抗并孵育2 h,再用0.5%Tween-20的TBS洗膜3次,ECL化学发光试剂盒检测特异条带。
1.6 细胞增殖抑制率分析 药物处理细胞72 h,在空白对照组内按每孔10μL加入PB溶液,试验组加入10μL的WST-1,继续培养2 h,酶联检测仪检测450 nm的吸光度值(A450)。按下列公式计算IR,并以3次独立生物学试验的平均值表示最终试验结果。
IR=[1-(A 450T-A 450B)/(A 450C-A 450B)]×100%
2结果
2.1 3种中药单体对白血病细胞内化阿霉素的影响 ADR(0、2.5、5μmol/L和10μmol/L)和NCTD(0和7.5μmol/L)处理4 h后,细胞内红色荧光强度代表ADR的相对含量(图1)。3种中药单体对细胞内化ADR的影响见表1。结果显示,3种中药单体中,NCTD和姜黄素可促进白血病细胞内化ADR。
2.2 中药单体和阿霉素对白血病细胞凋亡的影响
ADR(0、2.5、5μmol/L和10μmol/L)和NCTD(0和7.5μmol/L)处理16 h,流式细胞术分析细胞凋亡,图中1、2和3象限内细胞分别代表坏死细胞、晚期凋亡细胞、早期凋亡细胞和活细胞(图2)。将象限2和3内细胞的百分率合计为凋亡细胞,则3种中药单体对HL60细胞凋亡的影响见表2。ADR单独作用组比较,3种中药单体均可增强ADR诱导白血病细胞凋亡。

图1 ADR和NCTD对白血病细胞内化ADR的影响

表1 3种中药单体对白血病细胞内化ADR的影响
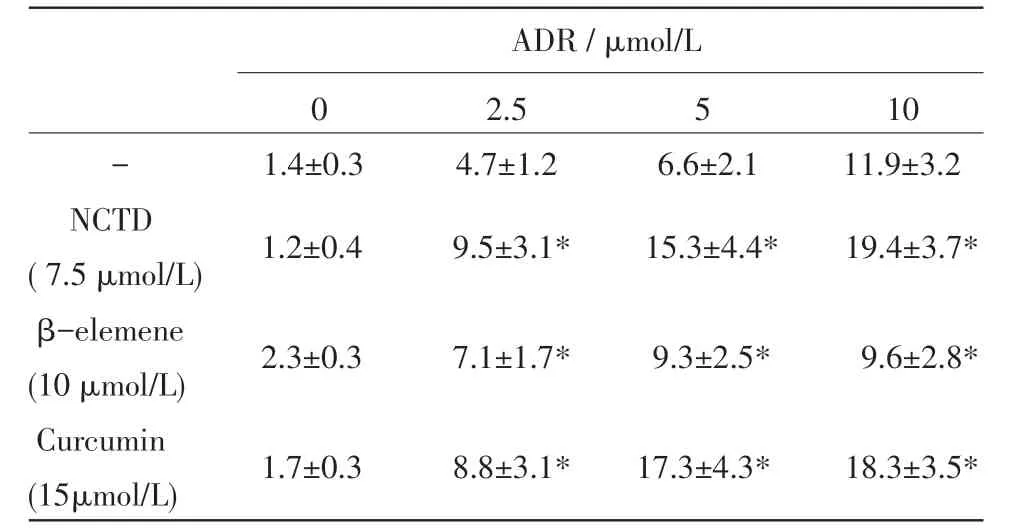
表2 3种中药单体对白血病细胞凋亡的影响(凋亡细胞百分率%)

图2 ADR和NCTD对白血病细胞凋亡的影响
2.3 中药单体和阿霉素对白血病细胞增殖的影响
ADR(0、2.5、μmol/L5和10μmol/L)与NCTD(7.5 μmol/L)、β-榄香烯(10μmol/L)或姜黄素(15μmol/L)处理HL60细胞72 h,对细胞增殖的抑制率见表3.与ADR单独作用组比较,3种中药单体均可增强ADR对白血病细胞的抑制作用,其中NCTD和姜黄素的增敏作用较强。

表3 3种中药单体对ADR抑制白血病细胞增殖的影响 (IR%)
2.4 中药单体和阿霉素对白血病细胞活化Cas⁃pase-3的影响 ADR(0和2.5μmol/L)与NCTD(7.5 μmol/L)、β-榄香烯(10μmol/L)或姜黄素(15μmol/L)处理HL60细胞16 h,活化Caspase-3的表见图3。与ADR单独作用比较,NCTD和姜黄素与ADR联合对活化Caspase-3的表达有增强作用。

图3 中药单体和阿霉素对白血病细胞Caspase-3表达的影响
3 讨论
ADR属于蒽环类抗生素,是一种高效的广谱抗抗生素,是临床上广泛应用的抗肿瘤药物。心脏毒性是ADR临床应用的主要不良反应之一,表现为剂量依赖的不可逆转的心肌病、充血性心力衰竭等,限制了其临床应用[3-4]。ADR的心脏毒性机制尚未完全清楚,可能与自由基增加、线粒体损伤、钙超载和细胞凋亡等多因素共同参与关系密切。其中,依浓度增加而自由基水平和线粒体损伤,进而导致心肌细胞和血管内皮细胞凋亡是毒性产生的早起事件和关键环节[4-5]。ADR与心肌组织的亲和力高于其他组织,进入心肌细胞后,在代谢过程中产生的自由基引起线粒体膜和内脂网的脂质过氧化。防护ADR毒性的策略包括建立联合方案降低其用量、抗氧化制剂和自由基清除、抑制细胞凋亡和钙离子稳定剂等。回顾性研究表明,当ADR积累量达550mg/m2时,充血性心力衰竭的发生率>26%,降低ADR的用量对降低毒性作用具有重要意义[5]。
ADR的分子量543.52,属于大环内酯类药物,若肿瘤原发为P-gp高表达,或化疗药物诱导其表达增加,则加速阿霉素等大环内酯类药物被“药泵”运出细胞的效率,导致药物内化入细胞的ADR量减少。近年来,有学者提出,自中药有效成分中筛选促进药物内化入细胞的制剂,与ADR联合以减少ADR用量,达到降低毒性作用的目标[6]。本研究采用流式细胞术分析细胞内ADR的相对含量,分析3种中药单体(去甲斑蝥素、β-榄香烯和姜黄素与ADR联合作用后,白血病细胞内ADR含量的变化。结果表明,去甲斑蝥素和姜黄素可通过促进ADR内化。进一步分析发现,两者还可促ADR诱导活化Caspase-3表达、细胞凋亡;联合后对癌细胞增殖的效应也增强。研究结果提示,去甲斑蝥素或姜黄素与ADR联合,可获得相同的抗肿瘤效应,但减少ADR的用量。我国中药资源丰富,从中选择可降低化疗药物毒副作用的制剂,具有重要意义。恶性肿瘤的治疗常需要在杀伤癌细胞的同时,尽量减少毒副作用,保持机体的免疫力。去甲斑蝥素和姜黄素单独应用具有一定的抗肿瘤作用,而毒副作用小[7-8]。
本研究结果表明,NCTD和姜黄素与ADR联合,具有减少ADR剂量的潜在价值。但在体内环境下,NCTD和姜黄素是否还可通过该机制与ADR协同抗肿瘤还需要进一步研究。
[1] 王睿,徐长庆.阿霉素心脏毒性作用机制研究进展[J].齐齐哈尔医学院学报,2006,27(10):1221-1222.
[2]任非,姜耀东,李国峰.纳米载体药物逆转P-gp介导的肿瘤多药耐药研究进展[J].医药导报,2009,28(5):614-616.
[3] Fu J,Yamamoto K,Guan ZW,etal.Human neuronalnitric oxide synthase can catalyze one electron reduction of adriamycin:role of flavin domain[J].Arch Biochem Biophys,2004,427(2):180.
[4]郑东诞,王秀玉,杨春涛,等.氧化应激通过抑制胱硫醚-γ-裂解酶介导阿霉素的心肌毒性[J].中国动脉硬化杂志,2011,19(12):969-973.
[5] 李世红,王绍军.阿霉素心脏毒性发病机制新近展[J].临床心血管病杂志,2005,21(4):249-253.
[6] 张芳,徐春蕾,邱郑.中药逆转肿瘤细胞多药耐药研究进展[J].中国实验方剂学杂志,2013,19(24):342-348.
[7] 沃兴德,洪行球,高承贤,等.姜黄素长期毒性试验[J].浙江中医学院学报,2000,24(1):61-65.
[8]于婷,刘东武,陈志伟.斑蝥素及其衍生物的作用机制及临床应用[J].生命科学仪器,2009,1:15-18.

