褪黑素减轻蛛网膜下腔出血后的早期脑损伤
林 达,陈敬寅,李建儒,陈 高
颅内动脉瘤破裂所致的蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的发生率大约为1/10,000,具有高死亡率和高致残率的特点[1]。最新的研究表明,蛛网膜下腔出血后的早期脑损伤(early brain injury,EBI)可能是导致蛛网膜下腔出血患者死亡率高的因素之一。其可能的机制包括脑血流量的降低、血脑屏障(blood-brain barrier,BBB)的破坏以及脑水肿[2]。
同时目前的研究也表明神经元细胞的凋亡也是早期脑损伤的一个重要因素并且是决定该疾病短期以及长期预后,特别是认知功能预后的一个重要因素[3,4]。因此,减轻蛛网膜下腔出血后的早期脑损伤可以有效地降低迟发的缺血性损伤的严重程度,改善蛛网膜下腔出血患者的神经预后。褪黑素(N-乙酰-5-氧基色胺)由松果体分泌,具有强烈的抗氧化作用,其可能的作用机制为褪黑素及其代谢物可以清除氧自由基,激活抗氧化酶,促进谷胱甘肽的合成,促进其他抗氧化剂的活化,并且可以保护抗氧化酶,所以是非常有效的抗氧化剂[5~8]。而且褪黑素能够透过血脑屏障,即使大剂量应用也并未监测到毒性损伤[9,10]。尽管如此,褪黑素对蛛网膜下腔出血后早期脑损伤的作用仍没有明确。
本研究拟观察褪黑素是否能通过抑制细胞凋亡和稳定血脑屏障来减轻蛛网膜下腔出血后早期脑损伤和神经功能的改善。
1 实验材料与方法
1.1 实验动物和分组 体重300~330 g 的SD成年雄性大鼠购自Slac 动物实验有限公司(中国上海)。大鼠随机分为3 组,即假手术组(假手术+溶剂)、SAH 组(SAH+溶剂)、SAH+MEL 组(SAH+褪黑素)。这项研究所有的终点都设定在蛛网膜下腔出血模型建立后24 h。所有实验的内容均得到了浙江大学实验动物伦理委员会的批准。
1.2 大鼠蛛网膜下腔出血模型 我们依照文献[11]介绍的方法建立大鼠的蛛网膜下腔出血模型。通过腹腔内注射戊巴比妥(40 mg/kg)对大鼠实施麻醉,快速暴露左侧颈总动脉及其分支。从远端切断左侧颈外动脉,使由此产生的断端与颈内动脉成一直线。将一根钝头的4-0 单丝尼龙缝线通过颈外动脉断端伸入颈内动脉,超过颈内颈外动脉分叉处约18~20 mm,直到有阻力感。继续将单丝尼龙缝线推进约3 mm,即在靠近颈内动脉颅内分叉处刺穿颈内动脉。大约15 s 后退出单丝尼龙缝线。我们依据文献公布的分级量表[12]来评价大鼠蛛网膜下腔出血的严重程度,对6 段基底池蛛网膜下腔的血液量做分级。0 分,没有蛛网膜下腔出血;1 分,极少量蛛网膜下腔出血;2 分,中等量血并可见动脉;3分,血凝块覆盖了分段区域内的所有动脉。通过对6 个分段区域的分数相加可以得到该蛛网膜下腔出血模型的得分(0~18)。
1.3 药物治疗 褪黑素购自Sigma-Aldrich 公司(圣路易斯,密苏里州,美国)。把褪黑素(150 mg/kg)溶解于含1%乙醇的生理盐水溶剂中,在蛛网膜下腔出血2 h 后注射入SAH+MEL 组大鼠腹腔内。假手术组和SAH 组均在对应的相同时间点按体重注射等量的溶剂。
1.4 死亡率和神经功能障碍的评估 在蛛网膜下腔出血模型建立后24 h,进行死亡率和神经功能障碍评估。神经功能评分依据加西亚评分系统[13]。对大鼠的自发性活动、四肢活动的对称性、前脚外伸、爬行、躯干本体感觉以及对触须触碰的反应进行观察评定,每个测试计0~3 分或1~3 分,总分值范围从3~18 分。所有测试分值的评定都由对分组及治疗情况不知情的观察者来完成,同时对动物行为测试的顺序是随机的。较低的得分表明存在严重的神经功能缺损。在同样的时间点计算各组大鼠的死亡率。
1.5 脑含水量的测定 在蛛网膜下腔出血24 h后处死大鼠。立即取出脑组织并称重得到湿的重量,然后在105 ℃情况下烘干24 h 后称重得到干的重量。通过公式(湿的重量-干的重量)/湿的重量×100%计算得到脑组织的水含量[14]。
1.6 血脑屏障完整性的评价 在蛛网膜下腔出血模型建立后24 h,将2%伊文思蓝(5 mg/kg)经左侧股静脉注入大鼠体内,并循环1 h。在深度麻醉后,用磷酸盐缓冲盐水(phosphate-buffered saline,PBS)溶液经心室内灌注后取脑。将目标测定区域的脑组织称重后浸润在3 ml PBS 中制成匀浆,然后15000×g 下离心30 min。取0.7 ml 上液与等体积的三氯乙酸-乙醇(1∶3)混合液混合。经4 ℃下孵育过夜后,将样品于15000×g 下离心30 min,并作激发光波长620 nm、发射光波长680 nm 的分光荧光测定。
1.7 组织学和TUNEL 染色 大鼠处死后用0.1 mmol 磷酸盐缓冲溶液(pH 7.4)和4%多聚甲醛(pH 7.4)注入心脏。取脑放入相同的固定液,置于4 ℃环境中2 d。然后,将脑置于组织冷冻介质中冷冻,并切成7 μm 的切片。TUNEL 染色依据试剂生产厂家标明的方法进行,选取冠状位相同位置的皮层切片,在400 倍荧光显微镜(LSM-710,Zeiss)下观察拍照并测定相同大脑皮层区TUNEL 阳性(绿色)细胞数及细胞核(DAPI,蓝色)数,取TUNEL 阳性细胞数所占细胞核数百分数统计分析。
1.8 蛋白质印迹 将大鼠处死后用pH 7.4 的PBS 作心内灌注,取左侧基底皮质样品(面对血块)制成匀浆,在4 ℃下以1000×g 离心10 min。将所得上液进一步离心分离,使用CD 蛋白定量试剂(Bio-Rad)测定蛋白浓度。将等量的蛋白(60 μg)重悬于同样的缓冲液中,95 ℃变性5 min,加入十二烷基硫酸钠-聚丙烯酰胺凝胶作电泳分离。蛋白在80 V 电泳分离3 h 后,于100 V 经2 h,转移到聚偏二氟乙烯膜上。膜经脱脂牛奶封闭后,加入检测蛋白:一抗caspase-3(1∶1000,sc-22140,Santa Cruz Biotechnology)。膜经辣根过氧化物酶偶联的二抗于21 ℃下孵育1 h 后,使用X 光胶片检测蛋白条带,并作定量分析(NIH)。
2 结果
2.1 生理学评价 在手术过程中监测的动脉压、动脉血pH 值、p(O2)、p(CO2)、血糖水平间均没有统计学差异(P>0.05)(见表1)。
2.2 死亡率、神经功能障碍以及蛛网膜下腔出血分级 假手术组大鼠无死亡,SAH 组死亡率为12/35(33.3%);SAH+MEL 组死亡率为5/28(17.9%)。假手术组、SAH 组及SAH+MEL 组大鼠神经功能评分分别为17.8±0.4、10.9±0.7、12.3±1.2。SAH 组神经功能得分显著低于假手术组(10.9±0.7 vs 17.8±0.4,P<0.05)。SAH+MEL 组大鼠的神经功能缺损较SAH 组明显减轻(12.3±1.2 vs 10.9±0.7,P<0.05)。同时在取脑时发现蛛网膜下腔血凝块主要分布在同侧的Willis 环和脑干表面,假手术组、SAH 组和SAH+MEL组的蛛网膜下腔出血分级分数分别为(0±0)、(13.47±1.5)、(13.45±1.1)。SAH 组与SAH+MEL 组之间的蛛网膜下腔出血评分无显著性差异。
2.3 褪黑素对脑含水量的影响 蛛网膜下腔出血后24 h,假手术组大鼠的脑含水量为79.2%;SAH 组大鼠的脑含水量为80.0%;SAH+MEL 组大鼠的脑含水量为79.5%。与假手术组相比,SAH 组的脑含水量增加0.8%(79.2% vs 80.0%,P<0.05)。与SAH 组相比,SAH+MEL 组大鼠的脑含水量明显降低(79.5% vs 80.0%,P<0.05)。
2.4 褪黑素对血脑屏障的影响 伊文思蓝染料外渗是血脑屏障破坏的一项指标。蛛网膜下腔出血后24 h,与假手术组相比,SAH 组大鼠的目标测定区域脑组织伊文思蓝渗出明显增多(P<0.05)。与SAH 组相比,SAH+MEL 组大鼠目标测定区域脑组织伊文思蓝渗出明显减少(P<0.05)。
2.5 褪黑素对细胞凋亡的影响 在假手术组没有发现TUNEL 阳性细胞。蛛网膜下腔出血后24 h,SAH 组大鼠的基底部皮质可发现大量TUNEL阳性细胞。与SAH 组相比,褪黑素治疗可以明显减少基底部皮质中的TUNEL 阳性细胞(P<0.05)。
2.6 褪黑素对caspase-3 表达的影响 我们在大鼠左脑基底部皮质中检测caspase-3 的表达。褪黑素可以抑制蛛网膜下腔出血诱导的caspase-3 表达的升高。与SAH 组相比,SAH+MEL 组大鼠左脑基底部皮质中的caspase-3 表达水平明显降低(P<0.05)。
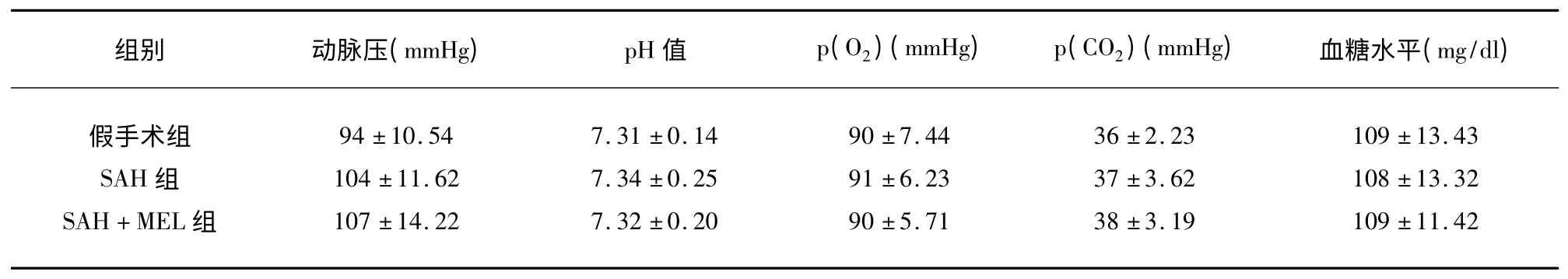
表1 不同组间生理状态比较
3 讨论
蛛网膜下腔出血早期脑损伤的机制非常复杂,涉及颅内压的升高、脑灌注压的降低、凋亡、坏死、自噬、血脑屏障障碍、氧化应激和炎症等[15]。近期的研究发现,很多药物在某一方面对蛛网膜下腔出血后早期脑损伤有保护作用,然而更多的研究表明,只有那些具有多重保护机制的药物才能在近期和远期预后中能起到较为切实有效的作用。在实验中,我们研究了褪黑素在早期脑损伤中的作用,并且研究了它对蛛网膜下腔出血后大鼠脑组织细胞凋亡、血脑屏障功能障碍、脑水肿、神经功能障碍和死亡率的影响。我们的研究表明,在大鼠蛛网膜下腔出血2 h后腹腔注射褪黑素显著改善了蛛网膜下腔出血后24 h时的预后,降低了大鼠的死亡率,改善了大鼠的神经功能评分。
在蛛网膜下腔出血的早期,通常可以观察到血脑屏障的破坏、内皮细胞功能障碍以及随后的脑水肿。而继发于这些改变的便是颅内压升高、严重的神经功能障碍和较高的死亡率[16,17]。在我们的研究中,我们在蛛网膜下腔出血后24 h 也发现了SAH 组大鼠存在脑水肿和血脑屏障破坏,但通过褪黑素治疗可以减轻脑水肿和血脑屏障的破坏程度。
很多研究已经确定在动脉瘤蛛网膜下腔出血过程中,神经元、星形胶质细胞和少突胶质细胞都会发生凋亡[18,19]。我们的结果表明蛛网膜下腔出血后脑组织的相关区域凋亡水平上升,而通过褪黑素的治疗可以降低其上升程度。另外,有证据表明外源性和内源性凋亡机制在蛛网膜下腔出血后的细胞凋亡过程中均被激活[20,21],蛛网膜下腔出血后的细胞凋亡的分子机制主要涉及caspase-3、caspase-8 以及caspase-9,因而在蛛网膜下腔出血后抑制它们的活性对近期和远期的预后均是有益的[11,22,23]。我们的研究表明蛛网膜下腔出血早期褪黑素治疗可以降低caspase-3 的表达,从而降低蛛网膜下腔出血后的细胞凋亡水平,改善神经功能。
总之,我们的研究表明大鼠蛛网膜下腔出血后早期褪黑素治疗有降低细胞凋亡水平、减轻脑水肿和保护血脑屏障的作用,并可能通过上述作用减轻蛛网膜下腔出血后的早期脑损伤,降低蛛网膜下腔出血的死亡率,改善神经功能。但是褪黑素降低细胞凋亡和保护血脑屏障的机制尚不明确,需要进一步的实验去探索研究。
[1]Bederson JB.Guidelines for the management of aneurysmal subarachnoid hemorrhage:A statement for healthcare professionals from a special writing group of the stroke council[J].Stroke,2009,40(3):994-1025.
[2]Cahill J,Zhang JH.Subarachnoid hemorrhage is it time for a New direction[J].Stroke,2009,40(3):86-87.
[3]Matz PG,Fujimura M,Chan PH.Subarachnoid hemolysate produces DNA fragmentation in a pattern similar to apoptosis in mouse brain[J].Brain Res,2000,858(2):312-319.
[4]Sabri M,Kawashima A,Ai J,et al.Neuronal and astrocytic apoptosis after subarachnoid hemorrhage:A possible cause for poor prognosis[J].Brain Res,2008,1238:163-171.
[5]Rodriguez C,Mayo JC,Sainz RM,et al.Regulation of antioxidant enzymes:a significant role for melatonin[J].J Pineal Research,2004,36(1):1-9.
[6]Bonnefont-Rousselot D,Collin F,Jore D,et al.Reaction mechanism of melatonin oxidation by reactive oxygen species in vitro[J].J Pineal Research,2011,50(3):328-335.
[7]Galano A,Tan DX,Reiter RJ.On the free radical scavenging activities of melatonin’s metabolites[J].J Pineal Research,2013,54(3):245-257.
[8]Poeggeler B,Saarela S,Reiter RJ,et al.Melatoin a-a highly potent endogenous radical scavenger and electron-donor-new aspects of the oxidation chemistry of this indole accessed in-virro[J].Annals of the New York Academy of Sciences,1994,738:419-420.
[9]Cheung RTF.The utility of melatonin in reducing cerebral damage resulting from ischemia and reperfusion[J].Journal of Pineal Research,2003,34(3):153-160.
[10]Cheung RTF,Tipoe GL,Tam S,et al.Preclinical evaluation of pharmacokinetics and safety of melatonin in propylene glycol for intravenous administration[J].Journal of Pineal Research,2006,41(4):337-343.
[11]Park S,Yamaguchi M,Zhou C,et al.Neurovascular protection reduces early brain injury after subarachnoid hemorrhage[J].Stroke,2004,35(10):2412-2417.
[12]Sugawara T,Ayer R,Jadhav V,et al.A new system evaluating bleeding scale infilament perforation subarachnoid hemorrhage rat model[J].Journal of Neuroscience Methods,2008,167(2):327-334.
[13]Garcia JH,Wagner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerdbral-artery occlusion in rats-statistical validation[J].Stroke,1995,26(4):627-634.
[14]Czosnyka M,Pickard JD,Kirkpatrick PJ,et al.In intracranial pressure and brain biochemical monitoring[M].Vienna:Springer Vienna,2002,11:253-256.
[15]Sehba FA,Hou J,Pluta RM,et al.The importance of early brain injury after subarachnoid hemorrhage[J].Progress in Neurobiology,2012,97(1):14-37.
[16]Iuliano BA,Pluta RM,Jung C,et al.Endothelial dysfunction in a primate model of cerebral vasospasm[J].J Neurosurgery,2004,100(2):287-294.
[17]Jung CS,Iuliano BA,Harvey-White J,et al.Association between cerebrospinal fluid levels of asymmetric dimethyl-L-arginine,an endogenous inhibitor of endothelial nitric oxide synthase,and cerebral vasospasm in a primate model of subarachnoid hemorrhage[J].J Neurosurgery,2004,101(5):836-842.
[18]Dreier JP,Ebert N,Priller J,et al.Products of hemolysis in the subarachnoid space inducing spreading ischemia in the cortex and focal necrosis in rats:a model for delayed ischemic neurological deficits after subarachnoid hemorrhage[J].J Neurosurgery,2000,93(4):658-666.
[19]Prunell GF,Svendgaard NA,Alkass K,et al.Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain[J].J Neurosurgery,2005,102(6):1046-1054.
[20]Cheng G,Wei L,Zhi-dan S,et al.Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway[J].BMC Neuroscience,2009,10:7-17.
[21]Meguro T,Chen B,Lancon J,et al.Oxyhemoglobin induces caspasemediated cell death in cerebral endothelial cells[J].J Neurochemistry,2001,77(4):1128-1135.
[22]Kuroiwa T,Baethmann A,Czernicki Z,et al.Brain Edema Xii[M].Vienna:Springer Vienna,2003.483-487.
[23]Zhou C,Yamaguchi M,Kusaka G,et al.Caspase inhibitors prevent endothelial apoptosis and cerebral vasospasm in dog model of experimental subarachnoid hemorrhage[J].J Cerebral Blood Flow and Metabolism,2004,24(4):419-431.

