大菱鲆四倍体的人工诱导研究*
吴志昊 尤 锋① 宋宗诚 胡金伟, 王丽娟 朱香萍 谭训刚 李 军
(1.中国科学院海洋研究所实验海洋生物学重点实验室 青岛 266071;2.威海圣航水产科技有限公司 威海 264200;3.中国科学院大学 北京 100049;4.青岛农业大学动物科技学院 青岛 266109)
大菱鲆(Scophthalmus maximus)属于菱鲆科(Scophthalmidae)、菱鲆属(Scophthalmus)(Nelson,2006),原产于欧洲北海、波罗的海和地中海沿岸,自 1992年由黄海水产研究所引入我国,已成为我国北方主要的海水养殖品种。但是,近年来大菱鲆由于累代养殖和近亲交配,造成孵化率、成活率下降,生长慢,抗逆性差等现象不断发生(马爱军等,2010)。因此,采取有效方法对大菱鲆进行遗传改良,从根本上解决大菱鲆养殖产业良种化问题已成当务之急。
多倍体作为细胞工程育种的重要组成部分,一直受到研究者和养殖业者的关注,特别是不育的三倍体生物可将用于繁殖的能量转化到生长方面,避免了性腺发育和成熟繁殖阶段生长停滞、肉质下降和死亡率增高等现象,因而具有较高的经济价值(刘筠等,2003)。以大菱鲆为例,超过1龄的三倍体个体生长显著快于二倍体个体(P<0.05)。而且由于没有因性成熟、产卵产精带来的伤害,成熟三倍体个体的成活率比二倍体对照要高8%(Calet al,2006)。但是,三倍体鱼因为具有三套染色体,不能进行正常的减数分裂而达不到性成熟,因此三倍体每代都需要进行人工诱导,既繁琐,成功率又不高,制约了三倍体的大规模应用。而四倍体的生殖细胞由于含有偶数染色体组是可育的,成熟的四倍体与正常的二倍体杂交则可进行大批量的、一劳永逸的三倍体生产,故四倍体的研究一直受到重视(尤锋,1999)。20世纪80年代以来,通过染色体组调控技术诱导四倍体,在鱼类遗传育种领域已得到广泛的应用,并在虹鳟(Salmo gairdneri)(Chourrout,1982)、斑点叉尾(Ictalurus punctatus)(Bidwellet al,1985)、罗非鱼(Oreochromis niloticus和O.mossambicus)(Myers,1986)、鳙鱼(Anstichthys nobilis)(洪云汉,1990)、水晶彩鲫(Carassius auratustransparent colored variety)(桂建芳等,1991)等鱼类中进行了应用。但在海水鱼类中仅在欧鲈(Dicentrarbus labrax)(Peruzziet al,2003)、黄金鲈(Perca flavescens)(Malisonet al,1993)、半滑舌鳎(Cynoglossus semilaevis)(李文龙等,2012)和牙鲆(Paralichthys olivaceus)(衣启麟等,2012)中有一些尝试。到目前为止,有关大菱鲆四倍体的人工诱导,国内外尚未见报道。本研究探索了静水压诱导大菱鲆四倍体受精卵染色体加倍的条件,并获得了高诱导率的大菱鲆初孵仔鱼,其结果将为大菱鲆四倍体成鱼的获得以及进一步三倍体规模化生产提供参考。
1 材料与方法
1.1 实验材料
本研究所用大菱鲆亲鱼均来自威海圣航水产有限公司,雌鱼全长 40—60cm,雄鱼全长 35—50cm。亲鱼在产卵季节前进行营养强化,并通过控光、控温等方法进行生殖调控。亲鱼成熟后,选择体型正常,性腺发育良好的同批亲鱼,人工收集质量较好的精卵进行人工授精。授精及后续孵育过程水温保持在14.8—15.5°C之间的恒定温度下。各组实验均有二倍体对照,并进行4次重复。
1.2 静水压适宜处理时刻的筛选
根据预备实验结果,设置5个处理时刻梯度,分别为卵裂前 20min、17.5min、15min、12.5min、10min。实验中,处理压力为67.5MPa,处理时间为6min。处理后的受精卵正常孵化,统计各组受精率、原肠胚成活率、孵化率和诱导率,筛选最适处理起始时刻。
1.3 静水压适宜处理压力的筛选
根据上述实验结果,将处理时刻定为卵裂前15min,设置 5个处理压力梯度,分别为 62.5MPa、65MPa、67.5MPa、70MPa、72.5MPa。实验中,处理时间为6min。处理后的受精卵正常孵化,统计各组受精率、原肠胚成活率、孵化率和诱导率,筛选最适处理压力。
1.4 静水压适宜处理时间的筛选
根据上述实验结果,将处理时刻设定为卵裂前15min,处理压力设定为67.5MPa,设置5个处理时间梯度,分别为 4min、5min、6min、7min、8min。处理后的受精卵正常孵化,统计各组受精率、原肠胚成活率、孵化率和诱导率,筛选最适处理起间。
1.5 正交实验
根据单因子实验筛选结果,设计3×3正交表,进行三因子三水平实验,设置处理时刻分别为卵裂前20min、15min、10min;处理压力分别为 62.5MPa、67.5MPa、72.5MPa;处理时间分别为 4min、6min、8min。处理后的受精卵正常孵化,统计各组受精率、原肠胚成活率、孵化率和诱导率。
1.6 胚胎及仔鱼倍性鉴定
采用染色体制片计数和流式细胞仪检测DNA相对含量进行倍性鉴定。
染色体制片:每诱导组和对照组选取 100—200粒原肠胚中期胚胎,进行秋水仙碱处理、0.075mol/L KCl低渗、卡诺氏液(甲醇:冰乙酸=3︰1)固定、滴片、空气干燥、15%Giemsa染色,获得的染色体制片在显微镜油镜下观察和计数。每一组随机选取30个以上中期分裂相,计算其中四倍体分裂相所占比例即为该组诱导率。
流式细胞仪检测 DNA相对含量:每诱导组和对照组采取 10尾以上初孵仔鱼,分别捣碎、过 260目筛绢、DAPI染色、流式细胞仪(PARTEC,CCA-Ⅱ)检测DNA相对含量。将二倍体对照DNA相对含量设为100,四倍体DNA 相对含量则应为200。四倍体检出个体数与总检测个体数比值即为四倍体诱导率。
1.7 数据分析
诱导组和对照组每组各取出约 1000粒受精卵,于600mL杯中孵育,计算受精率、原肠胚成活率、孵化率及诱导率。具体公式如下:
受精率(%) = 发育到囊胚期受精卵数/总上浮卵数×100%
原肠胚成活率(%) = 发育到原肠胚中期卵数/上浮卵数×100%
孵化率(%) = 正常初孵仔鱼卵数/总上浮卵数×100%
诱导率(%) = 四倍体分裂相数/总分裂相数×100% 或四倍体初孵仔鱼数/正常初孵仔鱼数×100%
诱导组与对照组受精率的比例即为相对受精率,同理计算相对原肠胚成活率及相对孵化率。后文若无特殊说明均为相对受精率、原肠胚成活率及孵化率。
使用 SPSS16.0软件计算平均值和标准差,并使用Duncan’s多重比较分析差异的显著性。
2 结果
2.1 胚胎发育、仔鱼孵化及倍性鉴定
诱导组胚胎形态与对照组基本一致(图1),在早期卵裂过程中可观察到一些分裂不均衡的现象。在15.0—15.5°C孵化时鱼苗约110h破膜,略晚于二倍体对照组(100h左右)。
二倍体大菱鲆染色体数为 2n=44(Bouzaet al,1994),因此将染色体数为 88的视为大菱鲆四倍体,计算大菱鲆四倍体诱导率(图2)。而流仪测试则是以二倍体为对照,将二倍体对照组峰值设为 100,如果样品峰值为200则视为四倍体。流仪倍性测定仅为原肠胚染色体制片结果进行部分验证,结果显示两种方法结果基本一致,故本文各诱导组四倍体率使用原肠胚期染色体计数方法结果。

图1 大菱鲆对照组(上)与诱导组(下)的胚胎发育观察Fig.1 Embryo development of turbot in control and induction groups
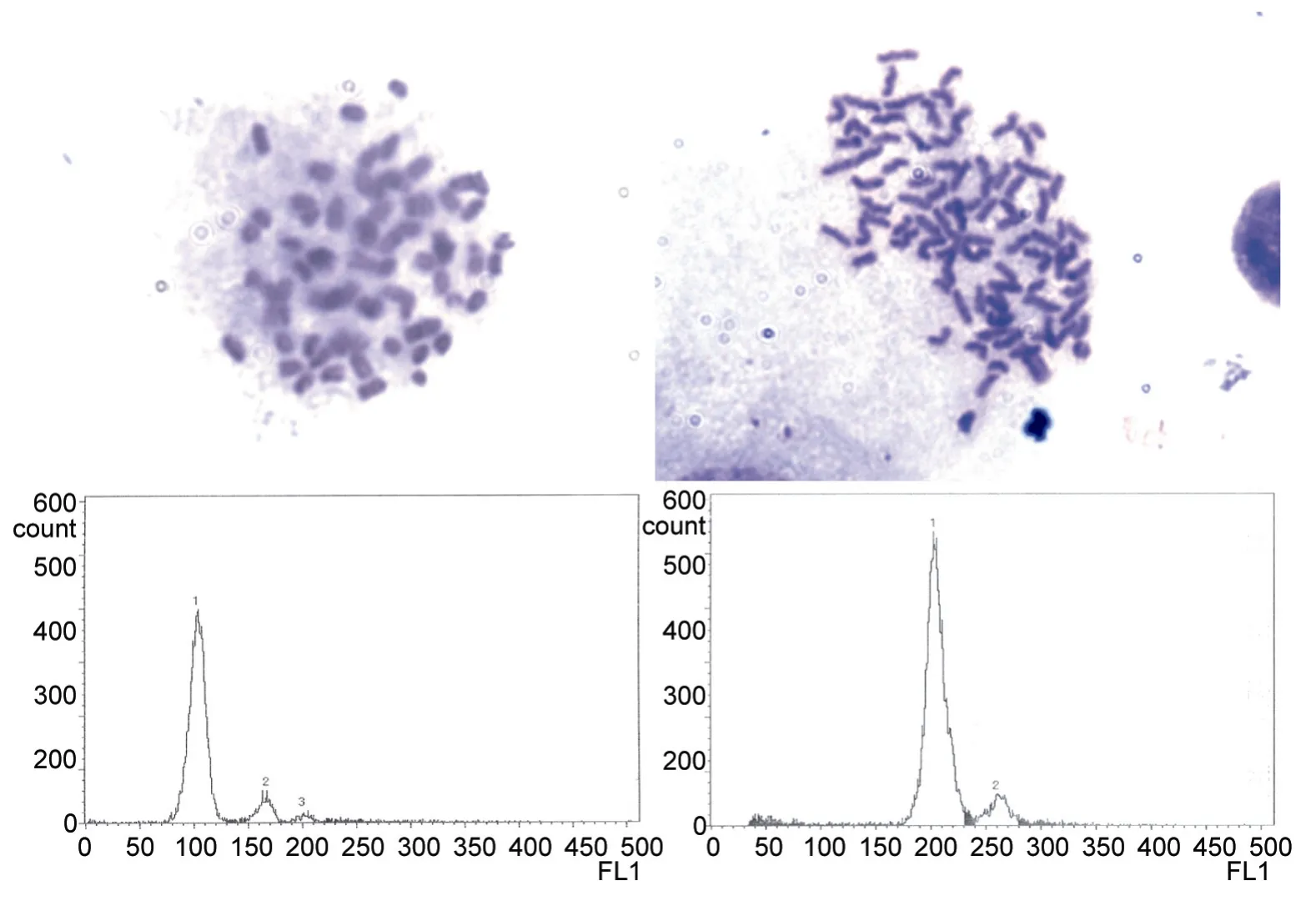
图2 大菱鲆二倍体对照(左)和人工诱导四倍体(右)的染色体中期分裂相(上,1000×)和流式细胞仪(下)检测结果Fig.2 Chromosome(above,1000×) and histograms of ploidy analysis(below) of turbot in control(left) and induction groups(right)
2.2 单因子实验结果
不同处理时刻、处理压力和处理时间对受精率、原肠胚成活率、孵化率及诱导率的影响如图3。卵裂前12.5min处理的受精率显著高于其它各组(P<0.05),其孵化率也相对较高,但卵裂前15min处理时诱导率较高,综合考虑选择卵裂前15min作为进一步实验的处理时刻;67.5MPa处理的受精率、孵化率及诱导率均为几个组中较高的,因此认为67.5MPa为较适处理压力;处理时间各组之间均无显著差异,但处理6min其诱导率相对较高,因此认为6min为较适的处理时间。
2.3 正交实验结果
正交实验结果见表1,结果显示,处理时刻对原肠胚成活率和孵化率有显著影响(P<0.05),其中卵裂前15min处理效果最好。处理时刻对诱导率和孵化率的影响较处理压力和处理时间更大(表2)。处理压力和处理时间对受精率、原肠胚成活率、孵化率和诱导率影响均不显著,但处理压力的影响大于处理时间。
3 讨论
人工诱导多倍体方法包括生物学、化学和物理学方法三大类。其中,生物学方法主要是通过远缘杂交产生三倍体或四倍体后代,如 He等(2012)用红鲫(♀)与翘嘴鲌(♂)杂交获得了异源三倍体、四倍体。但这种方法受鱼种的限制较大,仅在少数特定鱼种中可获得成功。化学法主要是利用秋水仙素(colchicine)和细胞松弛素B(cytochalasin B,CB)等化学药品,抑制第二极体的排出或抑制早期卵裂,从而达到产生三倍体或四倍体的目的。但化学药品具有毒性,在鱼类中使用通常得到的是嵌合体,目前应用已较少(Chourrout,1984)。物理学方法主要包括温度休克法和压力休克法,是鱼类三倍体、四倍体诱导最为常用的方法,操作起来较简单、在生产实践中容易被接受,但四倍体中温度法诱导率较低。与温度休克法相比,压力休克法在鱼类四倍体诱导中更加有效。其通过静水压机产生的高静水压来抑制受精卵卵裂,达到染色体加倍的目的,在四倍体诱导中尤其有效。其处理时间较短,压力传导均匀,对受精卵的损伤小,在适宜条件下可以获得较高的成活率及诱导率(90%—100%),对冷、温水性鱼类都适用而被广泛采用(Xuet al,2008)。本研究结果也表明,静水压法能够有效地诱导大菱鲆四倍体。
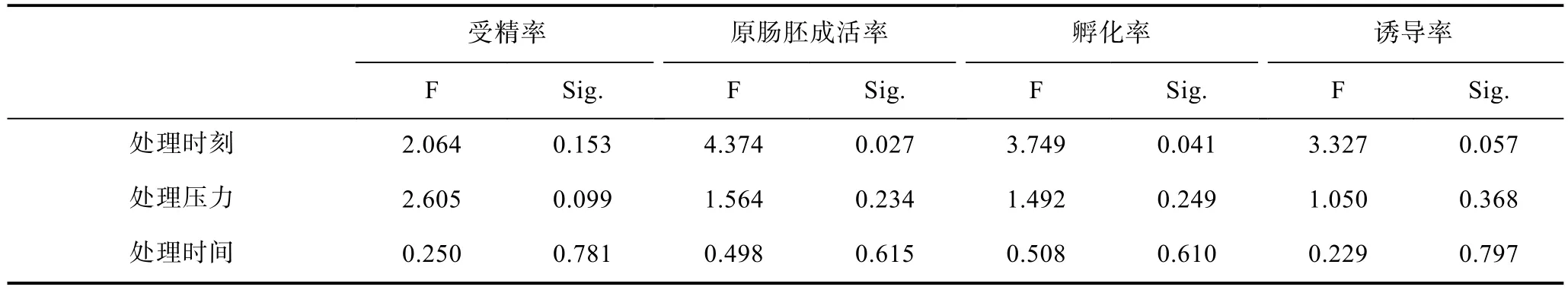
表1 大菱鲆四倍体人工诱导正交实验结果Tab.1 Results of orthogonal experiment in turbot tetraploid induction

表2 大菱鲆四倍体人工诱导正交实验结果分析Tab.2 Analysis of orthogonal experiment in turbot tetraploid induction

图3 不同处理时刻(a)、处理压力(b)和处理时间(c)对受精卵受精率、原肠胚成活率、孵化率及诱导率的影响Fig.3 Effects of initiation time,treatment pressure and treatment duration on fertility rate,survival rate of gastrula stage,hatching rate and tetraploid rate
静水压处理效果主要是受处理时刻、处理持续时间和处理压力强度三因素的影响。由本文结果可看出,不同处理时刻和不同处理压力下,各诱导组之间的受精率、孵化率和诱导率存在显著差异(P<0.05);而不同处理时间下各诱导组间受精率、孵化率和诱导率差异均不显著,说明处理时间实验结果的影响较小,而合适处理时刻和处理压力的确定更为重要,这也与正交试验的结果基本一致。静水压诱导鱼类四倍体是通过抑制受精卵卵裂使受精卵染色体加倍的,其处理时刻一般在第一次卵裂前,从受精至卵裂的孵育时间中,受精卵的低同步性、卵裂调控的复杂性以及外界的环境变化,都会对受精卵的发育造成影响,使得最佳处理时刻很难确定。若提前处理,则受精卵还未发育到预期程度就开始被处理,极大降低了诱导效率;若延后处理,则受精卵已经开始卵裂,进而影响其对卵裂的抑制效果,导致非整倍体的产生,会导致死亡率的升高(Sakaoet al,2006)。为能准确的确定处理时刻,本实验是根据易于观察确定的第一次卵裂痕出现的时间,并结合对照组来计算处理时刻的。如此,可以减少水温和气温等环境因素的影响。
到目前为止,成功获得两性可育且能自然繁殖的人工诱导四倍体鱼的研究在鲆鲽鱼类等纯海水鱼类中还未见报道。李文龙等(2012)利用静水压诱导得到半滑舌鳎的四倍体鱼苗,其四倍体率达到 68.3%;衣启麟等(2012)通过静水压方法诱导四倍体牙鲆,在培育到8—15cm的子代中检测出13.3%的四倍体,但也远未达到性成熟。本实验在初孵仔鱼中可检测到超过70%的四倍体,但这些仔鱼的死亡率往往较高,并且导致随着诱导组仔鱼的生长发育,其四倍体率逐渐降低。此外,实验中也观察到四倍体诱导组受精卵前期卵裂出现较多卵裂不均衡现象,其卵质也远低于采用同批精卵受精的二倍体对照组。这与牙鲆同质雌核发育诱导中出现的现象十分相似(Wanget al,2008),作者推测这些现象可能与受精卵分裂异常导致非整倍体的产生有关,抑或是加倍引起隐性致死基因的纯合所致,但具体原因尚需进一步分析。
马爱军,王新安,雷霁霖,2010.大菱鲆(Scophthalmus maximus)选育家系的构建和培育.海洋与湖沼,41(3):301—306
尤 锋,1999.海洋生物技术新进展——海产鱼类多倍体育种进展.北京:海洋出版社,148—155
刘 筠,刘少军,孙远东等,2003.多倍体鲫鲤.中国农业科技导报,5:3—6
衣启麟,于海洋,王兴莲等,2012.静水压力诱导牙鲆(Paralichthys olivaceus)四倍体的条件优化.海洋与湖沼,43(2):382—388
李文龙,陈松林,季相山等,2012 半滑舌鳎四倍体鱼苗的诱导与鉴定.中国水产科学,19(2):196—201
陈敏容,杨兴棋,俞小牧等,1997.白鲫(♀)×红鲫(♂)异源四倍体鱼的倍性操作及其生殖力的研究.水生生物学报,21(3):197—283
洪云汉,1990.热休克诱导鳙鱼四倍体的研究.动物学报,36(1):70—75
桂建芳,孙建民,梁绍昌等,1991.鱼类染色体组操作的研究Ⅱ.静水压处理和静水压与冷休克结合处理诱导水晶彩鲫四倍体.水生生物学报,15(4):333—341
Aldridge F J,Marston R Q,Shireman J V,1990.Induced triploids and tetraploids in bighead carp,Hypophthalmichthys nobilis,verified by multi-embryo cytofluorometric analysis.Aquaculture,87(2):121—131
Bidwell C A,Chrisman C L,Libey G,1985.Polyploidy induced by heat shock in channel catfish.Aquaculture,51:25—32
Bouza C,Sánchez L,Martínez P,1994.Karotypic characterization of turbot(Scophthalmus maximus) with conventional,fluorochrome and restriction endonuclease-banding techniques.Marine Biology,120(4):609—613
Cal R M,Vidal S,Gómez C,Álvarez-Blázquez Bet al,2006.Growth and gonadal development in diploid and triploid turbot(Scophthalmus maximus).Aquaculture,251:99—108
Chourrout D,1982.Tetraploidy induced by heat shocks in the rainbow trout(Salmo gairdneriR.).Reproduction Nutrition Development,22:569—574
Chourrout D,1984.Pressure-induced retention of second polar body and suppression of first cleavage in rainbow trout:Production of all-triploids,all-tetraploids,and heterozygous and homozygous diploid gynogenetics.Aquaculture,36(1—2):111—126
He W,Qin Q,Liu Set al,2012.Organization and variation analysis of 5S rDNA in different ploidy level hybrids of red cruciancarp×topmouthculter.PLoS ONE,7(6):e38976.doi:10.1371/journal.pone.0038976
Malison J A,Kayes T B,Held J Aet al,1993.Manipulation of ploidy in yellow perch(Perca flavescens) by heat shock,hydrostatic pressure shock and spermatozoa inactivation.Aquaculture,110:229—242
Myers J M,1986.Tetraploid induction inOreochromisspp.Aquaculture,57:281—287
Nelson J S,2006.Fishes of the world,4th ed.New York.John Wiley and Sons
Peruzzi S,Chatain B,2003.Induction of tetraploid gynogenesis in the European sea bass(Dicentrarbus labraxL.).Genetica,119:225—228
Refstie T,1981.Tetraploid rainbow trout produced by cytochalasin B.Aquaculture,25:51—58
Sakao S,Fujimoto T,Kimura S,2006.Drastic mortality in tetraploid induction results from the elevation of ploidy in masu salmonOncorhynchus masou.Aquaculture,252(2—4):147—160
Wang W,You F,Xu J H,2008.Genetic analysis of meio- and mitogynogenetic stocks ofParalichthys olivaceuswith microsatellite markers.ACTA Oceanologica Sinica,27(2):149—156
Xu J,You F,Wu X,2008.Induction of triploidy in large yellow croackerPseudosciaena crocea(Richardson,1846):effects of pressure shocks and growth performance in the first rearing year.Aquaculture Research,39:1369—1376

