不同脂肪水平下添加胆汁酸对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和脂肪代谢的影响*
孙建珍 王际英① 马晶晶 李宝山 郝甜甜 孙永智 张利民
(1.上海海洋大学水产与生命学院 上海 201306;2.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006)
脂肪为鱼类生长发育提供能量和必需脂肪酸,是鱼类必需的营养物质。研究发现,饲料中适宜脂肪水平可提高鱼体生长性能(Chouet al,1996;Wanget al,2005);过低会造成必需脂肪酸缺乏,蛋白质消耗过多,导致鱼体生长缓慢,饲料利用率下降;过高则会抑制鱼类生长,导致体内脂肪过度蓄积(Duet al,2005;Pedroet al,2009)。
胆汁酸是胆汁的重要组成成分,是胆固醇代谢过程中产生的一系列固醇类物质。胆汁酸具有较强的表面活性,能降低油水两相间的表面张力,促进脂类乳化,扩大脂肪和脂肪酶的接触面积,加速脂类的消化吸收(唐胜球等,2009)。研究表明,饲料中添加胆汁酸可以显著提高日本鳗鲡(Anguilla japonica)(Maitaet al,1996)、异育银鲫(Carassius auratus gibelio)(谭永刚等,2008)、军曹鱼(Rachycentron Canadum)(周书耘等,2010)等的生长并降低饵料系数;提高日本鳗鲡(Maitaet al,1996)和牙鲆(Paralichthys olivaceus)(Alamet al,2001)脂肪酶活性,促进脂肪代谢;降低罗氏沼虾(Macrobrachium rosenbergii)(马俊霞等,2008)肝脏脂肪沉积,减少脂肪肝的发生(Pieterset al,1991)。目前,胆汁酸作为一种降脂因子,在养殖业上的应用越来越广泛。
大菱鲆(Scophthalmus maximus)属鲆科(Bothidae)、菱鲆属(Scophthalmus),生长迅速、肉味鲜美、经济价值高,是我国重要的海水养殖品种。有关胆汁酸在大菱鲆配合饲料中的研究报道较少且不够系统(李勇等,2006)。本文以大菱鲆幼鱼为实验对象,在不同脂肪水平(10%和 18%)的配合饲料中分别添加 0%和1.5%的胆汁酸,研究胆汁酸对大菱鲆幼鱼生长、体组成和脂肪代谢的影响,旨在为大菱鲆配合饲料中胆汁酸的应用提供理论参考。
1 材料与方法
1.1 实验设计及饲料制作
以鱼粉、豆粕为蛋白源,鱼油为脂肪源,使饲料配方中粗蛋白含量为47%,粗脂肪含量分别为10%和18%。在每个脂肪水平下分别添加 0%、1.5%的胆汁酸(以玉米淀粉为载体,纯度为 20%,山东龙昌动物保健品有限公司),配制成4种等氮饲料,并分别命名为D1、D2、D3和D4。实验饲料配方和营养组成见表1。
所有原料粉碎过 80目筛,营养成分分析后,依据饲料配方,采用逐级扩大法混匀后,加入鱼油及适量蒸馏水再次混合均匀,经螺旋挤压机加工成直径为2.5mm的硬颗粒饲料,自然风干后置于–20°C冰箱保存待用。
1.2 饲养管理
养殖实验在山东省海洋资源与环境研究院海水循环系统内进行。大菱鲆幼鱼购自蓬莱宗哲养殖有限公司,实验鱼在养殖系统中驯养2周,驯养期间投喂大菱鲆商品饲料(山东升索渔用饲料研究中心,粗蛋白 50%,粗脂肪 12%)。两周后挑选规格整齐、体质健壮,平均体重为(45.78±0.11)g的幼鱼360尾,随机分为4组,每组3个重复,每个重复30尾鱼,养殖实验持续8周。
水质条件:水温 16—18°C,溶氧>7.0mg/L,氨氮浓度<0.05mg/L。光照周期为12h光照 :12h黑暗。实验期间每天饱食投喂两次(08:00,16:00),日投喂量为鱼体重 1.5%左右,根据鱼体生长情况调整投喂量,投喂30min后从排水口将残饵排出,记录残饵数量。
1.3 样品采集
饲养实验结束后禁食 24h,称每桶鱼总重,计算增重率。每桶随机取12尾鱼,用MS-222麻醉后测量体长、体重,计算肥满度。随机取3尾用作全鱼样本,剩余9尾尾静脉取血,血样在4°C静置4h后,4°C条件下 4000r/min离心 10min,吸取上层血清放置在–80°C超低温冰箱中保存待测。取血后分离出肝胰脏并称重,计算肝体比;取背部肌肉,用于常规成分和脂肪酸的分析;所有样品均于–80°C保存备用。

表1 实验饲料配方及营养组成(%干物质)Tab.1 Formulation and nutrient composition of the experimental diets(%,DW)
1.4 测定指标与方法
1.4.1 生长性能
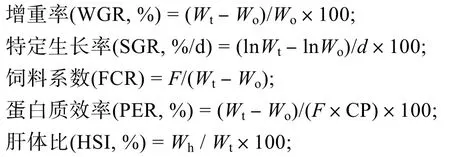
式中,Wo为实验开始时鱼体重量(g),Wt为实验结束时鱼体重量(g),Wh为肝胰脏重量(g),F为摄食量(g),d为养殖周期(d),CP为饲料粗蛋白。
1.4.2 常规成分测定 水分采用 105°C 烘干恒重法测定(GB/T6435-2006);粗蛋白采用杜马斯燃烧法测定(LECO FP-528);粗脂肪采用索氏抽提法测定(GB/T6433-2006);粗灰分采用 550°C 灼烧法(GB/T6433-2007);能量采用氧弹仪燃烧法测定(PARR 6100)。
1.4.3 血清和肝脏生化指标 血清中的甘油三酯(TG)、总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)和谷草转氨酶(AST)均采用全自动生化分析仪(日立,7020)测定,试剂盒购于北京利德曼生化股份有限公司。
脂肪酶(LPS)采用聚乙烯醇橄榄油乳化液水解法测定,肝脏蛋白采用考马斯亮蓝法测定。肝脂酶(HL)、脂蛋白脂酶(LPL)采用试剂盒(购自南京建成生物工程研究所)测定。
1.4.4 肌肉脂肪酸含量测定
(1) 分析样品中总脂肪提取:参照 Folch等(1957)介绍的氯仿-甲醇法,脂肪甲酯化参考氢氧化钾-甲醇酯化法(寇秀颖等,2005),略作改进,样品经皂化-甲酯化后供高效气相色谱仪分析用。
(2) 色谱条件:日本岛津GC2010气相色谱仪
SP-2560气相色谱柱:美国 SUPELCO公司,100m×0.25mm×0.2μm;
载气:99.99%高纯氮,氢气 40mL/min,空气400mL/min;
柱温:240°C;气化室温度 260°C;分流比 90 :l;
氢离子火焰检测器(FID),温度260°C;
采用程序升温法:起始温度140°C,保持5min,以4°C /min升温至240°C,并维持10min,进样量为1μL。
(3) 脂肪酸鉴定:根据标准品气相色谱出峰的保留时间,鉴定各种脂肪酸;采用峰面积归一化法计算脂肪酸的相对百分含量。
1.5 数据统计分析
采用SPSS 16.0软件对实验所得数据进行双因素方差分析(Two-way ANOVA),差异显著时(P<0.05),用 Duncan’s多重比较检验。统计数据均以平均值±标准差(Means±SD)表示。
2 结果
2.1 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼生长性能的影响
实验期间各实验组大菱鲆均未出现死亡。不同脂肪水平下添加胆汁酸对大菱鲆幼鱼生长性能的影响见表2。如表2所示,随着饲料脂肪水平升高,D3组与D1组相比 WGR、SGR、PER分别提高了 38.16%、26.03%和31.99%(P<0.05),FCR降低了22.66%,HSI无显著差异(P>0.05);在不同脂肪水平下添加胆汁酸后,D2组与D1组相比大菱鲆幼鱼WGR、SGR和PER分别提高了12.26%、8.96%和9.84%(P<0.05),FCR、HSI分别降低了14.84%、40.97%(P<0.05);D4组与D3组相比WGR、SGR和PER分别提高了8.38%、5.75%和5.16%(P<0.05),HSI降低了 28.08%(P<0.05),FCR无显著变化(P>0.05);但不同脂肪水平处理组间仍存在显著差异,表现为D4组WGR、SGR、PER和HSI较D2组分别提高了33.41%、26.03%、26.36%和23.53%(P<0.05),FCR 降低了17.43%(P<0.05)。双因素分析结果显示,饲料脂肪和胆汁酸二者之间的交互作用对大菱鲆幼鱼生长性能指标均无显著影响(P>0.05)。

表2 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼生长性能的影响Tab.2 Effects of bile acids on growth performance of juvenile turbot at different dietary lipid levels
2.2 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼体组成的影响
不同脂肪水平下添加胆汁酸对大菱鲆幼鱼体组成的影响见表3。由表3可知,当饲料脂肪水平由10%升高至18%,未添加胆汁酸组(D1组,D3组)肝脏、背肌、全鱼粗脂肪含量均有显著升高(P<0.05);全鱼粗灰分含量有明显下降趋势(P<0.05);而各组织水分及粗蛋白含量均未见有显著变化(P>0.05)。在各脂肪水平下添加胆汁酸可显著降低全鱼和背肌水分、粗脂肪含量(P<0.05),显著提高其粗蛋白含量(P<0.05),但对肝脏粗脂肪及背肌粗灰分含量均无显著影响(P>0.05)。D4组全鱼、背肌和肝脏粗脂肪含量显著高于 D2组,但全鱼粗灰分,肝脏水分、粗蛋白显著低于 D2组(P<0.05)。大菱鲆幼鱼常规成分指标均不受饲料脂肪和胆汁酸二者之间的交互作用的影响(P>0.05)。

表3 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼常规成分的影响(%)Tab.3 Effects of bile acids on proximate composition of juvenile turbot at different dietary lipid levels(%)
2.3 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼肌肉脂肪酸的影响
不同脂肪水平下添加胆汁酸对大菱鲆幼鱼肌肉脂肪酸的影响见表4。由表4可知,随着饲料脂肪水平升高,肌肉 SFA中仅 C17:0含量有显著升高(P<0.05)。饲料中添加胆汁酸可显著提高肌肉C18:0含量(P<0.05),饲料脂肪和胆汁酸二者之间的交互作用对C18:0含量存在显著影响(P<0.05),但均对SFA含量无显著影响(P>0.05);饲料脂肪水平对MUFA含量无显著影响(P>0.05),但对其中各主要脂肪酸含量(除C22:1n-7外)均有显著影响(P<0.05)。饲料胆汁酸能显著影响肌肉MUFA及其C16:1n-7、C18:1n-9、C18:1n-7和C22:1n-9含量(P<0.05)。饲料脂肪和胆汁酸二者之间的交互作用仅对C22:1n-9含量有显著的影响(P<0.05);饲料脂肪(C18:3n-6除外)和胆汁酸水平(C20:2n-9除外)对PUFA中各脂肪酸含量均有显著影响,且二者之间的交互作用对 C18:2n-6、C18:3n-6、C20:3n-3、ARA、DPA含量和n-3/n-6比值均有显著的影响(P<0.05)。
2.4 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼血清生化指标的影响
不同脂肪水平下添加胆汁酸对大菱鲆幼鱼血清生化指标的影响见表5。表中数据显示,饲料脂肪和胆汁酸水平对血清 TG、TCHO、HDL-C、LDL-C含量及ALT、AST活性均有显著影响(P<0.05)。随着饲料脂肪水平的升高,D3组血清TG、TCHO、HDL-C、LDL-C、ALT和AST均显著高于D1组(P<0.05)。在两个脂肪水平下添加胆汁酸均能显著降低以上指标,但 D4组仍显著高于 D2组(P<0.05)。TG、TCHO和HDL-C均受饲料脂肪和胆汁酸二者之间的交互作用的影响(P<0.05)。
2.5 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼脂肪代谢酶的影响

表4 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼肌肉脂肪酸组成的影响(%总脂肪酸)Tab.4 Effects of bile acids on dorsal muscle fatty acid composition of juvenile turbot at different dietary lipid levels(%,total fatty acids)
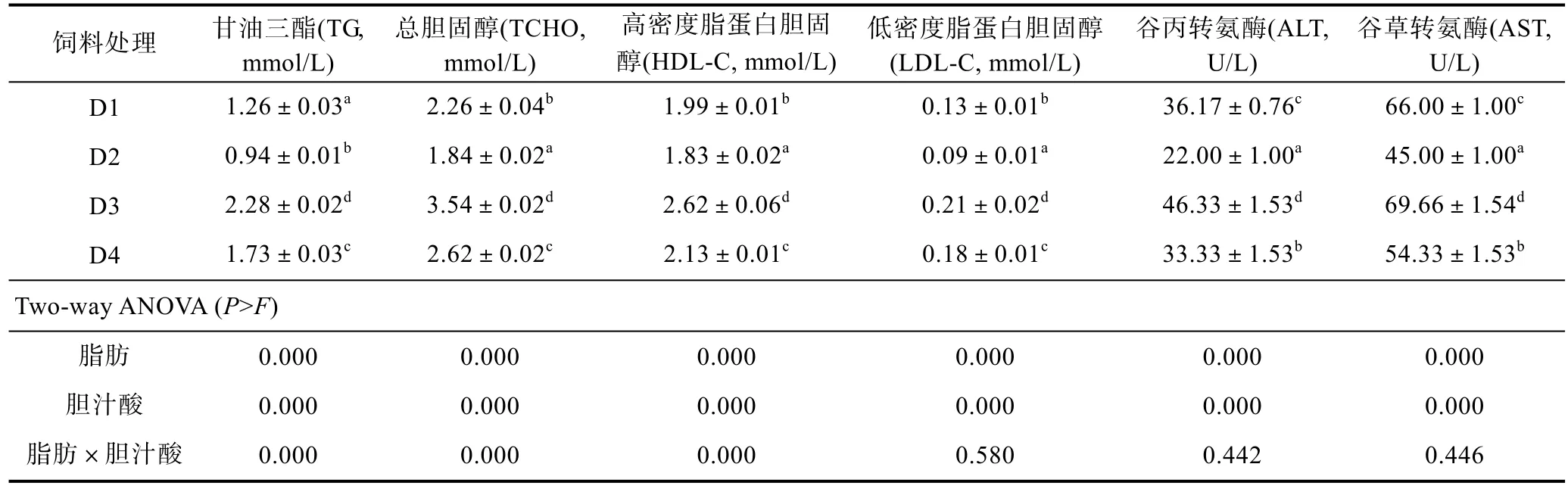
表5 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼血清生化指标的影响Tab.5 Effects of bile acids on serum biochemical indices of juvenile turbot at different dietary lipid levels
不同脂肪水平下添加胆汁酸对大菱鲆幼鱼脂肪代谢酶的影响见表6。由表可知,随着饲料脂肪水平升高,D3组LPL、HL、TL和LPS活性显著高于D1组(P<0.05);在两个脂肪水平下添加胆汁酸均可显著提高以上脂肪代谢酶活性(P<0.05),且D4与D2组间仍存在显著差异(P<0.05)。HL、TL活性均显著受饲料脂肪和胆汁酸二者之间的交互作用的影响(P<0.05)。
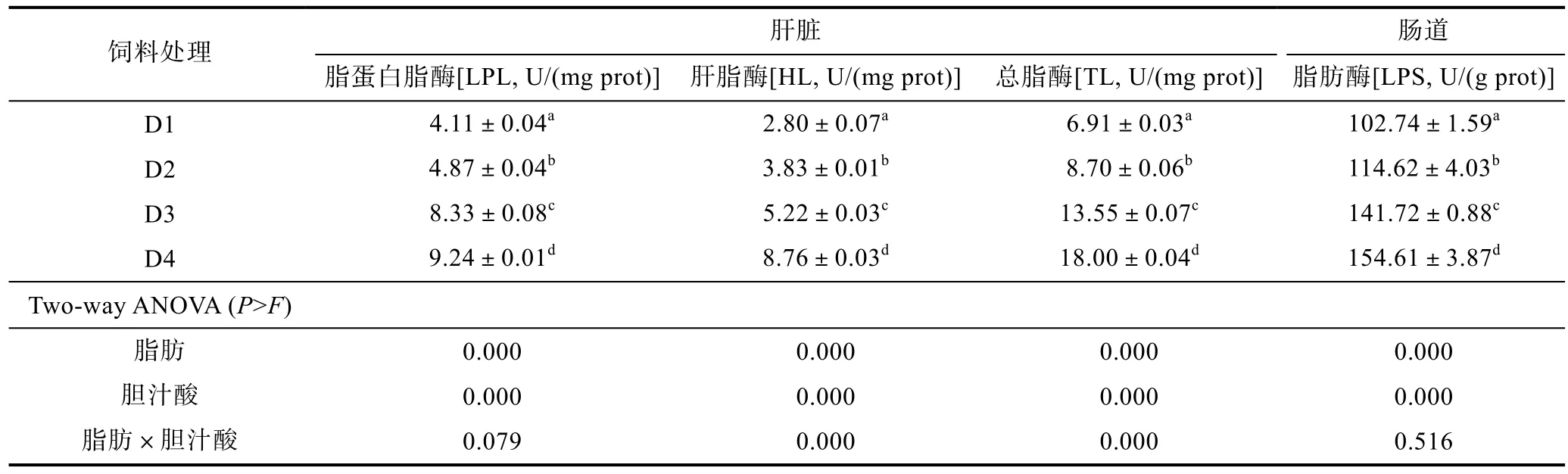
表6 不同脂肪水平下添加胆汁酸对大菱鲆脂肪代谢酶活性的的影响Tab.6 Effects of bile acids on lipid metabolism enzymes activities of juvenile turbot at different dietary lipid levels
3 讨论
3.1 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼生长性能的影响
Nijhof(1993)研究发现,饲喂含 16.90%脂肪的饲料,大菱鲆增重率和蛋白效率显著高于饲喂 10.60%脂肪的饲料;Cho等(2005)报道,与6.90%脂肪的饲料相比,16.80%脂肪的饲料提高了大菱鲆生长和特定生长率。在本实验中,18%脂肪水平组实验鱼WGR、SGR和 PER均显著高于 10%脂肪水平组,略高于以上研究中大菱鲆饲料脂肪水平,这可能与实验鱼规格、饲料脂肪水平及脂肪源、实验条件等因素有关。另外,本研究结果表明,在一定脂肪水平范围内,大菱鲆幼鱼生长性能随饲料脂肪水平升高呈上升趋势,与奥尼罗非鱼(Oreochromis niloticus×Oreochromis aureus)(甘辉等,2009;林仕梅等,2010)和梭鱼(Chelon haematocheilus)(张春暖等,2012)等的研究结果一致。
研究发现,饲料中添加胆汁酸能有效提高虹鳟(Oncorhynchus mykiss)(颉志刚等,2002)、黄尾鱼(Seriola aureovittata)(Deshimaluet al,1982)生长性能、降低饲料系数。与以上研究一致,本实验结果显示,在10%和18%脂肪水平下,添加胆汁酸均能显著提高大菱鲆幼鱼WGR、SGR和PER,降低FCR,但其提高程度因脂肪水平而异,18%脂肪水平组提高幅度小于 10%脂肪组,表明高脂肪组需要更多的胆汁酸参与脂肪乳化,加速脂类消化吸收,进而促进鱼体生长(王继强等,2009)。在本实验中,未观察到饲料脂肪和胆汁酸二者之间的交互作用对其生长性能指标有影响。
3.2 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼体组成和肌肉脂肪酸的影响
在本实验中,大菱鲆幼鱼全鱼、肌肉和肝脏中脂肪沉积量均随着饲料脂肪含量增加而增加,与军曹鱼(Wanget al,2005)和大菱鲆(Sætheret al,2001;Leeet al,2003)等研究结果相一致。与本研究结果不同,Regost等(2001)报道随着饲料脂肪水平的增加,大菱鲆全鱼和肝脏中粗脂肪沉积量均有所增加,但肌肉粗脂肪含量变化不明显;在两个脂肪水平下添加胆汁酸均能显著降低全鱼、肌肉中粗脂肪含量,显著提高其粗蛋白含量,表明胆汁酸能促进脂肪分解供能,对蛋白质具有节约作用,进而提高组织中蛋白沉积量。与本研究结果相吻合,林仕梅等(2003)报道,饲料中添加胆汁酸可以显著提高异育银鲫全鱼粗蛋白含量。周书耘等(2010)研究发现,添加胆汁酸能显著提高军曹鱼全鱼和肌肉粗蛋白含量。
本研究结果显示,大菱鲆幼鱼肌肉 n-3HUFA含量随饲料脂肪水平升高呈上升趋势,进一步验证了Cho等(2005)的研究结果。王恒(2010)研究发现,添加胆汁酸可降低罗氏沼虾肌肉中PUFA和HUFA含量。与此一致,在本实验中,两个脂肪水平下添加胆汁酸均显著降低了肌肉PUFA、n-3 PUFA、n-6 PUFA含量和 n-3/n-6比值,表明胆汁酸能较好地促进 PUFA在大菱鲆幼鱼体内的吸收和利用。
3.3 不同脂肪水平下添加胆汁酸对大菱鲆幼鱼脂肪代谢的影响
在本实验中,随着饲料脂肪水平的升高,血清TG、TCHO、HDL-C、LDL-C含量呈上升趋势,与胭脂鱼(Myxocyprinus asiaticus)(王朝明等,2010)和梭鱼(Chelon haematocheilus)(张春暖等,2013)等的研究结果相似。饲料中添加胆汁酸能显著降低大菱鲆幼鱼血清TG、TCHO、HDL-C和LDL-C含量,可能是因为胆汁酸可以通过提高极低密度脂蛋白核受体、载脂蛋白A-V和载脂蛋白C-Ⅱ的表达,促进TG的水解,进而降低血清TG含量(Sirventet al,2004);通过降低肝脏载脂蛋白A-Ⅰ的表达,减少高密度脂蛋白(HDL)中胆固醇的含量,最终降低血清TCHO水平(Massonet al,2005)。Boulias等(2005)研究表明,胆汁酸可以通过FXR-α途径调控与HDL代谢相关的基因,被激活的 FXR-α可以通过诱导 SHP表达上调肝细胞 HDL外向转运载体和下调肝细胞内摄 HDL载体,减少HDL的分泌,降低血清HDL-C的浓度。但郭永丽等(2008)对草鱼(Ctenopharyngodon idella)的研究表明,外源胆汁酸能够提高草鱼血清中TG、TCHO、HDL-C和LDL-C含量。周书耘(2010)在军曹鱼的饲料中添加胆汁酸,提高了血液中TG和HDL-C的含量,降低了TCHO和LDL-C含量。本实验结果与以上结论有一定差异,这可能与鱼的种类、生长阶段、食性及饲养条件等有关系,具体原因有待进一步研究。
谷草转氨酶(AST)、谷丙转氨酶(ALT)是肝细胞内两种重要转氨酶。当肝细胞遭受破坏或细胞膜通透性增加时,血液中 AST和 ALT活性会显著升高,可用于反映肝脏损伤情况(金芬芬等,2001;蒋永芳等,2005)。本研究中,AST、ALT随饲料脂肪水平升高而升高,与奥尼罗非鱼(甘辉等,2009)、草鱼(汪开毓等,2012)的研究结果相似。但在两个脂肪水平下,各胆汁酸处理组的AST、ALT活性均有显著降低,表明胆汁酸对肝脏有一定保护作用,进而促进了营养物质的消化吸收。
脂蛋白脂酶(LPL)和肝脂酶(HL)是肝胰脏中参与脂肪降解的两种关键酶,合称总脂酶(TL)。LPL可将血液中的乳糜颗粒和极低密度脂蛋白携带的TG水解成甘油和脂肪酸(Wonget al,2002;Mukherjee,2003),控制其在各组织的含量,决定从饲料中摄入脂类的代谢途径(Auwerxet al,1992;Zechner,1997)。HL在肝细胞中合成,可作为配体促进 LDL和乳糜颗粒残粒进入肝细胞,并直接参与HDL-C的逆转和HDL残粒的分解(Choiet al,1998)。已有研究发现,高脂肪水平可以诱导瓦氏黄颡鱼肝脏LPL mRNA表达(郑珂珂等,2010),增强梭鱼肝脏 LPL、HL活性(张春暖等,2013)。在本实验中,随着饲料脂肪水平升高,大菱鲆幼鱼LPL、HL和TL活性呈显著升高趋势,且在10%和 18%脂肪水平下添加胆汁酸均能显著提高其活性,这可能是因为胆汁酸能通过增加载脂蛋白表达激活LPL(向枭等,2008)。同时还可通过乳化脂肪成乳糜颗粒,促进肝细胞 HL合成,且该作用随饲料脂肪水平升高有增强趋势。以上结果表明添加胆汁酸可以改善高脂水平下大菱鲆幼鱼的肝脏功能(倪燕君等,1999;Wonget al,2002)。
脂肪酶是鱼类消化食物中的脂肪所必需的。对真鲷(Pagrosomus major)(王重刚等,1998)、星斑川鲽(Platichthys stellatus)(Dinget al,2010)、奥尼罗非鱼(Oreochromis niloticus×Oreochromis aureus)(黎军胜等,2004)的研究表明,脂肪酶活性与饲料脂肪含量呈负相关。但本实验中,实验鱼脂肪酶活性随着饲料脂肪水平升高而升高,这可能与两个实验中所用实验动物和脂肪梯度不同有关。研究发现,胆汁酸能够将小肠内脂肪酶原激活为有活性的脂肪酶使其发挥作用,并能增强其活性(刘敬盛等,2010)。胆汁酸能使脂肪酶结合到甘油三酯的脂滴表面上且起催化作用,提高脂肪酶活性,促进脂肪消化。目前为止,仍未发现其它物质可以替代胆汁酸对脂肪酶的这种桥梁和联结作用(Romanski,2007)。Maita等(1996)研究发现,添加胆汁酸可显著增强日本鳗鲡脂肪酶活性。Alam等(2001)报道胆汁酸可以显著提高牙鲆脂肪酶活性,进而促进脂肪代谢。与此一致,在本实验中,添加胆汁酸可显著提高大菱鲆幼鱼肠道脂肪酶活性,进一步验证了以上观点。
4 结语
本研究结果表明,饲料脂肪和胆汁酸水平均可显著影响大菱鲆幼鱼生长性能、体组成及脂肪代谢等指标,但胆汁酸添加效果受饲料脂肪水平的影响。因此,不同脂肪水平下胆汁酸的适宜添加量以及饲料脂肪与胆汁酸的交互作用仍有待进一步研究。
马俊霞,张胜鹏,李卓建等,2008.含胆汁酸制剂对罗氏沼虾脂肪代谢的影响.全国动物生理生化第十次学术交流会论文摘要汇编.陕西杨凌:中国畜牧兽医学会动物生理生化学分会,133—134
王 恒,2010.不同脂肪源及胆汁酸对罗氏沼虾生长性能及脂肪酸组成的影响.扬州:扬州大学硕士学位论文,52—62
王重刚,陈品建,顾 勇等,1998.不同饵料对真鲷稚鱼消化酶活性的影响.海洋学报,20(4):103—106
王继强,龙 强,李爱琴等,2009.胆汁酸的生理功能及在养殖业的应用研究进展.中国动物保健,(7):103—107
王朝明,罗 莉,张桂众等,2010.饲料脂肪水平对胭脂鱼生长性能、肠道消化酶活性和脂肪代谢的影响.动物营养学报,22(4):969—976
甘 辉,李坚明,冯光明等,2009.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响.上海海洋大学学报,18(1):35—41
向 枭,周兴华,陈 建等,2008.饲料中脂肪含量对翘嘴红鲌幼鱼消化酶活性的影响.北京水产,5:35—38
刘敬盛,杨玉芝,王君荣等,2010.胆汁酸的营养特性及其在家禽生产中应用的研究进展.中国畜牧兽医,37(1):13—16
李 勇,王优军,王 雷等,2006.不同添加剂及其组合对大菱鲆生长性能与水环境的影响.饲料工业,27(10):25—28
汪开毓,苗常鸿,黄锦炉等,2012.投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶 1 mRNA表达的变化.动物营养学报,24(12):2375—2383
张春暖,王爱民,刘文斌等,2012.饲料脂肪水平对梭鱼生长营养物质消化及体组成的影响.江苏农业学报,28(5):1088—1095
张春暖,王爱民,刘文斌等,2013.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响.中国水产科学,20(1):108—115
林仕梅,叶元土,罗 莉,2003.胆汁酸添加剂对异育银鲫生长的影响.广东饲料,(3):14—15
林仕梅,罗 莉,2010.饲料脂肪水平和复合降脂因子对罗非鱼生长性能和肝胰脏代谢、抗氧化指标的影响.动物营养学报,22(6):1585—1591
金芬芬,徐 团,秦圣娟等,2001.镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影.水生生物学报,35(6):1019—1023
周书耘,2010.饲料中磷水平和添加胆汁酸对军曹鱼幼鱼生长、体组成和肝脏组成的影响.广州:中山大学硕士学位论文,46—48
周书耘,刘永坚,梁海鸥等,2010.饲料中添加胆汁酸对军草鱼生长及体组成的影响.南方水产,8(1):20—25
郑珂珂,朱晓鸣,韩 冬等,2010.饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响.水生生物学报,34(4):815—821
倪燕君,刘厚钰,张顺财等,1999.肝酯酶、脂蛋白酯酶在脂肪肝发病中的作用.中华消化杂志,19(4):324—327
郭永丽,饶碧波,马俊霞等,2008.外源胆汁酸对草鱼生长、抗氧化能力及脂肪代谢的影响.全国动物生理生化第十次学术交流会论文摘要汇编.陕西杨凌:中国畜牧兽医学会动物生理生化学分会,185—186
唐胜球,董小英,孙德文,2009.饲用添加剂胆汁酸的最新研究进展.广东饲料,1:32—35
颉志刚,牛翠娟,2002.可利康对虹鳟生长的影响.饲料研究,(10):22—25
蒋永芳,旷晖峰,2005.慢性乙型病毒性肝炎患者血清 HBV DNA水平和谷丙转氨酶与肝组织病理的关系.重庆医科大学学报,30(4):578—580
谭永刚,魏文志,曾党胜等,2008.饲料中添加胆汁酸对异育银鲫生长性能的影响.广东饲料,17(1):25—26
黎军胜,李建林,吴婷婷,2004.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响.中国水产科学,11(6):585—588
Alam M S,Teshima S,Ishikawa Met al,2001.Methionine requirement of juvenile Japanese flounderParalichthys olivaceusestimated by the oxidation of radioactive methionine.Aquaculture Nutrition,7(3):201—209
Auwerx J,Leroy P,Schoonjans K,1992.Lipoprotein lipase:recent contributions from molecular biology.Critical Reviews Clinical Laboratory Sciences,29(34):243—268
Boulias K,Katrakili N,Bamberg Ket al,2005.Regulation of hepatic metabolic pathways by the orphan nuclear receptor SHP.The EMBO Journal,24:2624—2633
Cho S H,Lee S M,Lee J Het al,2005.Effect of dietary protein and lipid levels on growth and body composition of juvenile turbot(Scophthalmus maximusL) reared under optimum salinity and temperature conditions.Aquaculture Nutrition,11,235—240
Choi S Y,Goldberg I J,Curtiss L Ket al,1998.Interaction between ApoB and hepatic lipase mediates the uptake of ApoB-containing lipoproteins.Journal of Biological Chemistry,273(32):20456—20462
Chou B S,Shiau S Y,1996.Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromis niloticus×Oreochromis aureus.Aquaculture,143:185—195
Deshimalu O,Kuroki K,Yone Y,1982.Suitable levels of lipids and ursodeoxycholic acid in diet for yellowtail.Bulletin of Japanese Society of Scientific Fisheries,48:1265—1270
Ding L Y,Zhang L M,Wang J Yet al,2010.Effect of dietary lipid level on growth performance,feed utilization,body composition and blood chemistry of juvenile starry flounder(Platichthys stellatus).Aquaculture Research,41(10):1470—1478
Du Z Y,Liu Y J,Tian L Xet al,2005.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp(Ctenopharyngodon idella).Aquaculture Nutrition,(11):139—146
Lee J K,Cho S H,Park S Uet al,2003.Dietary protein requirement for young turbot(Scophthalmus maximusL.).Aquaculture Nutrition,9:283—286
Maita M,Tachiki,Kaibar Aet al,1996.Pharmacological effect of ursodeoxycholic acid in juvenile eel.Nippon Suisan Gakkaisi,62(1):129—130
Masson D,Lagrost L,Athias Aet al,2005.Expression of the preguane X receptor in mice antagonizes the cholic acidmediated changes in plasma lipoprotein profile.Arteriosclerosis Thrombosis and Vascular Biology,25:2164—2169
Mukherjee M,2003.Human digestive and metabolic lipasesabrief review.Journal of Molecular Catalysis B:Enzymatic,22:369—376
Nijhof N,1993.Effects of Body Weight on Diet Requirements of Turbot(Scophthalmus maximus) with Special Reference to Feed Intake and Body Composition.In:Kaushik S J,Luquet P ed.Fish Nutrition in Practice.INRA,Paris,501—513
Pedro B,Beatriz O,Susana Cet al,2009.Dietary lipid level affects growth performance and nutrient utilization of Senegalese sole(Solea senegalensis) juveniles.British Journal of Nutrition,102:1007—1014
Pieters M N,Schouten D,Bakkerren H Fet al,1991.Selective uptake of cholesteryl esters from apolipoprotein-E-free high-density lipoproteins by rat parenchymal cells in vivo is efficiently coupled to bile synthesis.Biochemical Journal,280:359—365
Regost C,Arzel J,Cardinal L Met al,2001.Dietary lipid level,hepatic lipogenesis and flesh quality in turbot(Psetta maxima).Aquaculture,193:291—309
Romanski K W,2007.The role and mechanism of action of bile acids in the digestive system-bile acids in the liver and bile.Advances in Clinical and Experimental Medicine,16(6):793—799
Sæther B S,Jobling M,2001.Fat content in turbot feed:influence on feed intake,growth and body composition.Aquaculture Research,32:451—458
Sirvent A,Claudel T,Martin Get al,2004.The farnesoid X receptor induces very low density lipoprotein receptor gene expression.FEBS Lett,566:137—173
Wang J T,Liu Y J,Tian L Xet al,2005.Effect of dietary lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia(Rachycentron canadum).Aquaculture,249:439—447
Wong H,Schotz M C,2002.The lipase gene family.Journal of Lipid Research,43:993—999
Zechner R,1997.The tissue specific expression of lipoprotein lipase:implications for energy and lipoprotein metabolism.Current Opinion in Lipidolopy,8(2):77—88

