菲律宾蛤仔(Venerupis philippinarum)Rho型GST和微粒体型GST的序列分析及表达特征研究*
章盈盈 袁泽轶 王 清 李巧梅 吴惠丰 赵建民①
(1.中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室 烟台 264003;2.国家海洋信息中心 天津 300171;3.中国科学院大学 北京 100049)
谷胱甘肽 S-转移酶(glutathione S-transferase,GST)是一类广泛分布的多功能超家族酶系,主要催化还原型谷胱甘肽(GSH)的巯基与疏水性化合物的亲电子基团结合,将其转化为水溶性代谢产物并排出体外,从而达到解毒目的(Eatonet al,1999)。此外,GST具有过氧化物酶和异构酶活性,可参与氧化应激信号通路的调节,避免 H2O2等引起的细胞死亡(Adleret al,1999;Hayeset al,2005);同时,GST能够以非催化的形式结合多种内源或外源配体,参与氧化损伤生物大分子的修复及被氧化含巯基蛋白的再生(Sheehanet al,2001;Laborde,2010)。GST 已被发现广泛分布于动物、植物和微生物在内的所有生物中(Pearson,2005)。根据细胞内定位,GST可分为胞质型(Cytosolic GST)、线粒体型(Mitochondria GST,也称为Kappa GST)和微粒体型(Microsomal GST)GST三大类。其中,胞质型 GST分布最广,根据 N-端氨基酸序列、底物特异性等特征,可分成 Alpha、Beta、Rho、Omega等13类;微粒体型GST是一类膜结合蛋白,活化后能够防止脂质的过氧化作用(Mosialouet al,1993),且多具有过氧化物酶活性(Prabhuet al,2001),现已被归入参与花生四烯酸与谷胱甘肽代谢(MAPEG)的膜结合蛋白家族(Jakobssonet al,1999;Hayes et al,2005)。
菲律宾蛤仔(Venerupis philippinarum)是我国沿海各地广泛养殖的经济贝类,其病害问题是制约蛤仔养殖业健康发展的重要瓶颈之一。鳗弧菌(Vibrio anguillarum)作为海洋环境中的常见致病菌之一,已被证明是导致多种双壳贝类发病及死亡的重要原因。通过探讨菲律宾蛤仔抗病功能基因在病原菌感染下的表达规律,有助于深入了解机体的固有免疫防御系统。本研究采用 cDNA末端快速扩增(Rapid Amplification of cDNA Ends,RACE)技术,从菲律宾蛤仔中克隆获得 Rho型 GST(VpGSTR)和微粒体型GST(VpGSTMi)的cDNA全长序列,并运用实时荧光定量PCR方法研究了VpGSTR和VpGSTMi的组织分布及其在鳗弧菌刺激下的时序表达特征,可为进一步探讨 GST在菲律宾蛤仔抵御病原侵染中的免疫功能提供依据。
1 材料与方法
1.1 实验用动物及试剂
实验用菲律宾蛤仔(壳长 3—4cm)购于烟台当地水产市场,在过滤海水中暂养10d后开始鳗弧菌侵染实验;暂养期间,持续曝气,每天定时投喂扁藻并进行完全换水。
Trizol试剂购自美国Invitrogen公司,M-MLV反转录酶购于美国Promega公司,Taq DNA Polymerase购于美国 Fermentas公司,pMD18-T载体、DNA Marker、SYBR Premix Ex TaqTM均为大连宝生物工程有限公司产品,凝胶回收试剂盒、质粒提取试剂盒购自天根生化科技有限公司,其余试剂均购自国药集团。
1.2 组织取样及鳗弧菌刺激
实验用的鳗弧菌购于中国海洋微生物保藏中心,株型为1A07299。将鳗弧菌接种于2216E液体培养基,培养至对数生长期后离心收集菌体;采用灭菌过滤海水重悬菌体,以 107CFU/mL的浓度浸泡刺激菲律宾蛤仔;分别在处理后 6、12、24、48、96h采集血淋巴样品,低速离心(2000r/min,4°C)收集血淋巴细胞用于总RNA提取,每个时间点采集6个平行样本。实验过程中,设置未经任何处理的对照组。
分别采集对照组的肝胰腺、血淋巴细胞、鳃、性腺和肌肉组织,用以测定目的基因的组织表达,每个组织设置6个平行。
1.3 总RNA提取及cDNA合成
总RNA提取使用 Trizol试剂,具体操作参照说明书。cDNA合成按照美国Promega公司的M-MLV反转录酶操作说明书进行;以总 RNA为模板,Oligo dT为逆转录引物,反应条件如下:70°C 5min,冰上放置 1—2min,42°C 50min,65°C 15min 终止反应,并于4°C结束程序。
1.4 目的基因全长cDNA的扩增
根据实验室已有的 EST序列,分别设计基因特异 性 引 物 :VpGSTR(F1:5′-TTACCGCTGGATGAA CAAGG-3′,F2:5′-AAGAACGCCAACACTGGATA-3′),VpGSTMi(F3:5′-CGTATTGCCCTTCGTTCTGA-3′,F4:5′-ACATGCCAGCCCTAATCACA-3′)。采用巢氏PCR扩增后,将纯化的目的片段连接到pMD-18T载体,转化至Escherichia coliTop10F′感受态细胞;经蓝白斑筛选和菌落PCR鉴定,分别挑取5个阳性克隆送至北京诺赛基因公司进行序列测定。
1.5 生物信息学分析
将获得的 VpGSTR和 VpGSTMi序列提交Genbank数据库注册,并采用 BLAST在线程序进行比对分析。经 CLUSTALⅩ进行多序列比对排列后,用 MEGA4.0构建系统进化树,计算方法为邻位相连法(Neighbor-Joining)和自展内部分枝法(Bootstrapping)评定进化树的可靠性,重复次数为1000。
1.6 VpGSTR和VpGSTMi基因的时空表达
采用ABI7500荧光定量PCR系统,测定目的基因的组织分布及其在鳗弧菌刺激后的时序表达情况。实验过程中,以菲律宾蛤仔β-actin为内参基因(Actin-RT-F:5′-CTCCCTTGAGA AGAGCTACGA-3′,Actin-RT-R:5′-GATACCAGCAGATTCCATACCC-3′);VpGSTR和 VpGSTMi的基因特异性引物分别为:VpGSTR-F:5′-AAGACGGGGATCTTGTTGTG-3′,VpGSTR-R:5′-TCTCTGTCACGTTCGTTTGC-3′;VpGSTMi-F:5′-ACGTATTGCCCTTCG TTCTG-3′,VpGSTMi-R:5′-AACATGCCAGCCCTAATCAC-3′。荧光定量 PCR参照本实验室已经优化的扩增体系及反应条件进行(Zhanget al,2012),数据处理采用 2−ΔΔCT法(Livaket al,2001),使用 SPSS软件进行单因素方差分析(ANOVA),P<0.05认定为差异显著。
2 结果
2.1 序列分析
通过序列拼接,分别获得VpGSTR与VpGSTMi的全长 cDNA序列,GenBank注册号依次为GQ384394与GQ384399。其中,VpGSTR的开放阅读框(ORF)包括 705bp(图1),编码 234个氨基酸,预测分子量为 27.43kDa,理论等电点为 9.64。经 BLAST比对分析可知,VpGSTR基因编码的蛋白序列与南极帽贝(Laternula elliptica)GSTR的相似性为64%,而与其它物种的序列相似性较低。SMART软件分析显示,VpGSTR为分泌型蛋白,具有典型的谷胱甘肽S-转移酶 N-末端结构域(G位点,M1—E76)和 C-末端结构域(H位点,T108—R198)。多重比对结果表明,参与谷胱甘肽结合的 N-末端区域较为保守,而与特异性疏水底物结合的C-末端保守性较低(图2)。
VpGSTMi的ORF包括450bp(图3),编码149个氨基酸,预测分子量为 16.74kDa,理论等电点为9.84。BLAST分析发现,VpGSTMi编码的蛋白序列与太平洋牡蛎(Crassostrea gigas)及皱纹盘鲍(Haliotis discus discus)的相似性分别是和61%和62%。Pfam在线软件分析显示,VpGSTMi具有典型的 MAPEG(Membrane Associated Proteins in Eicosanoid and Glutathione metabolism)膜蛋白结构域(F16—R145)。此外,微粒体型 GST的酶活性位点精氨酸残基(R114)和酪氨酸残基(Y121)也高度保守(图4)。

图1 VpGSTR全长cDNA序列及推测的氨基酸序列Fig.1 The full-length cDNA of VpGSTR and deduced amino acid sequence
2.2 系统进化分析
系统进化分析结果显示,胞质型 GST和微粒体型 GST分别聚类(图5)。本研究获得的 VpGSTR和VpGSTMi分别归于Rho型簇和微粒体型簇。VpGSTR首先与菲律宾蛤仔的Rho亚型、南极帽贝(L.elliptica)聚成一簇,这三个物种的 GSTR再与斑马鱼(Danio rerio)、鲤鱼(Cyprinus carpio)等鱼类的GSTR聚成Rho型GST分支;而VpGSTMi归属于MAPEG家族中的GSTMi1,并与GSTMi3、GSTMi2形成微粒体型GST分支。VpGSTMi与长牡蛎(Crassostrea gigas)、皱纹盘鲍(H discus discus)、栉孔扇贝(Azumapecten farreri)聚成一个分支,表明 VpGSTMi与无脊椎动物的GSTMi亲缘关系较近,而与哺乳动物的亲缘关系较远。由上可见,菲律宾蛤仔 Rho型和微粒体型 GST在进化分类中的地位与传统分类学中的位置相符合。
2.3 VpGSTR和VpGSTMi基因的组织分布
利用实时荧光定量 PCR技术,检测了 VpGSTR和VpGSTMi基因在菲律宾蛤仔的组织分布特征。结果发现,在肝胰腺、鳃、血淋巴细胞、外套膜和肌肉中均可检测到VpGSTR和VpGSTMi基因的表达,且均以肝胰腺组织中的表达水平最高。其中,VpGSTR的表达从高到低依次为肝胰腺>鳃>血淋巴细胞>外套膜>肌肉(图6a),而VpGSTMi的表达水平则为肝胰腺>血淋巴细胞>鳃>外套膜>肌肉(图6b)。

图2 VpGSTR与其它物种GSTR的多重比对结果Fig.2 Multiple alignment of the deduced amino acid sequence of VpGSTR with GSTR from Laternula elliptica (ACM44933),Daniorerio (NP001038525),Cyprinus carpio (ABD67511),Oreochromis aureus (ACT22667)

图3 VpGSTMi全长cDNA序列及推测的氨基酸序列Fig.3 The full-length cDNA of VpGSTMi and deduced amino acid sequence

图4 VpGSTMi与其它物种GSTMi的多重比对结果Fig.4 Multiple alignment of deduced amino acid sequence of VpGSTMi with GSTMi from Bubalus bubalis (AEB71425),Xenopus laevis(NP001084720),Homo sapiens (AAP36387),Haliotis discus discus (ABO26660),and Ictalurus furcatus (ADO28130)
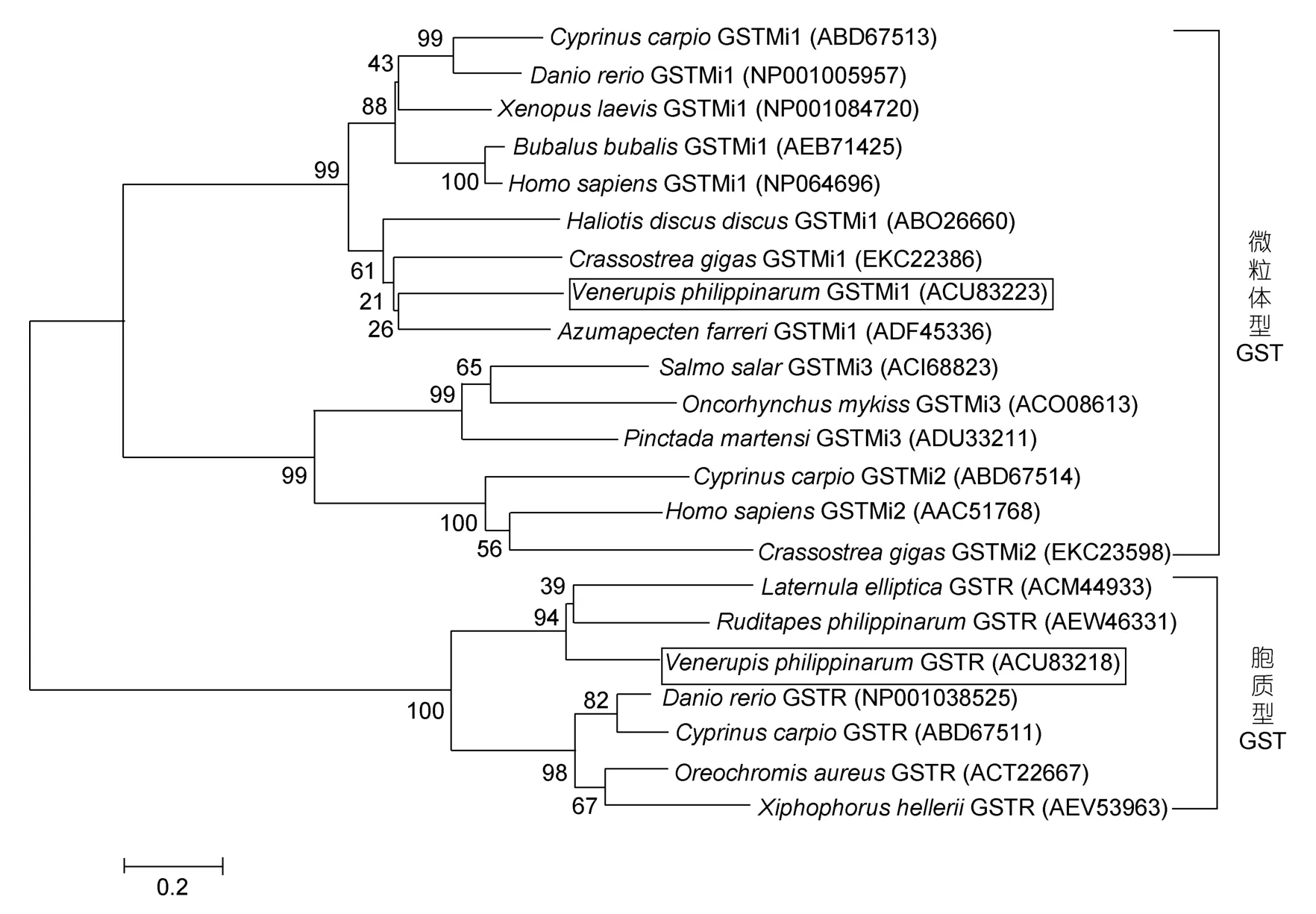
图5 Rho型GST和微粒体型GST的系统进化分析Fig.5 Phylogenetic tree of Rho and microsomal class GST proteins constructed by neighbor-joining method based on the sequences from different animals
2.4 VpGSTR和VpGSTMi在鳗弧菌刺激后的时序表达
采用实时荧光定量 PCR,分析了鳗弧菌刺激后菲律宾蛤仔血淋巴细胞中VpGSTR和VpGSTMi基因的时序表达(图7)。结果发现,鳗弧菌刺激 6h后,VpGSTR基因表达量较对照组水平无显著变化;在菌刺激12h和24h后,VpGSTR基因的相对表达量显著升高(P<0.05),分别达到对照组的2.5倍和3.5倍;随着菌刺激时间的延长,VpGSTR基因的表达量逐步回落,在 96h降低到对照组水平。与 VpGSTR类似,VpGSTMi基因的表达量也呈现逐步上升而后又降至对照水平的趋势;其中,暴露 24h后 VpGSTMi基因的表达量较对照组水平显著升高(2.7倍,P<0.05)。

图6 VpGSTR(a)和VpGSTMi(b)在菲律宾蛤仔中的组织分布特征Fig.6 Tissue distribution of VpGSTR(a)and VpGSTMi(b)determined by qRT-PCR

图7 菲律宾蛤仔经鳗弧菌刺激后VpGSTR(a)和VpGSTMi(b)基因的时序表达Fig.7 The temporal expression of VpGSTR(a)and VpGSTMi(b)mRNA in the clams post Vibrio anguillarum challenge
3 讨论
谷胱甘肽硫转移酶普遍存在于生物体内,在机体有毒化合物代谢转化和抗氧化反应等过程中起着重要作用。目前,已在多种海洋动物中先后发现了多种类型的GST的存在(Wanet al,2008;Xuet al,2010;Liet al,2012;Saranyaet al,2012;Umasuthanet al,2012;Zhanget al,2012;Espinozaet al,2013)。本研究克隆获得了菲律宾蛤仔两种 GST的 cDNA序列,分别属于 Rho型和微粒体型家族。序列分析表明,VpGSTR具有典型的谷胱甘肽 S-转移酶 N-末端结构域(G位点)和C-末端结构域(H位点)。其中,N-末端主要为谷胱甘肽提供结合位点,具有高度保守的色氨酸、丝氨酸、谷氨酸、苯丙氨酸、结氨酸和谷氨酰胺残基(Parket al,2009);而C-末端为特异性的疏水底物提供结合位点,其氨基酸变异程度较高,利于不同底物的结合(Mannerviket al,1988;Blanchetteet al,2007)。VpGSTMi氨基酸序列存在保守的精氨酸残基(R114)和酪氨酸残基(Y121);其中,精氨酸残基(R114)被认为是MAPEG家族催化功能的作用位点,而酪氨酸残基(Y121)可能与酶的活性相关。同时,两个氨基酸残基位置上的相近,有利于催化形成二级结构(Jakobssonet al,1999;Chenet al,2011)。
由于 GST功能的多样性,其在不同物种中的组织分布存在较大差异;且多种内源或者外源因素都被证明可介导 GST在组织中表达量的变化。本研究发现,VpGSTR和VpGSTMi广泛存在于所检测组织中,并以肝胰腺组织中的表达水平最高。这与已有的研究结果相一致,即GST呈多组织分布,且多数GST在海洋动物的肝胰腺或肝脏组织中呈高表达水平(Kimet al,2009;Parket al,2009;邹青青等,2010;Chenet al,2011)。肝胰腺被认为是外源毒物和细菌积聚的主要位点,GST作为重要的解毒酶和抗氧化酶,可能参与了病原菌侵染过程中产生的过量活性氧的清除(Pushpamaliet al,2008)。此外,VpGSTMi在血淋巴细胞中也有较高水平的表达,推测其在血细胞介导的免疫防御中发挥了重要作用。类似的现象在中华绒螯蟹(Eriocheir sinensis)中也有发现,Delta型GST被认为与血淋巴细胞介导的免疫反应密切相关(Zhaoet al,2010)。
本研究中,通过测定鳗弧菌侵染后血淋巴细胞GST基因表达量的变化,探讨了 VpGSTR和VpGSTMi在菲律宾蛤仔免疫防御反应中的作用。结果显示,鳗弧菌刺激可诱导VpGSTR和VpGSTMi基因的表达,并在刺激后 24h达到基因表达的最高峰,随后逐渐恢复至初始水平。目前,有关海洋动物受弧菌侵染后 GST基因表达量变化的结果已有报道。例如,马氏珠母贝(Pinctada martensii)血细胞微粒体型GST和长牡蛎(C.gigas)Sigma型GST在弧菌刺激6h后的表达水平显著提高(Labreucheet al,2006;Chenet al,2011)。海洋双壳贝类由于其滤食习性,会从周围水环境中积累大量的细菌。在应对弧菌等细菌的侵染时,贝类通过改变活性氧(ROS)产生、血细胞吞噬、水解酶活性等来达到免疫目的(Canesiet al,2002)。ROS的增加有利于杀灭入侵细菌,但过量的活性氧对贝类自身也具有毒害作用,因此必须予以清除。抗氧化酶系统对于调节机体内 ROS的水平、维持细胞内稳态、保护机体免受过氧化损伤具有重要作用。研究表明,细菌侵染时伴随吞噬引起的呼吸暴发产生的ROS、有毒的脂质过氧化代谢产物、有机过氧化物和细菌内毒素等均能使得 GST表达量发生变化(Dubovskiyet al,2008)。因此,在细菌刺激过程中,GST可能协同过氧化氢酶(CAT)、超氧物歧化酶(SOD)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPx)、硫氧还蛋白(TRx)等多种酶类参与了活性氧的清除。
邹青青,王军花,郭红军等,2010.池蝶蚌和三角帆蚌谷胱甘肽转移酶基因表达特征.动物学杂志,45(4):96—101
Adler V,Yin Z,Fuchs S Yet al,1999.Regulation of JNK signaling by GSTp.EMBO J,18(5):1321—1334
Blanchette B,Feng X,Singh B R,2007.Marine glutathione S-transferases.Mar Biotechnol(NY),9(5):513—542
Canesi L,Gallo G,Gavioli Met al,2002.Bacteria-hemocyte interactions and phagocytosis in marine bivalves.Microsc Res Tech,57(6):469—476
Chen J,Xiao S,Deng Y,2011.Cloning of a novel glutathione S-transferase 3(GST3)gene and expression analysis in pearl oyster,Pinctada martensii.Fish &Shellfish Immunol,31(6):823—830
Dubovskiy I M,Martemyanov V V,Vorontsova Y Let al,2008.Effect of bacterial infection on antioxidant activity and lipid peroxidation in the midgut ofGalleria mellonellaL.larvae(Lepidoptera,Pyralidae).Comp Biochem Physiol C Toxicol Pharmacol,148(1):1—5
Eaton D L,Bammler T K,1999.Concise review of the glutathione S-transferases and their significance to toxicology.Toxicol Sci,49(2):156—164
Espinoza H M,Shireman L M,McClain Vet al,2013.Cloning,expression and analysis of the olfactory glutathione S-transferases in coho salmon.Biochem Pharmacol,85(6):839—848
Hayes J D,Flanagan J U,Jowsey I R,2005.Glutathione transferases.Annu Rev Pharmacol Toxicol,45:51—88
Jakobsson P J,Morgenstern R,Mancini Jet al,1999.Common structural features of MAPEG—a widespread superfamily of membrane associated proteins with highly divergent functions in eicosanoid and glutathione metabolism.Protein Sci,8(3):689—692
Kim J H,Raisuddin S,Rhee J Set al,2009.Molecular cloning,phylogenetic analysis and expression of a MAPEG superfamily gene from the pufferfishTakifugu obscurus.Comp Biochem Physiol C Toxicol Pharmacol,149(3):358—362
Laborde E,2010.Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death.Cell Death Differ,17(9):1373—1380
Labreuche Y,Lambert C,Soudant Pet al,2006.Cellular and molecular hemocyte responses of the Pacific oyster,Crassostrea gigas,following bacterial infection withVibrio aestuarianusstrain 01/32.Microbes Infect,8(12):2715—2724
Li C,Su X,Li Yet al,2012.Two classes of glutathione S-transferase genes with different response profiles to bacterial challenge inVenerupis philippinarum.Fish &Shellfish Immunol,32(1):219—222
Livak K J,Schmittgen T D,2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod.Methods,25(4):402—408
Mannervik B,Danielson U H,1988.Glutathione transferases structure and catalytic activity.CRC Crit Rev Biochem,23(3):283—337
Mosialou E,Ekström G,Adang A Eet al,1993.Evidence that rat liver microsomal glutathione transferase is responsible for glutathione-dependent protection against lipid peroxidation.Biochem Pharmacol,45(8):1645—1651
Park H,Ahn I Y,Kim Het al,2009.Glutathione S-transferase as a biomarker in the Antarctic bivalveLaternula ellipticaafter exposure to the polychlorinated biphenyl mixture Aroclor 1254.Comp Biochem Physiol C Toxicol Pharmacol,150(4):528—536
Pearson W R,2005.Phylogenies of glutathione transferase families.Methods Enzymol,401:186—204
Prabhu K S,Reddy P V,Gumpricht Eet al,2001.Microsomal glutathione S-transferase A1-1 with glutathione peroxidase activity from sheep liver:molecular cloning,expression and characterization.Biochem J,360(Pt 2):345—354
Pushpamali W A,De Zoysa M,Kang H Set al,2008.Comparative study of two thioredoxin peroxidases from disk abalone(Haliotis discus discus):Cloning,recombinant protein purification,characterization of antioxidant activities and expression analysis.Fish &Shellfish Immunol,24(3):294—307
Saranya Revathy K,Umasuthan N,Lee Yet al,2012.First molluscan theta-class glutathione S-transferase:identification,cloning,characterization and transcriptional analysis post immune challenges.Comp Biochem Physiol B Biochem Mol Biol,162(1):10—23
Sheehan D,Meade G,Foley V Met al,2001.Structure,function
and evolution of glutathione transferases:implications for classification of non-mammalian members of an ancient enzyme superfamily.Biochemical Journal,360(Pt 1):1—16
Umasuthan N,Revathy K S,Lee Yet al,2012.A novel molluscan sigma-like glutathione S-transferase from Manila clam,Ruditapes philippinarum:cloning,characterization and transcriptional profiling.Comp Biochem Physiol C Toxicol Pharmacol,155(4):539—550
Wan Q,Whang I,Lee J,2008.Molecular cloning and characterization of three sigma glutathione S-transferases from disk abalone(Haliotis discus discus).Comp Biochem Physiol B Biochem Mol Biol,151(3):257—267
Xu C,Pan L,Liu Net al,2010.Cloning,characterization and tissue distribution of a pi-class glutathione S-transferase from clam(Venerupis philippinarum):Response to benzo[α]pyrene exposure.Comp Biochem Physiol C Toxicol Pharmacol,152(2):160—166
Zhang L,Qiu L,Wu Het al,2012.Expression profiles of seven glutathione S-transferase(GST)genes fromVenerupis philippinarumexposed to heavy metals and benzo[α]pyrene.Comp Biochem Physiol C Toxicol Pharmacol,155(3):517—527
Zhao D,Chen L,Qin Cet al,2010.A delta-class glutathione transferase from the Chinese mitten crabEriocheir sinensis:cDNA cloning,characterization and mRNA expression.Fish&Shellfish Immunol,29(4):698—703

