正交试验优选槐角中山奈酚的提取工艺
马 敏,王 莉,李 芳,王卫峰#(1.陕西中医学院药学院,陕西咸阳 71046;.陕西省食品药品检验所,西安 710065;.陕西省中医药研究院,西安 71000)
槐角为豆科植物槐Sophora japonicaL.的干燥成熟果实,性寒、味苦,归肝、大肠经,有清热泻火、凉血止血之功效[1]。槐角中含有多种以苷类形式存在的黄酮类化合物,其基本的苷元有4种,即槲皮素、染料木素、山奈酚和异鼠李素[2],本研究将山奈酚含量作为评价指标。山奈酚又称山奈素、4′,5,7-三羟基黄酮醇等,主要是3位或3,7位成苷而在山奈、槐角、银杏叶、金钱草中普遍存在的黄酮醇类化合物,在槐角中含量最高,其药理作用主要有抗氧化、抗炎、抗辐射和预防心血管疾病等药理活性[3]。
笔者拟找到一条工艺合理、操作简单和成本低兼的水浸提法从槐角中将山奈酚提取出来,为工业化提取提供更多的选择。本研究参考有关文献[4-8],采取正交试验法,研究了各个影响因素,确定了槐角中山奈酚提取工艺的最佳条件。
1 材料
1.1 仪器
Acquity UPLC H-Class型超高效液相色谱仪,包括四元高压梯度泵、自动进样器、PDA检测器、柱温箱、EmpowerTM3色谱工作站(美国Waters公司);BP211D型电子分析天平(德国赛多利斯天平有限公司);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);Synergy UV型超纯水器(美国Millipore公司)。
1.2 药材
槐角购于陕西省药材公司,经陕西省中医药研究院王卫峰研究员鉴定为真品。
1.3 试剂
山奈酚对照品(中国食品药品检定研究院,批号:110861-200304);乙腈(色谱纯,美国Tedia公司);其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 水提取工艺
称取干燥槐角50 g,按正交试验设计方案,依次加热回流水煎煮,滤过,合并滤液,加热浓缩至200 ml,得提取液,贮藏,备用。
2.2 山奈酚含量测定
2.2.1 色谱条件 色谱柱:BEH C18(50 mm×2.1 mm,1.7 μm);流动相:乙腈-0.2%磷酸溶液(23 ∶77,V/V);检测波长:370 nm;柱温:30 ℃;流速:0.3 ml/min;进样量:1.0 μl。在此条件下山奈酚与其他组分可达到基线分离,理论板数按山奈酚计应不低于4 000。
2.2.2 对照品溶液的制备 精密称取山奈酚对照品适量,加甲醇制成每1 ml含0.441 1 mg的对照品溶液,摇匀,即得对照品溶液。
2.2.3 供试品溶液的制备 精密移取“2.1”项下提取液10 ml,置于100 ml具塞锥形瓶中,加入10 ml甲醇和1 ml 25%盐酸,于90 ℃水浴中受热水解1 h,取出迅速冷却,转移至25 ml量瓶中,用甲醇定容,摇匀,滤过,滤液再用0.22 μm微孔滤膜滤过,即得供试品溶液。
2.2.4 标准曲线的制备 精密吸取“2.2.2”项下对照品溶液0.2、0.4、0.8、1.2、1.6、2.0 μl,按“2.2.1”项下色谱条件进样测定,记录色谱图。以进样量(x,μg)为横坐标,峰面积积分值为纵坐标(y),进行线性回归,得回归方程为y=14 000 000x+6 012.2(r=0.999 8)。结果表明,山奈酚进样量在0.088 22~0.882 2 μg范围内与峰面积积分值呈良好线性关系。
2.3 单因素试验优选盐酸加入量
由于山奈酚主要与糖结合成苷而存在,所以需要用酸去水解而得到需要测定的山奈酚苷。笔者参考文献[9-15],在90 ℃下,分别加入0.5、1.0、2.0、3.0、4.0、5.0 ml 25%盐酸,测定山奈酚含量,选择最优加入量。结果表明,加入1.0 ml 25%盐酸水解后测定的山奈酚含量最高。25%盐酸加入量对山奈酚含量的影响见表1。
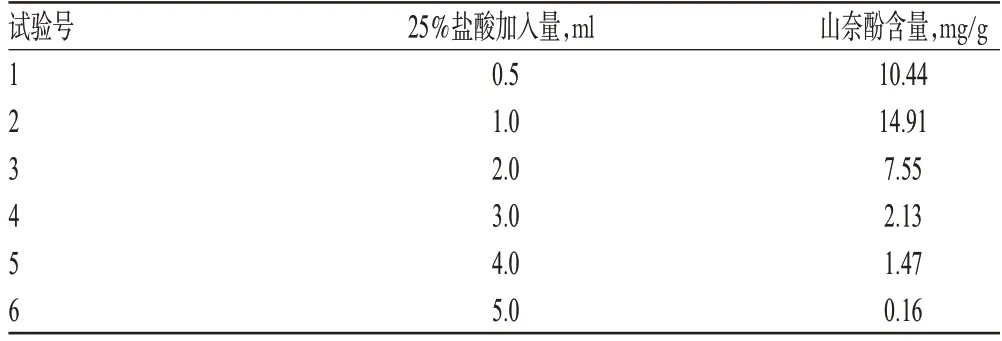
表1 25%盐酸加入量对山奈酚含量的影响Tab 1 Effect of adding amount of 25%hydrochloric acid on content of kaempferol
2.4 正交试验优选水提取工艺
以加水量(A)、提取时间(B)、提取次数(C)为考察因素,每个因素各选3个水平,以山奈酚含量为评价指标,采用L9(34)正交试验表安排试验。因素水平见表2;正交试验结果见表3;方差分析结果见表4。

表2 因素与水平Tab 2 Factors and levels
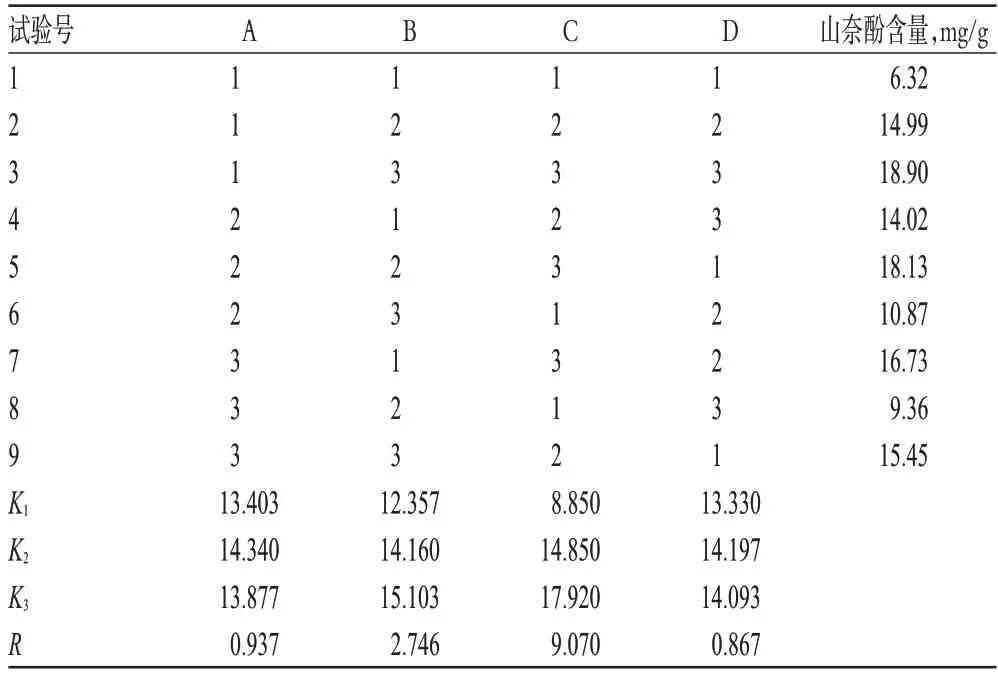
表3 正交试验结果Tab 3 Results of orthogonal test
由表3、表4可知,C因素即提取次数是主要影响因素,3个因素影响强弱顺序为C>B>A,即提取次数>提取时间>加水量;优选出的条件为A2B3C3,即12倍量水煎煮3次,每次2 h。
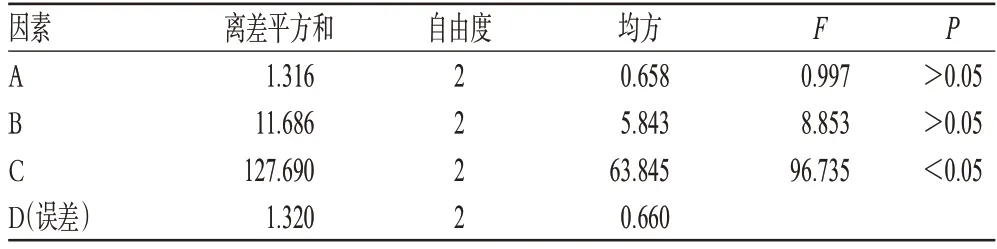
表4 方差分析结果Tab 4 Results of analysis of variance
2.5 工艺验证试验
称取槐角药材150 g,共3份,按照最优工艺参数进行验证试验,测定山奈酚含量。结果,每1 g槐角药材中含山奈酚分别为19.07、19.16、18.99 mg,RSD=0.45%。3次验证试验结果表明,优选出来的提取工艺稳定、重现性好,能适合于大工业生产。
3 讨论
槐角中山奈酚大多与糖结合成苷(如山奈酚-3-鼠李糖双葡萄糖苷、山奈酚-3,7-双葡萄糖苷)而存在,本试验采用酸水解后,测定指标中的山奈酚含量为游离山奈酚及其苷水解后的山奈酚的总和。25%盐酸加入量过多,也会对色谱柱有污染,因此应先用单因素优选出盐酸用量。
由于山奈酚具有亲脂性,易溶于热乙醇、乙醚,微溶于水,在预试验中还考察了在相同条件下水提取、60%乙醇提取和95%乙醇提取的效果。结果表明,60%乙醇提取的山奈酚含量略高于水提取工艺,考虑到大生产的成本,选择水提取更经济、实用。
本试验用超高液相色谱仪测定山奈酚含量,分析时间短、重复性好、准确简便,可在几分钟内完成分析,大大节约了分析时间,提高了检测效率。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:334.
[2]王志玲,勾凌燕,刘景东,等.槐角不同部位中主要黄酮苷元成分的比较[J].时珍国医国药,2012,23(3):594.
[3]雷晓晴,何珺,何军,等.槐角提取物中山奈素纯化工艺研究[J].中药材,2011,34(9):1 446.
[4]范卓文,张娜,于海龙,等.钱草硝石颗粒提取工艺研究[J].中医药信息,2011,28(5):40.
[5]刘松山,谈静,宋英,等.正交设计优化四生颗粒的醇提工艺[J].中国实验方剂学杂志,2013,19(17):25.
[6]何军,雷晓青,何珺,等.HPLC法同时测定槐角中4种黄酮苷元组分[J].安徽大学学报,2012,36(4):84.
[7]李春花,刘雪丽,郑文丽,等.正交试验优选黄蜀葵花中总黄酮的提取工艺[J].中国药房,2013,24(27):17.
[8]刘计权,谢树莲,尹晓琴,等.正交试验法优选犬问荆山奈素提取中水解条件的研究[J].山西中医学院学报,2011,12(4):17.
[9]曹明成.百蕊草提取工艺研究[J].现代中药研究与实践,2004,18(1):57.
[10]冉晓燕,胡德禹,薛伟.槐角中总黄酮的提取工艺研究[J].贵州教育学院学报,2009,20(6):22.
[11]光琴,周亚球.HPLC测定罗布麻叶中总黄酮的含量[J].中国实验方剂学杂志,2011,17(6):103.
[12]张媛,王晓杨,张志琴.HPLC同时测定桑葚口服液中槲皮素和山奈酚的含量[J].江西中医学院学报,2013,25(1):46.
[13]张秀娟,蒋琳兰.高效液相色谱法测定复方银茶方银杏黄酮苷含量[J].医药导报,2009,28(2):249.
[14]艾国民,王克让,刘宏民,等.高效液相色谱法测定马桑叶中总黄酮含量[J].郑州大学学报,2006,38(1):70.
[15]严蕾,石晓昵,孙莲.液相色谱法测定植物样品中槲皮素和山奈酚[J].中国卫生检验杂志,2008,18(6):1056.

