食品过敏原澳洲坚果环介导等温扩增检测方法的建立与应用
刘 津,张 隽,李 婷,张 璜,高东微,李志勇,*
(1.广东检验检疫技术中心,广东 广州 510623;2.广州迪澳生物科技有限公司,广东 广州 510663)
食品过敏原澳洲坚果环介导等温扩增检测方法的建立与应用
刘 津1,张 隽1,李 婷1,张 璜2,高东微1,李志勇1,*
(1.广东检验检疫技术中心,广东 广州 510623;2.广州迪澳生物科技有限公司,广东 广州 510663)
根据澳洲坚果豌豆蛋白AMP2基因序列,利用设计软件Primer Explorer Version 4设计并筛选了食品过敏原澳洲坚果的环介导等温扩增引物,对反应体系和反应条件进行优化,建立澳洲坚果的环介导等温扩增检测方法,结果判断可采用实时荧光法和荧光染料终点显色法。对该方法进行了特异性、灵敏度、稳定性评价,结果显示:该方法能够特异性、灵敏、稳定地检测食品中的澳洲坚果成分,检测低限为0.5%。此外,对7 种市售食品样品的检测结果表明,该方法与食品标签标示的过敏原成分结果吻合率为100%,假阳性率和假阴性率均为0,在市售食品的过敏原成分检测上较商业化快速检测试纸条更加稳定可靠。
食品过敏原;澳洲坚果;环介导等温扩增;检测方法
澳洲坚果(Macadamia ternifolia),又名夏威夷果、澳洲胡桃、昆士兰栗,为山龙眼科澳洲坚果属植物。澳洲坚果果仁,呈奶白色,营养丰富,除了用于制作干果外,还可制作糕点、巧克力等[1-2]。澳洲坚果引起的过敏症状包括嘴唇、眼睛、喉咙充血红肿、荨麻疹、结膜炎和呼吸困难等[3],是食品过敏原标识管理的重要种类。国际食品法典委员会制定的国际标准CODEX STAN 1-1985《预包装食品标签通则》明确规定了澳洲坚果及其产品必须在预包装食品标签上予以标识[4]。在国际标准的基础上,世界各国纷纷颁布了各自的法规标准,对澳洲坚果这种过敏原成分的标识管理进行了详细的规定[5-6]。我国在各级食品标准中也做出了相关规定,例如GB 7718—2011《预包装食品标签通则》、GB/T 23779—2009《预包装食品中的致敏原成分》等均对此有明确的规定[7-8]。
食品过敏原标识管理的有效实施,依赖于完善的监控技术手段。其中,食品过敏原检测技术是必不可少的一个组成部分。特别是进出口食品检验方面,我国主要贸易国家对过敏原标识管理的日趋严格,对检测技术提出了迫切的现实需求。但是,目前为止国内外尚未发布澳洲坚果过敏原成分的标准检测方法,澳洲坚果过敏原检测技术研究的文献也鲜有报道,国外对澳洲坚果的检测通常采用一种商业化过敏原蛋白质免疫层析快速检测技术,国内对澳洲坚果尚未建立任何达到行业应用水平的通用方法。这种现状已经严重影响了过敏原标识管理相关法规标准的科学有效实施。因此,在预包装食品过敏原检验技术领域,目前急需制定更加普适、简便、准确、成本低廉的澳洲坚果过敏原检测方法,使之适用于食品企业品质安全检验和进出口食品实验室检验。
目前食品过敏原检测的方法主要分为两大类,一类是基于蛋白质检测的方法,一类是基于基因检测的方法。然而,现有研究结果表明食品过敏原中能够引起过敏反应的蛋白质组成复杂,澳洲坚果中存在的过敏原蛋白质组成尚未完全调查清楚,因此以某种过敏原蛋白质为检测目标物质建立的蛋白质检测技术得到的检测结果存在与实际致敏效应发生偏差的可能性;基于免疫学原理的蛋白质检测技术对检测样品提取物的背景干扰具有较高的要求,与此同时由于预包装食品种类、配料成分、加工工艺千差万别造成背景干扰非常复杂,极大局限了澳洲坚果过敏原蛋白质免疫检测方法的实际应用效果[9]。此外,相对于核酸而言,澳洲坚果过敏原蛋白质容易在食品加工过程中发生变性,对基于免疫学原理的蛋白质检测技术造成不可忽略的性能下降。相比之下,基于基因检测的方法以食品过敏原的特异性基因片段为检测对象,通过食品中是否存在过敏原所属物种的保守基因片段判断是否含有某种特定的过敏原成分。由于核酸的稳定程度比蛋白质高,在食品加工过程中不易被破坏,因此这类技术可以更加稳定地检测出微量的过敏原成分[10]。
现有常用的基因检测方法包括聚合酶链式反应(polymerase chain reaction,PCR)和环介导等温扩增法(loop-mediated isothermal amplification,LAMP),但是PCR技术需要使用大型的仪器设备、耗时长、对技术要求高、成本昂贵,并不适用于基层实验室的推广应用。环介导等温扩增法是2000年由Notomi等发明的一种恒温核酸扩增方法[11]。LAMP技术发展至今,既可采用荧光染料终点显色法,利用SYBR GREEN Ⅰ等荧光染料可嵌合到扩增产物中,发生显著的颜色变化,可用肉眼进行颜色判断;又可采用实时荧光LAMP法,通过使用高精度的实时荧光仪对LAMP反应的过程进行实时监控[12-14]。目前,LAMP技术已经在食品安全、公共卫生安全监测和应急检测、临床医学诊断、生物安全、生物识别等专业技术领域获得了广泛的应用[15-18]。本实验以澳洲坚果AMP2豌豆球蛋白基因为目的基因,建立能够特异、灵敏、稳定地检测食品中的澳洲坚果成分的LAMP检测方法,并且能够同时用实时荧光法和荧光染料终点显色法进行判断,既能应用于大中型实验室,又能应用于基层快速大规模筛查。
1 材料与方法
1.1 样品种类及来源
澳洲坚果(Macadamia ternifolia)、巴西坚果(Bertholletia excelsa)、开心果(Pistacia vera)、核桃(Juglans regia)、碧根果(Carya illinoensis (Wangh.) koch)、腰果(Anacardium occidentalie)、松籽(Pinus koraiensis)、榛子(Corylus avellana)、美国大杏仁(Amygdalus communis)、葵花籽(Helianthus annuus)、板栗(Castanea mollissima)、苦杏仁(Semen Armeniacae Amarum)、南瓜籽(Cucurbita moschata)、莲子(Semen Nelumbinis)和大米(Oryza sativa) 市购。
1.2 试剂与仪器
Promega Wizard®基因组DNA纯化试剂盒 北京盈田卓越科技有限公司;Ex Taq和dNTPs购自宝生物工程(大连)有限公司;甜菜碱、Bst DNA聚合酶和10× ThermoPol缓冲液 德国Sigma公司;1 000× SYBR GreenⅠ 厦门致善生物科技有限公司;SYTO-9 美国Invitrogen公司;LAMP引物由上海生工生物工程有限公司合成;r-biopharm®澳洲坚果快速检测试纸条(BL 605) 拜发分析系统销售(北京)有限公司。
1000核酸蛋白分析仪 美国Nanodrop科技有限公司;ABI 7500实时荧光定量PCR仪 美国应用生物系统公司;恒温金属浴 杭州奥盛仪器有限公司;GelDoc XR+凝胶成像系统 美国伯乐生命医学产品有限公司。
1.3 方法
1.3.1 DNA模板的提取和纯化
根据GB/T 19495.3—2004《转基因产品检测:核酸提取纯化方法》规定[19],采用标准方法从供试材料中提取植物基因组DNA,用核酸蛋白分析仪测定DNA的浓度和纯度,将DNA溶液稀释至100 ng/μL,-20 ℃保存备用。对提取出的植物基因组DNA用植物通用引物Plant 159进行检测[20],检测结果阳性表明提取出适宜进行扩增的DNA,否则应重新进行DNA提取和纯化。
1.3.2 引物的设计与筛选
根据GenBank数据库中澳洲坚果AMP2豌豆球蛋白基因(Macadamia integrifolia vicilin precursor (AMP2),Accession no. AF161883.1)序列,通过BLAST在线比对软件进行分析,在澳洲坚果序列的种特异性区域,利用LAMP引物在线设计软件Primer Explorer Version 4分别设计包括两条外引物F3、B3、两条内引物FIP、BIP的LAMP引物各3 套,由上海生工生物工程有限公司合成。根据引物的扩增效果选取最佳的引物后,使用Primer Explorer Version 4设计环引物。在LAMP反应的循环延伸阶段,所有的茎环DNA与内引物或环引物结合,引导链置换延伸反应,可加快反应速度,缩短近一半的反应时间,提高检测效率。
1.3.3 LAMP反应体系的建立
根据文献[11],初步确定25 μL的LAMP反应体系:内引物FIP和BIP各1.6 μmol/L,外引物F3和B3各0.2 μmol/L,环引物LF和LB各0.8 μmol/L,1×ThermoPol缓冲液,1mol/L甜菜碱,6 mmol/L MgSO4,1.6 mmol/L dNTP,0.32 U/μL Bst DNA聚合酶,DNA模板200 ng。将LAMP反应体系配制完成后置于0.2 mL离心管中,在离心管中加入1 滴石蜡油以避免反应体系挥发和污染。
LAMP反应可采用两种结果判读方法,一是荧光染料显色法,二是实时荧光法。
荧光染料显色法是在上述管盖内壁加入1 μL 1 000×SYBR GreenⅠ。盖管盖时应小心,防止显色液混合进入反应液中。然后将其置于金属浴在63 ℃恒温反应90 min,最后80 ℃灭活5 min结束反应。反应结束后,将离心管上下颠倒混匀或离心,使盖内壁的SYBR GreenⅠ与反应液混合,观察离心管中反应液颜色。如发生特异性扩增,溶液变为绿色,否则保持SYBR GreenⅠ橙色不变。
实时荧光法是在反应体系中加入0.2 ømol/L SYTO-9,通过实时荧光PCR仪设定Holding Stage为63℃、30 s,1 个循环;Cycling Stage为63 ℃、15 s,63 ℃、45 s,90个循环,于63℃、45 s处收集荧光信号,荧光通道为FAM。
1.3.4 LAMP引物的筛选
用澳洲坚果DNA作为模板,用大米DNA作为阴性对照,每组对照分别设置2 个平行,通过实时荧光法检测LAMP反应。通过观察实时荧光的扩增曲线,根据起始扩增时间、扩增曲线的重复性等指标对引物进行筛选。
1.3.5 LAMP反应体系和反应条件的优化
根据文献[11]报道,反应温度、反应时间、镁离子浓度、甜菜碱浓度和dNTPs浓度是影响LAMP扩增效果的重要因素。由于Bst DNA聚合酶最适温度在61~65 ℃,本实验选取61、62、63、64 ℃和65 ℃ 5个温度条件进行LAMP反应,通过实时荧光法检测LAMP反应,选取适宜的温度。在适宜的温度条件下,依次对Mg2+、甜菜碱和dNTPs浓度和反应时间进行优化,其中Mg2+选取2、4、6、8、10 mmol/L 5 个浓度梯度,甜菜碱选取0.4、0.6、0.8、1.0、1.2 mol/L 5 个浓度梯度,dNTPs选取0.8、1.2、 1.6、2.0、2.4 mmol/L 5 个浓度梯度。通过实时荧光法检测LAMP反应,确定最佳反应体系和反应条件。
1.3.6 特异性实验
高度特异性是过敏原检测方法必须具备的基本特性,为此利用建立的LAMP方法对澳洲坚果、腰果、花生、巴西坚果、碧根果、杏仁、开心果、葵瓜子、板栗、榛子、核桃、南杏、北杏、松子、南瓜子、西瓜子、莲子共17 种常见的坚果进行LAMP扩增,同时采用显色法和实时荧光法进行检测。
1.3.7 灵敏度实验
为确定本方法的相对灵敏度,用100 ng/μL的大米DNA为基质,用100 ng/μL的澳洲坚果DNA按照体积比制成不同梯度浓度(0%、0.05%、0.1%、0.5%、1%、5%、10%)的澳洲坚果模拟样品DNA,用不同浓度梯度的模拟样品DNA进行LAMP扩增,每个梯度浓度设置2 个平行,用实时荧光法和显色法同时进行灵敏度测试。
1.3.8 稳定性实验
为评估本方法的稳定性,对0.5%、1%、5%的澳洲坚果模拟样品DNA进行LAMP扩增,每个浓度分别采用实时荧光法和显色法重复10 次,同时以0%的澳洲坚果模拟样品DNA作为阴性对照,用以测试本方法的稳定性。
1.3.9 适用性实验
利用建立的LAMP方法对共计7 份进口商品和市售商品进行检测,同时采用商业化快速检测试纸条进行检测,两种方法进行对比。
2 结果与分析
2.1 LAMP引物筛选
本研究针对澳洲坚果AMP2豌豆球蛋白基因设计了3 套LAMP检测引物,通过LAMP反应实时荧光法结果显示,第1套引物出现对数扩增时间分别为70 min和80 min,第2套引物出现对数扩增时间约为35 min,两个平行重复性较好,3 套引物出现对数扩增时间约为40 min。因此,选取第2套引物进行下一步的实验,为了增加扩增效率,引入环引物一对,最佳引物序列见表1。
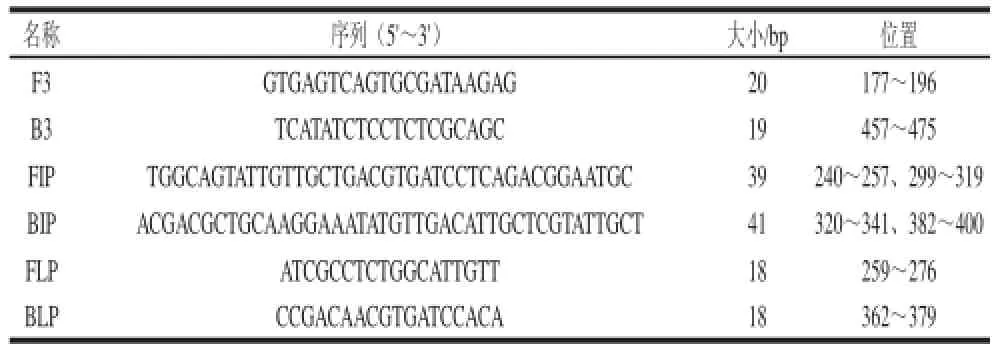
表1 澳洲坚果LAMP扩增引物序列Table 1 The primers for LAMP assay of macadamia nut
2.2 LAMP反应体系和反应条件的优化
2.2.1 反应温度的优化
以澳洲坚果DNA为模板,利用设计的引物在不同温度条件进行LAMP反应,实时荧光法检测LAMP反应的结果见图1。由图1可知,当反应温度为63 ℃时出现指数扩增的时间最早,因此选取63 ℃为最佳反应温度。

图1 不同反应温度澳洲坚果LAMP检测结果图(实时荧光法)Fig.1 RT-LAMP detection of macadamia nut at different reaction temperatures
2.2.2 反应体系的优化
以澳洲坚果DNA为模板,在反应温度为63 ℃的条件下,依次对Mg2+、甜菜碱和dNTPs浓度进行优化,结果见图2~4。

图2 不同镁离子浓度澳洲坚果LAMP检测结果图(实时荧光法)Fig.2 RT-LAMP detection of macadamia nut with different Mg2+concentrations

图3 不同甜菜碱浓度澳洲坚果LAMP检测结果图(实时荧光法)Fig.3 RT-LAMP detection of macadamia nut with different betaine concentrations
选取最早出现指数扩增曲线的反应体系浓度为最佳浓度,由图2~4可知,在25 μL反应体系中,当Mg2+浓度为6 mmol/L、甜菜碱浓度为0.8 mol/L、dNTPs浓度为1.6 mmol/L,在63 ℃反应45 min,LAMP反应扩增效果最好。
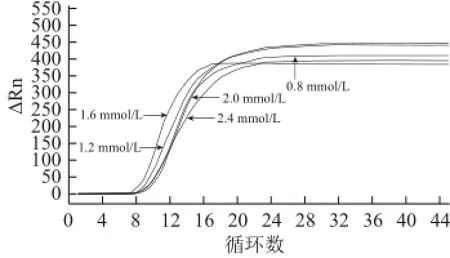
图4 不同dNTPs浓度澳洲坚果LAMP检测结果图(实时荧光法)Fig.4 RT-LAMP detection of macadamia nut with different concentrations of dNTPs
2.3 特异性实验
利用建立的LAMP方法对澳洲坚果及其他16 种坚果进行特异性扩增。实时荧光法和显色法的实验结果分别见图5和图6。
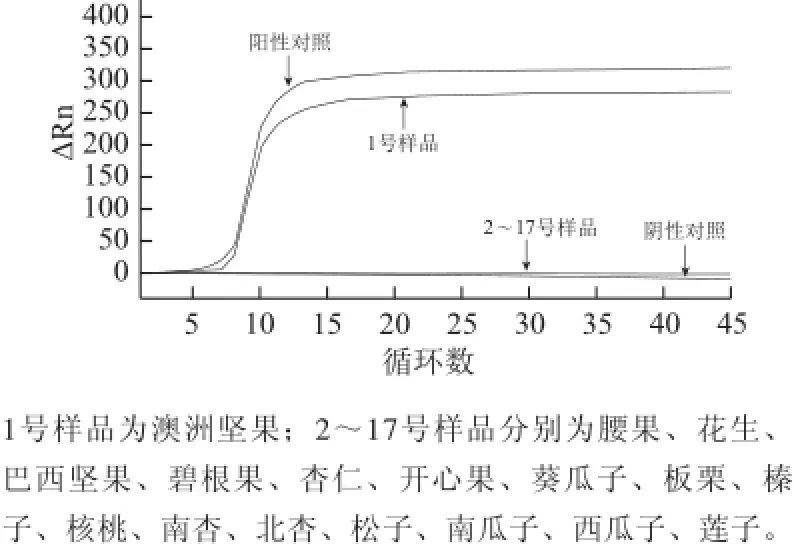
图5 澳洲坚果LAMP检测方法特异性实验结果(实时荧光法)Fig.5 Specificity of the RT-LAMP assay for macadamia nut
图6 澳洲坚果LAMP检测方法特异性实验结果(荧光染料显色法)Fig.6 Specificity of the LAMP assay using fluorescent dye for macadamia nut
由图5可知,澳洲坚果LAMP检测实时荧光法仅澳洲坚果出现特异性扩增,其他坚果均未出现扩增;澳洲坚果LAMP检测荧光染料显色法仅以澳洲坚果DNA为模板的反应管,在反应结束后加入SYBR Green Ⅰ荧光染料显色为绿色,以其他坚果DNA为模板的反应管均显示为黄色,且2 个平行管中的反应无差异。结果表明,本实验建立的LAMP方法对澳洲坚果具有高度的特异性。
2.4 灵敏度实验
实时荧光法和荧光染料显色法的实验结果分别见图7和图8,可知LAMP实时荧光法和荧光染料显色法均可检出100%、10%、5%、1%、0.5%的澳洲坚果阳性样品,不能检出0.1%和0.05%的阳性样品。LAMP实时荧光法的检测结果显示巴西坚果浓度越高,开始出现指数扩增的时间越短,Ct值越小。灵敏度实验结果表明,本标准检测方法对澳洲坚果的最低检测限可达0.5%。
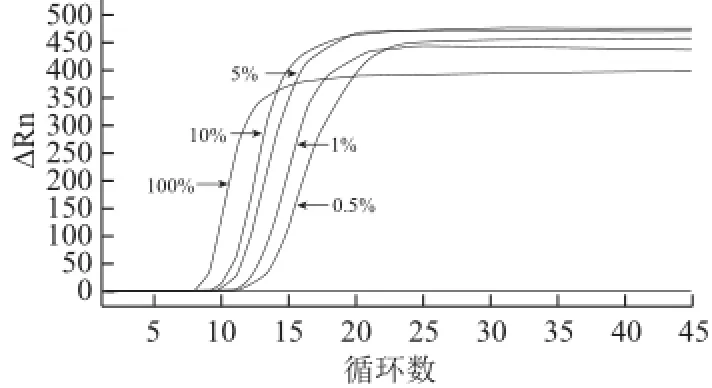
图7 澳洲坚果LAMP检测方法灵敏度实验结果(实时荧光法)Fig.7 Sensitivity of the RT-LAMP assay for macadamia nut

图8 澳洲坚果LAMP检测方法灵敏度实验结果(显色法)Fig.8 Sensitivity of the LAMP assay using fluorescent dye for macadamia nut detection method
2.5 稳定性实验
表2显示:澳洲坚果LAMP检测方法对0%、0.5%、1%和5%的澳洲坚果样品进行10 次重复检测,在不同浓度和各次重复中均能得到准确稳定的检测结果,假阳性率和假阴性率均为0,表明本方法具有良好的稳定性和重复性。注:+.阳性;—.阴性。
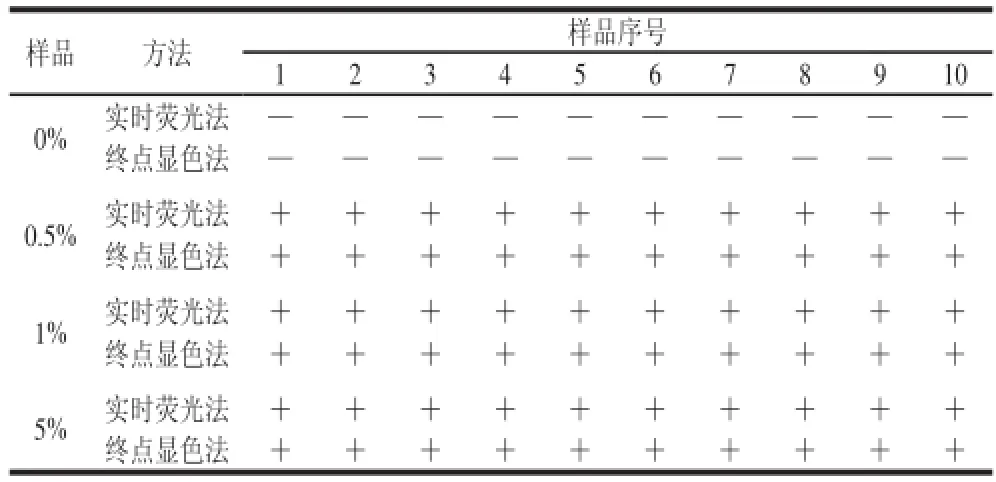
表2 澳洲坚果LAMP检测方法稳定性实验结果Table 2 Stability of the LAMP assay for macadamia nut
2.6 适用性实验
实际样品的检测结果见表3、图9~11。

表3 澳洲坚果LAMP检测方法适用性实验结果Table 3 Applicability of the LAMP assay for macadamia nut
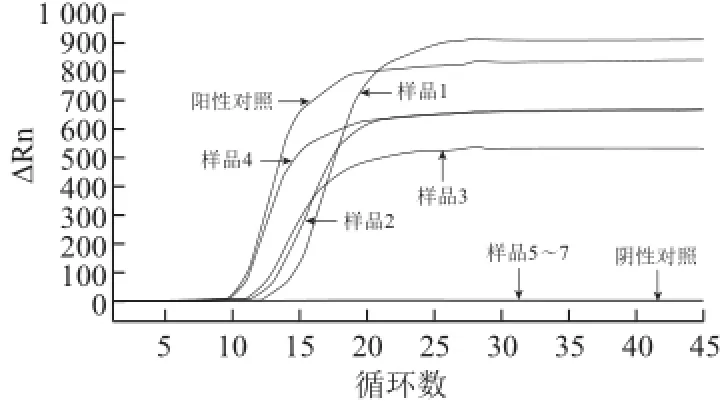
图9 澳洲坚果LAMP检测方法适用性实验结果(实时荧光法)Fig.9 Applicability of the RT-LAMP assay for macadamia nut
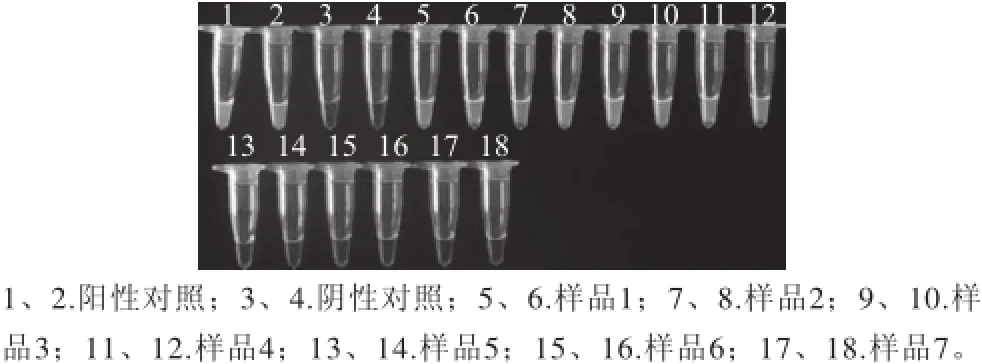
图10 澳洲坚果LAMP检测方法适用性实验结果(显色法)Fig.10 Applicability of the LAMP assay using fluorescent dye for macadamia nut

图11 澳洲坚果快速检测试纸条适用性实验结果Fig.11 Applicability of rapid test strips for macadamia nut
澳洲坚果LAMP检测实时荧光法和荧光染料显色法的检测结果与配料表中所标识的澳洲坚果是否存在的实际情况完全一致,假阳性率和假阴性率均为0。快速检测试纸条在检测样品1和2时均出现了弱阳性,检测结果较难判断。相比而言,本实验建立的澳洲坚果LAMP检测方法在检测样品1和2时,实时荧光法显示样品1和2出现了指数扩增,荧光染料显色法显示样品1和2均为阳性,且2个平行管结果一致,阳性结果易于判断。
适用性实验结果表明,本实验建立的澳洲坚果LAMP检测方法可用于预包装食品中澳洲坚果的检测,在检测市售食品样品时,特别是食品中含有低浓度澳洲坚果成分时,性能较商业化快速检测试纸条更佳。
3 讨 论
本实验建立的澳洲坚果LAMP检测方法该方法能够特异、灵敏、稳定地检测食品中的澳洲坚果成分,检测低限为0.5%,可采用实时荧光法和荧光染料终点显色法两种方法进行检测。实时荧光法的优点在于可通过使用高精度的实时荧光仪对LAMP反应的过程进行实时监控,尤其是在方法建立时优势突出,例如在引物筛选、反应条件和反应体系优化时,可以通过扩增曲线直观的分辨出指数扩增出现的时间迟早和效率高低,从而进行引物筛选和反应优化,大大提高了LAMP技术的灵敏性和准确性;实时荧光法的缺点在于需要使用大型的仪器设备,对实验室硬件配置要求较高。荧光染料终点显色法的特点在于利用SYBR GREEN Ⅰ等荧光染料可嵌合到扩增产物中,发生显著的颜色变化,突出的优点是通过反应终点的颜色变化进行结果判断,无需使用大型的仪器设备,可在基层实验室推广使用,也可用于现场检测;缺点是高浓度的荧光染料对LAMP反应具有抑制作用,因此扩增-检测需要分步进行,实验操作上与实时荧光法相比需要额外在扩增反应结束时加入荧光染料,稍显不便。本实验建立的澳洲LAMP检测方法可采用上述两种方法进行检测,两种方法互为补充,可有效地对食品中澳洲坚果过敏原成分进行检测和监控,能够极大的满足业务需要。
经文献调研,国内外均未发布澳洲坚果过敏原成分的标准检测方法,关于澳洲坚果过敏原成分检测技术也鲜有报道,国外对澳洲坚果的检测通常采用一种商业化过敏原蛋白质免疫层析检测试纸条,因此,在适用性实验部分将本实验建立的澳洲坚果LAMP检测方法与该方法进行了性能比较,结果显示本实验建立的方法性能较佳。原因可能有3 个方面:第1,由于食品样品中澳洲坚果含量低且分布不均匀影响了检测结果;第2,检测对象不同影响实验结果,LAMP技术的检测对象是核酸,而蛋白质免疫层析检测试纸条的检测对象为蛋白质,由于在加工过程中澳洲坚果核酸的稳定程度比蛋白质高,因此本实验建立的方法可以更加稳定的检测出微量的过敏原成分;第3,商业化过敏原蛋白质免疫层析检测试纸条对检测样品提取物的背景干扰具有较高的要求,由于食品类别、配料、加工工艺不同造成背景干扰非常复杂,对免疫检测方法的检测效果造成了负面影响。此外,澳洲坚果免疫层析检测试纸条为国外商业化试剂产品,价格昂贵,且订货期长,相比而言,本实验建立的澳洲坚果LAMP检测方法只需合成引物和配制试剂即可建立检测方法,检测试剂成本低廉,且无需昂贵的仪器设备,更加适合基层实验室推广应用。
[1] 刘建福, 黄莉. 澳洲坚果的营养价值及其开发利用[J]. 中国食物与营养, 2005(2): 25-26.
[2] 杜丽清, 邹明宏, 曾辉, 等. 澳洲坚果果仁营养成分分析[J]. 营养学报, 2010, 32(1): 95-96.
[3] de KNOP K J, HAGENDORENS M M, BRIDTS C H, et al. Macadamia nut allergy: 2 case reports and a review of the literature[J]. Acta Clinica Belgica, 2010, 65(2): 129-132.
[4] Codex Almentarius Commission. CODEX STAN 1-1985 General standard for the labelling of prepackaged foods[S].
[5] The commission of the European Communities. Commission directive 2007/68/EC of 27 November 2007 amending annex IIIa to directive 2000/13/EC of the European parliament and of the council as regards certain food ingredients[S].
[6] U.S. the Food and Drug Administration. Public law 108-282 the food allergen labeling and consumer protection act[S].
[7] 卫生部. GB 7718—2011 预包装食品标签通则[S]. 北京: 中国标准出版社, 2011.
[8] 国家质量监督检验检疫总局. GB/T 23779—2009 预包装食品中的致敏原成分[S]. 北京: 中国标准出版社, 2009.
[9] KENNETH H R, SUZANNE S T, SHRIDHAR K S. Tree nut allergen[J]. Int Arch Allergy Immunol, 2003, 131(4): 234-244.
[10] 刘中勇, 高东微. 预包装食品致敏原标识、检测和生产控制指南[M].北京: 中国标准出版社, 2011: 103-111; 118-126.
[11] TOMITA N, MORI Y, KANDA H, et al. Loop-mediated isothermal amplification (LAMP)of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877-882.
[12] MORI Y, KITAO M, TOMITA N. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. Journal of Biochemical and Biophysical Methods, 2004, 59: 145-157.
[13] HILL J, BERIWAL S, CHANDRA I, et al. Loop-mediated isothermal amplification assay for rapid detection of common strains of Escherichia coli[J]. Journal of Clinical Microbiology, 2008, 46(8): 2800-2804.
[14] LIU Dayu, LIANG Guangtie, ZHANG Qiong. Detection of mycobacterium tuberculosis using a capillary-array microsystem with integrated DNA extraction, loop-mediated isothermal amplification, and and fluorescence detection[J]. Analytical Chemistry, 2013, 85(9): 4698-4704.
[15] GOTO M, HONDA E, OGURA A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. Biotechniques, 2009, 46(3): 167-172.
[16] NJIRU Z K, YEBOAH-MANU D, STINEAR T P, et al. Rapid and sensitive detection of Mycobacterium ulcerans by use of a loop-mediated isothermal amplification test[J]. Journal of Clinical Microbiology, 2012, 50(5): 1737-1741.
[17] BÜHLMANN A, POTHIER J F, REZZONICO F, et al. Loop-mediated isothermal amplification (LAMP) assay for rapid pathogen detection and on-site diagnosis of fire blight[J]. Journal of Microbiological Methods, 2013, 92(3): 332-339.
[18] MAHONY J, CHONG S, BULIR D, et al. Development of a sensitive loop-mediated isothermal amplification assay that provides specimen-toresult diagnosis of respiratory syncytial virus infection in 30 minutes[J]. Journal of Clinical Microbiology, 2013, 51(8): 2696-2701.
[19] 国家质量监督检验检疫总局. GB/T 19495.3—2004 转基因产品检测: 核酸定性PCR检测方法[S]. 北京: 中国标准出版社, 2007.
[20] HAN Jianxun, WU Yajun, HUANG Wensheng, et al. PCR and DHPLC methods used to detect juice ingredient from 7 fruits[J]. Food Control, 2012, 25(2): 696-703.
Construction and Application of Loop-Mediated Isothermal Amplification Method for Detection of Macadamia Nut as a Food Allergen
LIU Jin1, ZHANG Jun1, LI Ting1, ZHANG Huang2, GAO Dong-wei1, LI Zhi-yong1,*
(1. Guangdong Inspection and Quarantine Technology Center, Guangzhou 510623, China; 2. Guangzhou Di Ao Bio-Technology Co. Ltd., Guangzhou 510663, China)
According to the Macadamia integrifolia vicilin precursor AMP2 gene sequences, sets of loop-mediated isothermal amplification (LAMP) primers were designed and screened using the design software Primer Explorer Version 4, then the relevant LAMP method was established for the detection of macadamia nuts as a food allergen by measuring the results using real-time fluorescence or using a fluorescent dye in the reaction end. An evaluation of this method indicated the satisfied specificity, sensitivity and stability in the identification of macadamia nuts from foods with a LOD of 0.5%. In addition, the detection of 7 marketed food samples using this method showed 100% consistency with the labeled information of allergen ingredients with zero false positive and negative rates, and thus, proved its better performances than commercial rapid test strips.
food allergen; macadamia nut; loop-mediated isothermal amplification (LAMP); detection method
TS255.6
A
1002-6630(2014)22-0226-07
10.7506/spkx1002-6630-201422044
2013-11-17
出入境检验检疫行业标准制定计划项目(2012B141)
刘津(1983—),女,工程师,硕士,研究方向为食品分子生物学检测。E-mail:ivfhonline@126.com
*通信作者:李志勇(1972—),男,研究员,博士,研究方向为食品安全和检测。E-mail:lizy@iqtc.cn

