响应面优化超声波提取桑叶槲皮素工艺
王海燕,李 睿,曾 秀,*,黄 勇,王介平,周 婵,吕金凤
(1.重庆市畜牧科学院,重庆 402460;2.重庆市绿之歌农业科技开发有限公司,重庆 401120)
响应面优化超声波提取桑叶槲皮素工艺
王海燕1,李 睿2,曾 秀1,*,黄 勇1,王介平1,周 婵1,吕金凤1
(1.重庆市畜牧科学院,重庆 402460;2.重庆市绿之歌农业科技开发有限公司,重庆 401120)
为优化超声波辅助提取桑叶槲皮素工艺,以桑叶槲皮素提取量为指标,通过单因素试验,探讨液料比、乙醇体积分数、超声时间、超声功率及超声温度等对槲皮素提取量的影响,利用响应面法对影响槲皮素提取量的4 个主要因素进行优化,分别为乙醇体积分数、液料比、超声功率、超声温度。结果表明,最佳提取工艺条件为乙醇体积分数51%、液料比26∶1(mL/g)、超声功率200 W、超声温度70 ℃,在此条件下,做3 次平行实验进行验证,桑叶槲皮素提取量为11.13 mg/g,与模型预测值11.31 mg/g基本相符。模型可较好地预测桑叶槲皮素的提取量,响应面法对桑叶槲皮素提取条件参数优化具有可行性。
超声波辅助提取;桑叶;槲皮素;响应面法
桑叶是蔷薇目桑科桑属桑种植物的叶[1],味苦、甘,性寒,不仅可用于养蚕,还可作为中药入药,在《神农本草》、《本草纲目》及《中国人民共和国药典》均有详细记载,被卫生部认定为药食两用植物[2]。桑叶中含有多种黄酮类物质,包括芸香苷、桑苷、槲皮素、异槲皮素、槲皮素-3-O-葡糖苷等[3]。槲皮素化学名为3,5,7,3’,4’-五羟基黄酮,属于黄酮醇类化合物,是桑叶中的重要活性物质。槲皮素具有抗氧化、抗菌消炎、抗血小板聚集、抗癌、抗心律失常、抗多药耐药、抗动脉粥样硬化、抗肿瘤等多种生物活性作用[4-12],是目前国内外研究的热点课题。我国是栽桑养蚕大国,拥有丰富的桑树资源,目前全国有桑园约1 197万 亩,而每年随着我国茧丝绸产业下滑,桑园利用率逐年下降,造成资源的极大浪费。桑叶中含有的丰富活性物质,可作为天然活性产物提取的植物来源。
目前,桑叶中槲皮素提取工艺文献报道较少,主要关于桑叶总黄酮的提取。章华伟等[13]采用响应面法优化浸提法提取桑叶黄酮,结果表明,最佳条件为乙醇体积分数71.75%、提取温度67.1 ℃、液料比23.2∶1(mL/g)、提取时间150 min,桑叶黄酮得率为2.37%。王芳等[14]对桑叶黄酮的提取研究结果表明:最佳提取溶剂是乙醇体积分数70%,在固液比1∶50(g/mL)、提取时间1.5 h、提取温度80 ℃的条件下,黄酮得率达3.50%。浸提法、加热法是桑叶黄酮物质传统的提取方法,具有操作简单的优点,但存在提取时间长、试剂消耗大、温度高、提取率低等问题[15-16]。近年来,随着新分离技术的发展,超声波提取法、微波提取法、超临界萃取法等新型分离技术逐渐应用于黄酮类物质的提取[17]。超声波提取法是利用声波产生的骚动效应、空话效应和热效应加速物质的扩散溶解,从而提高提取效率、缩短提取时间、节约能耗[17-19]。马金秋等[20]利用超声波辅助提取桑叶黄酮的最佳提取工艺为液料比20∶1(mL/g)、用80%的酒精溶液作溶剂、80℃超声提取40 min,结果桑叶总黄酮的提取量达到2.52%。贺伟强等[21]采用响应面法优化超声辅助提取桑叶总黄酮,最佳工艺条件为75%乙醇、液料比50∶1(mL/g)、超声温度64 ℃、超声时间45 min,桑叶总黄酮提取量理论值可达到4.29%。
响应面法是由Box等[22]于20世纪50年代提出的一种优化工艺条件的有效方法。它以最简单、高效的方式对试验进行全面地研究,通过对直观图形和回归方程分析,确定最佳优化条件。本实验通过响应面法优化超声波辅助提取桑叶槲皮素提取工艺,以期为桑叶中槲皮素的利用提供技术参考。
1 材料与方法
1.1 材料与试剂
桑叶由重庆市绿之歌农业科技开发有限公司提供,经鉴定为桑树的叶,经过干燥粉碎后过20 目筛。
槲皮素标准品(纯度99%) 中国食品药品检定研究院;无水乙醇、石油醚、甲醇、磷酸(均为分析纯) 成都市科龙化工试剂厂。
1.2 仪器与设备
101A-2型数显电热鼓风干燥箱 上海浦东荣丰科学仪器有限公司;JA2003A电子分析天平 上海精天电子仪器有限公司;KQ-250 DB型超声波清洗仪 昆山市超声仪器有限公司;5810型台式高速离心机 德国Eppendorf公司;LC-2010A高效液相色谱仪 日本岛津公司;RE52CS-1旋转蒸发器 上海亚荣生化仪器厂;HH-8数显恒温水浴锅 常州奥华仪器有限公司。
1.3 方法
1.3.1 桑叶槲皮素的提取
1.3.1.1 工艺流程
鲜桑叶→干燥、粉碎→过20 目筛→石油醚(60~90 ℃沸程)脱脂、脱色处理(具体方法见1.3.1.2节)→过滤→石油醚回收→滤渣干燥→超声波乙醇提取(具体方法见1.3.3节)→抽滤→减压浓缩→定容→桑叶槲皮素提取液
1.3.1.2 提取方法
称取过20 目筛后的干桑叶粉0.5 g,按1∶20(g/mL)加入石油醚,于50 ℃超声波回流提取2 次,每次20 min,弃去上清液。残渣于70 ℃烘箱中烘干。在桑叶残渣中,按照一定液料比加入乙醇溶液,超声波提取3 次,抽滤,合并滤液,真空减压浓缩,回收乙醇,定容至50 mL,获得桑叶槲皮素提取原液。
1.3.2 槲皮素检测方法
1.3.2.1 色谱条件
高效液相色谱(high performance liquid chromatography,HPLC)检测,色谱柱:Alltima C18(4.6 mm×250 mm,5 øm);流动相:甲醇-0.2%磷酸(75∶25,V/V);检测器紫外波长:360 nm;进样量:5 øL;流速:1.0 mL/min;柱温:25 ℃。
桑叶槲皮素提取原液稀释200 倍进样,吸取桑叶槲皮素提取原液0.1 mL定容至20 mL。桑叶槲皮素提取量计算公式如下。

式中:X为根据标准曲线计算的样液质量浓度/(mg/mL);V0为桑叶槲皮素提取液定容体积/mL;V1为桑叶槲皮素提取原液吸取体积/mL;V2为桑叶槲皮素稀释液定容体积/mL;m为桑叶样品质量/g。
1.3.2.2 标准曲线的绘制
精密称取槲皮素标准品5.3 mg,用体积分数70%甲醇定容于50 mL容量瓶中,分别吸取0、1.0、2.0、3.0、4.0、5.0、10.0 mL于10 mL容量瓶,用70%甲醇定容至刻度,其质量浓度分别是 0、0.010 6、0.021 2、0.031 8、0.042 4、0.053 0、0.106 0 mg/mL。根据HPLC检测方法测定槲皮素含量,以槲皮素标准品质量浓度为横坐标X,峰面积为纵坐标Y,绘制标准曲线。
1.3.2.3 回收率测定
精密称取样3 份,按以上方法处理,分别加入1 mL 0.106 mg/mL槲皮素标准液,测定加标回收率。
1.3.3 单因素试验
1.3.3.1 液料比对桑叶槲皮素提取效果的影响
称取过20 目筛后的干桑叶粉0.5 g,按照1.3.1.2节方法脱脂干燥。按照液料比为5∶1、10∶1、15∶1、20∶1、25∶1、30∶1、35∶1(mL/g)分别加入70%乙醇溶液,在超声温度75 ℃、超声功率250 W条件下提取30 min。按照1.3.2 节方法测定桑叶槲皮素提取量。
1.3.3.2 乙醇体积分数对桑叶槲皮素提取效果的影响
称取过20 目筛后的干桑叶粉0.5 g,按照1.3.1.2节方法脱脂干燥。按照液料比25∶1分别加入体积分数40%、50%、60%、70%、80%、90%乙醇溶液,在超声温度75 ℃、超声功率250 W条件下提取30 min。按照1.3.2节方法测定桑叶槲皮素提取量。
1.3.3.3 超声时间对桑叶槲皮素提取效果的影响
称取过20 目筛后的干桑叶粉0.5 g,按照1.3.1.2节方法脱脂干燥。按照液料比25∶1加入50%乙醇溶液,在超声温度75 ℃、超声功率250 W条件下分别提取10、20、30、40、50、60 min。按照1.3.2节方法测定桑叶槲皮素提取量。
1.3.3.4 超声功率对桑叶槲皮素提取效果的影响
称取过20 目筛后的干桑叶粉0.5 g,按照1.3.1.2节方法脱脂干燥。按照液料比25∶1加入50%乙醇溶液,在75 ℃温度条件下分别以125、150、175、200、225、250 W超声功率提取30 min。按照1.3.2节方法测定桑叶槲皮素提取量。
1.3.3.5 超声温度对桑叶槲皮素提取效果的影响
称取过20 目筛后的干桑叶粉0.5 g,按照1.3.1.2节方法脱脂干燥。按照液料比25∶1加入50%乙醇溶液,分别在55、60、65、70、75、80 ℃温度条件下,超声功率200 W提取30 min。按照1.3.2节方法测定桑叶槲皮素提取量。
1.3.4 Box-Behnken试验设计
综合考虑单因素试验结果,选取对桑叶槲皮素提取影响较大的4 个因素:乙醇体积分数、液料比、超声功率、超声温度。在单因素试验基础上,确定Box-Behnken设计的自变量,以桑叶槲皮素提取量为响应值,通过响应面分析对提取条件优化。试验因素水平编码设计见表1。数据采用Design-Expert 7.1统计软件分析。

表1 响应面试验因素水平及编码Table 1 Variables and levels used in the response surface design
2 结果与分析
2.1 标准曲线与回收率
根据1.3.2.2节方法绘制槲皮素标准曲线,该线性回归方程为Y=21.418X-0.762 7,R2=0.999 7,线性范围0.0106~0.106 mg/mL。根据1.3.2.3节方法测定加标回收率平均值92.96%,相对标准偏差(relative standard deviation,RSD)为2.6%。
2.2 单因素试验
2.2.1 液料比对提取效果的影响
由图1可知,液料比为5∶1~25∶1,随着溶剂量的增加,槲皮素提取量逐渐增加,液料比为25∶1时,槲皮素的提取量达到最大值,继续增加溶剂量,槲皮素提取量略有下降,并趋于平稳。提取液的增加,可使桑叶粉与提取溶剂充分接触,有利于槲皮素浸出,但液料比达到25∶1后,槲皮素提取基本达到饱和。而当溶剂量继续增大,浓缩时间增长,槲皮素更易被氧化破坏,影响其提取量,同时也增大了浓缩时的能量消耗。因此,从提取效果、减少溶剂用量和降低浓缩负荷等方面综合考虑,液料比25∶1比较合适。
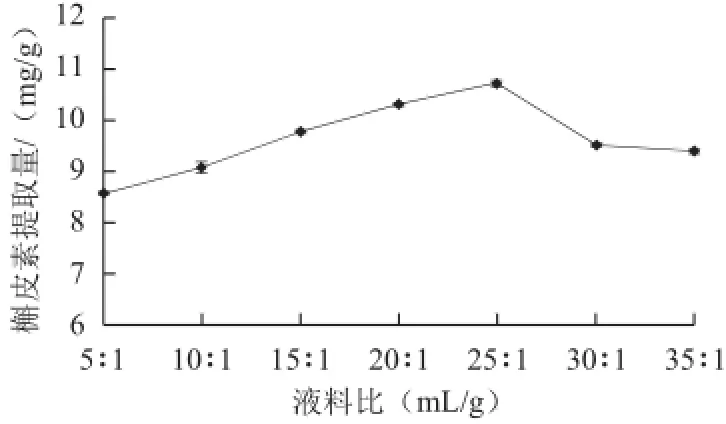
图1 液料比对槲皮素提取量的影响Fig.1 Effect of liquid/solid ratio on the yield of quercetin
2.2.2 乙醇体积分数对提取效果的影响
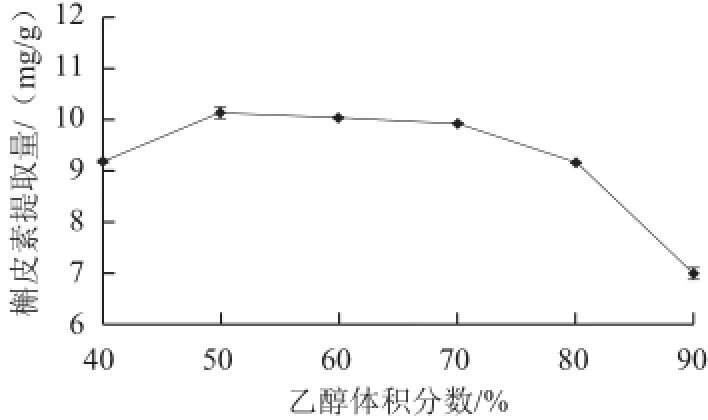
图2 乙醇体积分数对槲皮素提取量的影响Fig.2 Effect of ethanol concentration on the yield of quercetin
由图2可知,随着乙醇体积分数的增加,槲皮素提取量增加,在乙醇体积分数50%时最高,乙醇体积分数在60%~70%时,提取量趋于平稳,乙醇体积分数在80%后,提取量急速下降。分析原因可能是在乙醇体积分数较低时,随着乙醇体积分数增加而增加,当达到60%时,槲皮素浸出达到饱和,提取量趋于稳定,但随着溶剂体积分数继续提高,其他醇溶性杂质、色素、亲脂性强的成分溶出量增加,影响槲皮素的提取效率。综合考虑,可选用乙醇体积分数为50%。
2.2.3 超声时间对提取效果的影响

图3 超声时间对槲皮素提取量的影响Fig.3 Effect of ultrasonication time on the yield of quercetin
由图3可知,超声时间10~30 min范围内,随着超声时间的延长,槲皮素提取量逐渐增加,当超声时间为30 min时,槲皮素提取量最高,并在超声30 min后形成拐点,超声40 min时,槲皮素提取量反而有所下降,分析其原因可能是槲皮素在高温下发生降解、缩合、氧化等反应。由此可知30 min为最佳超声时间。
2.2.4 超声功率对提取效果的影响
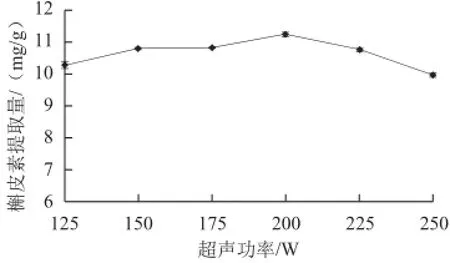
图4 超声功率对槲皮素提取量的影响Fig.4 Effect of ultrasonic power on the yield of quercetin
由图4可知,随着超声功率增加,槲皮素提取量逐渐增加,在超声功率200 W时,槲皮素提取量达到最高,之后随着超声功率增加,提取量逐渐降低,这可能是由于较高的超声功率会产生自由基,对槲皮素活性分子有一定破坏作用,造成槲皮素提取量降低[17]。200 W是最佳超声功率。
2.2.5 超声温度对提取效果的影响
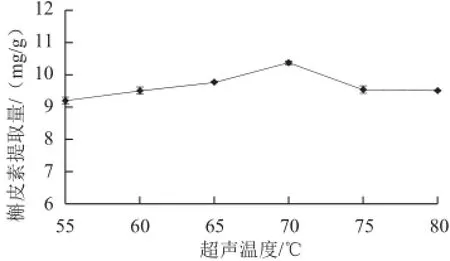
图5 超声温度对槲皮素提取量的影响Fig.5 Effect of extraction temperature on the yield of quercetin
由图5可知,超声温度在55~70 ℃范围内,随着超声温度的升高,槲皮素提取量随之增加,当超声温度为70 ℃时,提取量达到最高;超声温度在75 ℃之后,提取量随之降低,在80℃后趋于稳定。槲皮素属于多羟基类化合物,提高超声温度有利于槲皮素浸出,但温度过高则影响槲皮素的稳定性,加速其被氧化破坏[17]。因此,70 ℃是提取最佳温度。
2.3 响应面试验
在单因素试验基础上,综合考虑各因素对槲皮素提取量的影响,根据Box-Behnken试验设计原理,选择乙醇体积分数、液料比、超声功率、超声温度进行四因素三水平的响应面分析方法,确定桑叶槲皮素最佳提取条件,结果见表2,将所得的试验数据采用Design-Expert 7.1软件进行多元回归拟合,得到桑叶槲皮素提取量对乙醇体积分数(A)、液料比(B)、超声功率(C)、超声温度(D)的二次多项回归方程:
Y/(mg/g)=11.28+0.12A+0.16B-0.14C+0.038D+ 0.0053AB+0.099AC-0.37AD-0.045BC-0.34BD+ 0.14CD-0.59A2-0.45B2-0.62C2-0.60D2
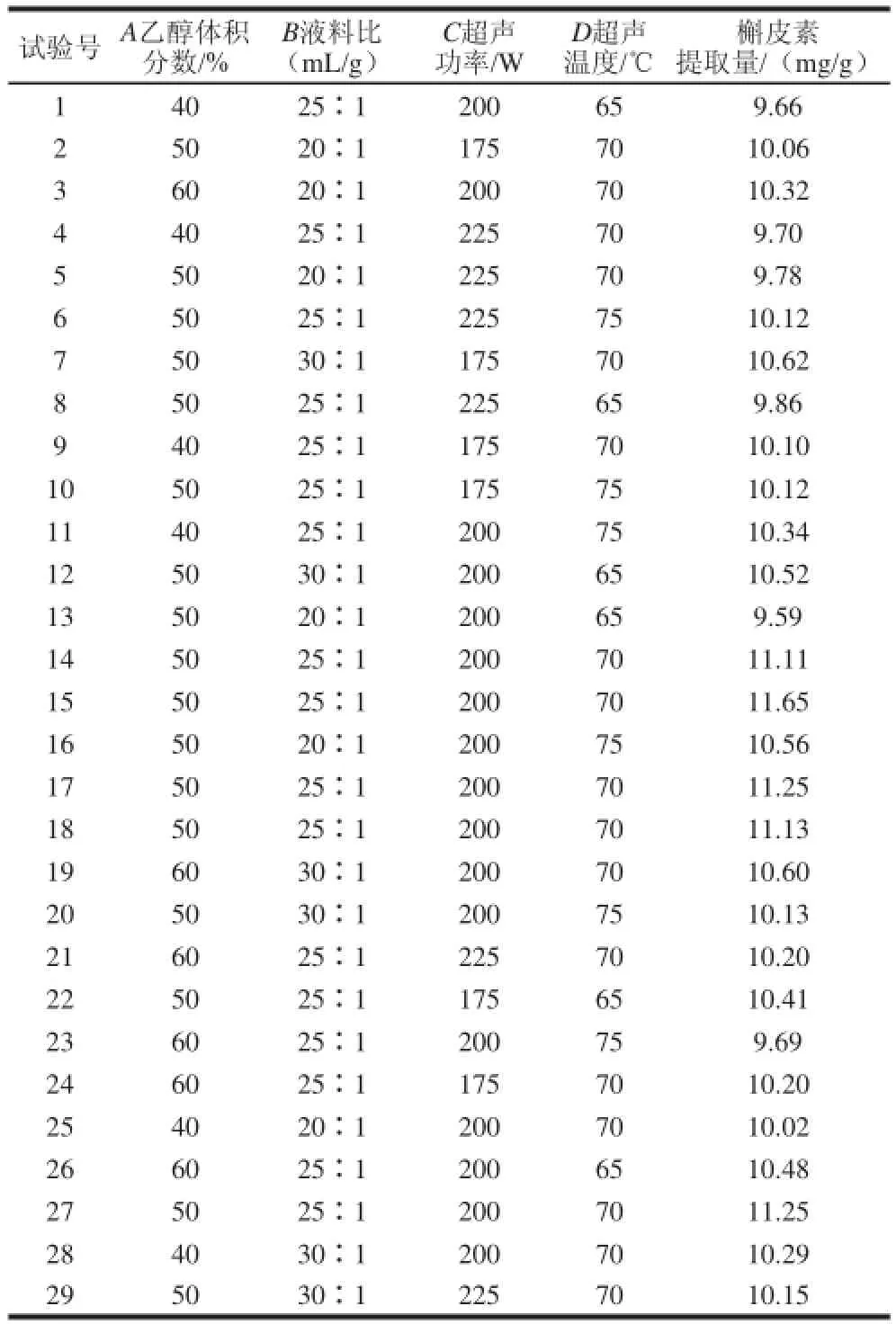
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
由表3可知,模型F值为18.36,P<0.000 1,表明响应回归模型达到了极显著水平。失拟项P=0.441 333>0.05,表示失拟不显著,模型的确定系数R2=0.948 3,说明该模型能解释94.83%响应值的变化,因而该模型拟合程度比较好,可以用此模型对槲皮素提取进行分析和预测。由回归模型和方差分析可知,方程一次项A、C对槲皮素提取量的影响达到显著水平(P<0.05);方程一次项B,交互项BD、AD和二次项A2、B2、C2、D2对槲皮素提取量的影响达到极显著水平(P<0.01)。根据F值可知,各个因素对槲皮素提取量影响的大小顺序为:液料比(B)>超声功率(C)>乙醇体积分数(A)>超声温度(D)。

表3 回归模型和方差分析Table 3 Analysis of variance for the regression model
2.4 响应面分析
超声波辅助提取桑叶槲皮素的等高线和响应面见图6~11,等高线图可直观地反应各因素对槲皮素提取量的交互作用程度。等高线呈圆形表示两因素交互作用不显著,而呈椭圆形或马鞍形则表示两因素交互作用显著[23]。由图8、10可知,乙醇体积分数(A)和超声温度(D)、液料比(B)和超声温度(D)等高线图呈明显的椭圆形,表明两因素间交互作用较显著。相比之下,乙醇体积分数(A)和超声功率(C)、超声功率(C)和超声温度(D)、液料比(B)和超声功率(C)交互作用较小。而乙醇体积分数(A)和液料比(B)等高线呈圆形,表明两因素间交互作用不显著。比较6 组图可知,液料比对槲皮素提取量影响最为显著,其曲线较陡,液料比最佳为25∶1,而超声功率、乙醇体积分数、超声温度次之,其曲线较平滑。
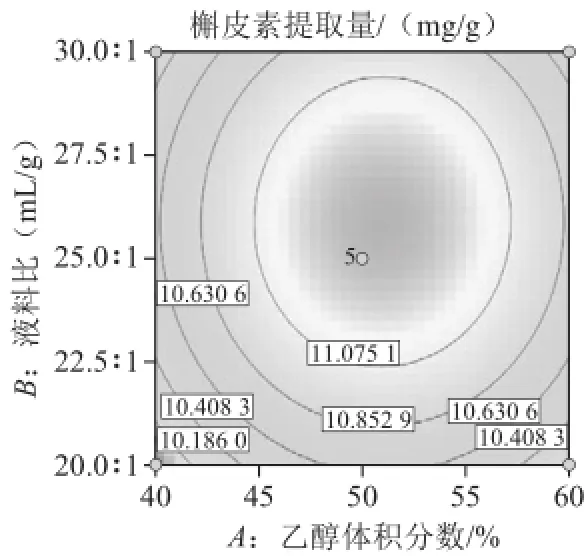
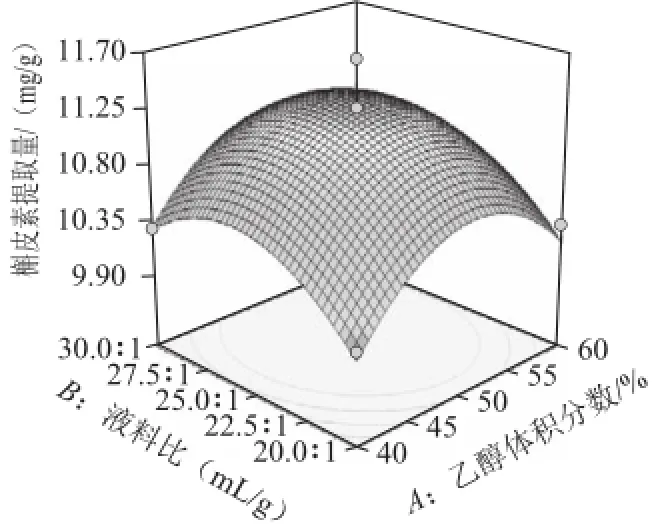
图6 乙醇体积分数和液料比对槲皮素提取量影响的等高线和响应面图Fig.6 Contour and response surface plots for the effects of ethanol concentration and liquid/solid ratio on the yield of quercetin

图7 乙醇体积分数和超声功率对槲皮素提取量影响的等高线和响应面图Fig.7 Contour and response surface plots for the effect of ethanol concentration and ultrasonic power on the yield of quercetin


图8 乙醇体积分数和超声温度对槲皮素提取量影响的等高线和响应面图Fig.8 Contour and response surface plots for the effect of ethanol concentration and extraction temperature on the yield of quercetin
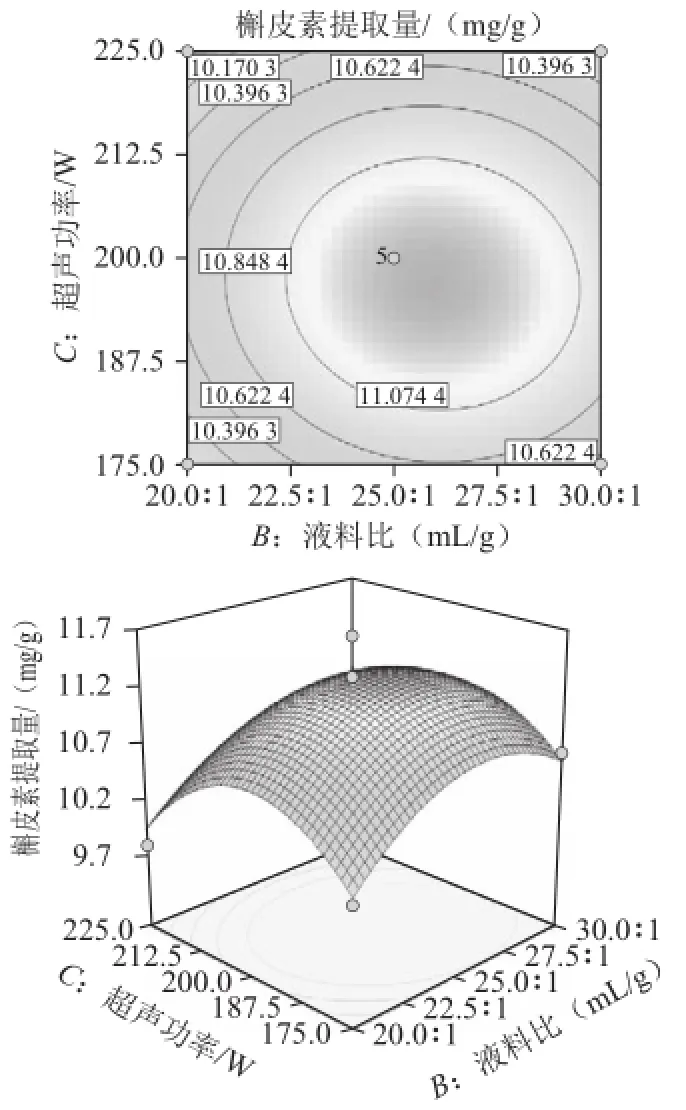
图9 液料比和超声功率对槲皮素提取量影响的等高线和响应面图Fig.9 Contour plot and response surface plot for the effect of liquid/ solid ratio and ultrasonic power on the yield of quercetin
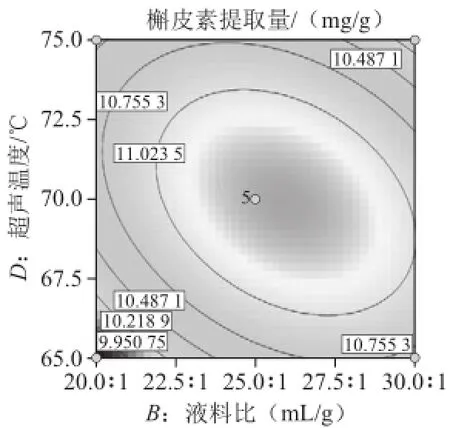

图10 液料比和超声温度对槲皮素提取量影响的等高线和响应面图Fig.10 Contour and response surface plots for the effect of liquid/solid ratio and ultrasonic temperature on the yield of quercetin
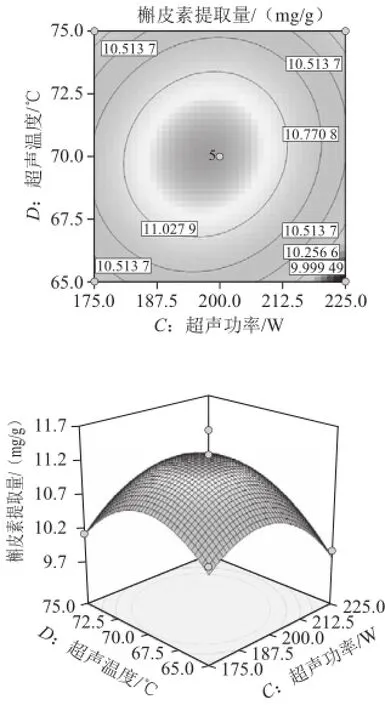
图11 超声功率和超声温度对槲皮素提取量影响的等高线和响应面图Fig.11 Contour and response surface plots for the effect of ultrasonic power and extraction temperature on the yield of quercetin
2.5 验证实验
根据回归模型分析可知,桑叶槲皮素超声波辅助提取工艺最优条件为:乙醇体积分数51.13%、液料比26.07∶1(mL/g)、超声功率196.99 W、超声温度69.61 ℃。根据实际情况稍做调整,即乙醇体积分数51%、液料比26∶1、超声功率200 W、超声温度70 ℃,做3 次平行实验,桑叶槲皮素平均提取量为11.13 mg/g,与理论值11.31 mg/g接近。
3 结 论
本实验采用超声波辅助乙醇提取工艺,根据Box-Benhnken试验设计,建立乙醇体积分数、液料比、超声功率、超声温度对桑叶槲皮素提取量的回归模型,并对模型进行失拟,经过试验验证了该方法的可靠性,能较好地预测桑叶槲皮素的提取量。桑叶槲皮素超声波辅助提取的最优条件为乙醇体积分数51%、液料比26∶1(mL/g)、超声功率200 W、超声温度70 ℃,在此条件下,做3 次平行实验进行验证,桑叶槲皮素提取量为11.13 mg/g,与模型预测值基本相符。刘焱等[24]采用超声波提取金樱子槲皮素的工艺条件为乙醇体积分数60%、超声温度70℃、液料比20∶1(mL/g)、超声时问60min;李瑞玲等[25]研究超声波提取鱼腥草中槲皮素的条件为:超声温度80 ℃、超声时间45 min、乙醇体积分数80%。根据比较,本研究结果在乙醇体积分数方面均比二者结果低,超声温度比后者低。孙莲等[26]报道的桑叶中槲皮素含量最高4.51 mg/g,吴好好等[27]测定桑叶中槲皮素含量为6.27 mg/g,本实验优化提取后桑叶槲皮素含量最高为11.13 mg/g。响应面优化超声波提取法不仅可提高桑叶中槲皮素提取量,还可在一定程度上减少试剂用量,节约能耗,为桑叶槲皮素提取开发利用方面提供理论依据。
[1] ZHANG S D, SOLTIS D E, YANG Y, et a1. Multigene analysis providesa well supported phylogeny of Rosales[J]. Molecular Phylogenetics and Evolution, 2011, 6(1): 21-28.
[2] 黄自然, 李树英. 蚕业资源综合利用[M]. 北京: 中国农业出版社, 2013: 46-47.
[3] 王芳, 励建荣. 桑叶的化学成分、生理功能及应用研究进展[J]. 食品科学, 2005, 26(1): 111-117.
[4] CHOI Y J, KANG J S, PARK J H, et a1. Polyphenolic flavonoids differ in their antiapoptotic efficacy in hydrogen peroxide treated human vascular endothelial cells[J]. The Journal of Nutrition, 2003, 133(4): 985-991.
[5] 姚芳芳, 张锐, 傅瑞娟. 槲皮素和芹菜素对高尿酸血症大鼠血尿酸及抗氧化能力的影响[J]. 食品科学, 2011, 32(5): 287-289.
[6] PAVANATO A, TUNON M J, CAMPOSS S, et al. Effects of quercetin on liver damage in rats with carbon tetrachloride-induced cirrhosis[J]. Digestive Diseases and Sciences, 2003, 48(4): 824-829.
[7] VOLATE S R, DAVENPORT D M, MUGA S J, et al. Modulation of aberrant crypt foci and apoptosis by dietary herbal supplements (quercetin, curcumin, silymarin, ginseng and rutin)[J]. Carcinogenesis, 2005, 26(8): 1450-1456.
[8] MOON Y J, WANG X, MORRIS M E. Dietary flavonoids: effects on xenobiotic and carcinogen metabolism[J]. Toxicology in Vitro, 2006, 20(2): 187-210.
[9] FUKUDA I, ASHIDA H. Suppressive effects of flavonoids on activation of the arylhydrocarbon receptor induced by dioxins[C]// Functional Foods and Health, ACS Symposium Series. Washington DC: American Chemical Society, 2008: 368-374.
[10] PSAHOULIA F H, DROSOPOULOS K G, DOUBRAVSKA L, et al. Quercetin enhances TRAIL-mediated apoptosis in colon cancer cells by inducing the accumulation of death receptors in lipid rafts[J]. Molecular Cancer Therapeutics, 2007, 6(9): 2591-2599.
[11] CHEN Chen, ZHOU J, JI Chunyan. Quercetin: a potential drug to reverse multidrug resistance[J]. Life Sciences, 2010, 87(11/12): 333-338.
[12] 罗玲, 吴凯男. 槲皮素的癌化学预防作用研究进展[J]. 中草药, 2001, 32(4): 378-379.
[13] 章华伟, 陈星宇, 凌春英. 响应面优化醇法提取桑叶黄酮工艺研究[J].氨基酸和生物资源, 2010, 34(3): 76-79.
[14] 王芳, 乔璐, 淡小艳, 等. 桑叶黄酮的提取及抗氧化研究[J]. 广东农业科学, 2011, 3A(15): 76-79.
[15] 雍国新. 荷叶中槲皮素提取工艺研究[J]. 安徽农业科学, 2008, 36(14): 5705-5706.
[16] 刘妍, 王遂. 二氢槲皮素的提取及抗氧化性研究[J]. 化学研究与应用, 2011, 23(1): 107-111.
[17] 唐浩国. 黄酮类化合物研究[M]. 北京: 科学出版社, 2009: 16-17; 48-55.
[18] PAN Guangyan, YU Guoyong, ZHU Chuanhe, et al. Optimization of ultrasound-assiste dextraction(UAE) of flavonoids compounds (FC) from hawthorn seed (HS)[J]. Ultrason Sonochem, 2012, 19(3): 486-490.
[19] BAGHERIAN H, ASHTIANI F Z, FOULADITAJAR A, et al. Comparisons between conventional, microwave and ultrasoundassisted methods for extraction of pectin from grapefruit[J]. Chemical Engineering and Processing, 2011, 50(11/12): 1237-1243.
[20] 马金秋, 李丹, 马向前, 等. 桑叶总黄酮的提取纯化工艺研究[J]. 中国药房, 2010, 21(23): 2142-2144.
[21] 贺伟强, 向天勇, 陶昆, 等. 响应面法优化超声辅助提取桑叶总黄酮的工艺研究[J]. 中国农学通报, 2012, 28(33): 296-301.
[22] BOX G P, BEHNKEN D W. Some new three level design for the study of quantitative variables[J]. Technometrics, 1960, 2(4): 456.
[23] MURALIDHAR R V, CHIRMAMILA R R, MERCHANT R. Response sulface approach for the comparison of lipase production by Candida using two different carbon sources[J]. Biochemistry Engineering Journal, 2001, 9(1): 17.
[24] 刘焱, 付玉, 李丽, 等. 金樱子槲皮素提取工艺的优化[J]. 湖北农业科学, 2012, 51(12): 2563-2573.
[25] 李瑞玲, 崔运启, 秦彩霞. 鱼腥草中槲皮素的提取及含量测定[J]. 化学与生物工程, 2014, 31(2): 72-75.
[26] 孙莲, 严雷, 石绕呢, 等. RP-HPLC测定桑叶、桑枝和桑花中槲皮素和山奈酚的含量[J]. 药物分析杂志, 2005, 25(10): 1230-1232.
[27] 吴好好, 孙冬黎, 钱文春, 等. 酸水解HPLC测定桑叶中槲皮素及山柰酚含量[J]. 中国现代应用药学, 2010, 27(3): 248-250.
Optimization of Ultrasound-Assisted Extraction of Quercetin from Mulberry Leaves by Response Surface Methodology
WANG Hai-yan1, LI Rui2, ZENG Xiu1,*, HUANG Yong1, WANG Jie-ping1, ZHOU Chan1, LÜ Jin-feng1
(1. Chongqing Academy of Animal Sciences, Chongqing 402460, China; 2. Chongqing Green Song of Agricultural Science and Technology Development Co. Ltd., Chongqing 401120, China)
The ultrasound-assisted extraction of quercetin from mulberry leaves was optimized using response surface methodology. The yield of quercetin was investigated with response to four main variables, i.e., liquid/solid ratio, ethanol concentration, extraction time, ultrasonic power, and extraction temperature. Three parallel experiments carried out under the optimal extraction conditions (51% ethanol as the extraction solvent with a liquid/solid ratio of 26:1 (mL/g), ultrasonication with an output power of 200 W, and an extraction temperature of 70 ℃) resulted in an extraction yield of 11.13 mg/g, agreeing with the predicted value (11.31 mg/g). The proposed prediction model could accurately predict the extraction yield of quercetin, suggesting that it is plausible to optimize the extraction conditions of quercetin from mulberry leaves using response surface methodology.
ultrasound-assisted extraction; quercetin; mulberry leaves; response surface methodology (RSM)
R284.2
A
1002-6630(2014)22-0056-07
10.7506/spkx1002-6630-201422011
2014-06-24
重庆市应用开发计划项目(cstc2014yykfA80014);重庆市基本科研业务费计划项目(2012cstcjbky00913)
王海燕(1986—),女,助理研究员,硕士,研究方向为天然活性成分、蚕桑资源综合利用及食品安全与质量控制。E-mail:whydetian@163.com
*通信作者:曾秀(1978—),女,副研究员,博士,研究方向为蚕桑资源综合利用。E-mail:zengxiuxiong@163.com

