酒石酸对双孢蘑菇多酚氧化酶活性及热敏性的影响
周 磊,刘 伟*,刘军平,邹立强,方志超
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
酒石酸对双孢蘑菇多酚氧化酶活性及热敏性的影响
周 磊,刘 伟*,刘军平,邹立强,方志超
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
以双孢蘑菇多酚氧化酶(polyphenoloxidase,PPO)为原料,研究不同浓度的酒石酸处理对PPO相对酶活力、热稳定性及热敏性的影响。结果表明:随着酒石酸浓度的增加,多酚氧化酶的相对酶活力逐渐降低,当酒石酸浓度达到40 mmol/L时,PPO的相对酶活力仅为1.41%;随着酒石酸浓度的增加,PPO热稳定性变差,酒石酸结合热处理对PPO起到更好的失活效果;失活速率常数(k)值随酒石酸浓度升高而变大,在50 ℃下,酒石酸浓度为0、10、15、20 mmol/L时k值分别为1.43×10-2、2.43×10-2、6.78×10-2、57.61×10-2min-1;酶失活活化能(Ea)随酒石酸浓度升高而变小,当酒石酸浓度为0、10、15、20 mmol/L时Ea分别为191.57、180.05、140.64、67.93 kJ/mol,表明PPO经酒石酸处理后热敏性变低。
多酚氧化酶;酒石酸;相对酶活力;热稳定性;热敏性
多酚氧化酶(polyphenoloxidase,PPO)是自然界分布极广的一种氧化还原酶,普遍存在于植物、真菌、昆虫的质体中,在植物细胞组织中,PPO存在的位置因原料的种类、品种及成熟度的不同而有差异[1-2]。多酚氧化酶的酶促反应是果蔬贮运加工 过程中引起褐变和品质劣变的主因之一,褐变反应对果蔬的感官和营养品质都有很大的影响。PPO的改性一直是研究的热点,应用手段主要有:加热法[3-4],物理方法如超静高压[5]、脉冲电场[6]、动态高压微射流[7-8];多种处理手段相结合的方法,如超声结合水杨酸[9]、高压结合温度[10]、加热法结合抗坏血酸[11];以及化学方法如亚硫酸盐[12-13]、有机酸[12-17]。
目前,在有机酸对PPO的活性影响方面有比较多的报道,Zhao Zhengang等[12]发现甘蔗多酚氧化酶能被1mmol/L的抗坏血酸强烈抑制;Palma-Orozco等[13]报道抗坏血酸是曼密苹果PPO的有效抑制剂;Özel等[14]发现苯甲酸可以抑制红柄牛肝菌PPO;Kumar等[15]报道抗坏血酸可有效抑制荔枝PPO活性;Altunkaya等[16]发现半胱氨酸可有效抑制莴苣PPO活性。在前期实验中发现柠檬酸对香菇PPO具有抑制作用,经60 mmol/L的柠檬酸处理后的PPO相对酶活力为4.3%[17]。酒石酸是一种羧酸,存在于多种植物中,可作为食品中添加的抗氧化剂,最大的用途是作为饮料添加剂。Todaro等[18]报道酒石酸能有效抑制茄子多酚氧化酶的活性;于新等[19]研究发现酒石 酸可有效抑制草菇PPO和过氧化物酶的活性。然而,有关酒石酸对PPO热稳定性和热敏性方面的研究还未见报道。
本实验主要以双孢蘑菇PPO为原料,采用不同浓度的酒石酸处理,测定PPO的相对酶活力,并对酒石酸处理过的PPO进行热处理,测定经不同浓度的酒石酸处理后的PPO在不同温度下的热稳定性,失活速率常数及酶失活活化能的变化,为研究蘑菇PPO的酶学性质及抑制PPO的酶活力提供理论参考。
1 材料与方法
1.1 材料与试剂
双孢蘑菇PPO(700 U/mg) 美国Worthington Biochemical公司;酒石酸 阿拉丁试剂上海有限公司;邻苯二酚、磷酸二氢钠、磷酸氢二钠 天津市大茂化学试剂厂。
1.2 仪 器与设备
PC-1600紫外光谱仪 上海美谱达公司;超纯水系统 法国Millipore公司;HH-4型数显恒温水浴锅 江苏省荣华有限公司。
1.3 方法
1.3.1 酒石酸对PPO溶液的处理
准确称取2.00 mg PPO溶解于10 mL 50 mmol/L磷酸缓冲液(pH 6.8)配制成PPO溶 液,称取不同质量的酒石酸分别溶解于10 mL 50 mmol/L磷酸缓冲液(pH 6.8)中,配制成浓度为10、20、30、40、50、60、80 mmol/L的酒石酸溶液。采用不同浓度的酒石酸溶液处理PPO溶液,酒石酸最终浓度分别为5、10、15、20、25、30、40 mmol/L,PPO的最终质量浓度为0.1 mg/mL。
1.3.2 PPO酶活力的测定
PPO酶活力的测定参照Liu Wei等[8]的方法,反应底物溶液包括0.2 mL 2 mmol/L的邻苯二酚溶液与2.7 mL 50 mmol/L pH 6.8的磷酸缓冲溶液,该底物溶液预先在37℃的 水浴锅内恒温15 min,然后将反应底物分别与0.1 mL 0~40 mmol/L酒石酸处理后的PPO酶液(0.1 mg/mL)迅速混合,立即于420 nm波长处测定吸光度,5 min后再次测定吸光度。每个样品酶活力平行测定3次。单位时间内,1 mL酶液吸光度变化0.001定义为1 个酶活力单位,单位为U/min。相对酶活力的定义:相对酶活力/%=(处理样品酶活力/未处理样品酶活力)×100。
1.3.3 PPO热稳定性分析
经酒石酸处理后的P P O热稳定性的实验参照Rapeanu等[20]和Gouzi等[21]的方法,作了部分修改:酒石酸处理后的PPO热处理在45~60 ℃下进行。将2 mL经酒石酸处理后的PPO加入到在固定温度(45、50、55、60 ℃)下预热后的试管中,加热固定时间后取出,在冰水浴中冷却至常温。然后利用上述PPO酶活力测定方法,测得处理后的样品相对酶活力(At),未经处理的样品则为原酶活力(A0)。每个样品酶活力平行测定3 次。
1.3.4 热失活曲线及热敏性分析
酶的热失活动力学数据分析用一级方程来描述:

式中:At为处理t时间(min)后的相对酶活力/%;k为失活速率常数/min-1。
上述的一级反应方程式可转变成式(2):

式中:A0是原酶活力/(U/min);At是处理t时间(min)后的相对酶活力/%;k是失活速率常数/min-1。
根据上述公式作图并计算出各处理的PPO在不同温度热处理下的失活速率常数(k)。
根据阿列纽斯定律,可得公式(3):

式中:k0是阿列纽斯常数/min-1;k是失活速率常数/min-1;Ea是酶失活活化能(k J/m o l);R是气体常数(8.314 J/(mol·K));T为绝对常数/K。
根据上述公式可通过热失活曲线的斜率计算出Ea。1.3.5 数据分析及处理
每个实验均重复3 次,取平均值。采用SAS软件进行显著性分析。
2 结果与分析
2.1 不同浓度酒石酸处理对PPO相对酶活力的影响
由 图1可知,随着酒石酸浓度增加,PPO的相对活力逐渐下降,抑制作用越来越强。当酒石酸浓度低于15 mmol/L时PPO的酶活力变化不大,相对活力保留在85%以上;当酒石酸浓度分别为20、25、30 mmol/L时,PPO酶活力显著被抑制,其相对酶活力分别为63.4%、27.3%、9.15%;当酒石酸浓度为40 mmol/L时,PPO完全失活,其相对活性仅为1.41%。
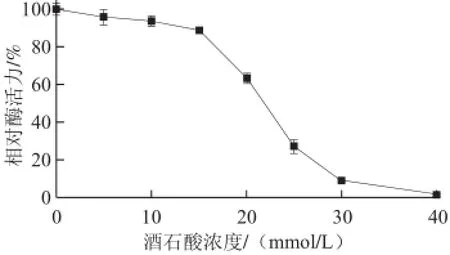
图1 不同浓度的酒石酸对PPO相对酶活力的影响Fig.1 Effect of tartaric acid on relative activity of PPO
研究发现经不同浓度的柠檬酸处理后蘑菇PPO其相对酶活力也发生了改变[17],当柠檬酸浓度分别为15、30 mmol/L时PPO相对酶活力分别为63.0%和24.2%,当柠檬酸浓度达到60 mmol/L时PPO才基本失活(相对酶活力为4.3%),因此,在低浓度范围(≤15 mmol/L)内,柠檬酸对PPO的抑制作用强于酒石酸;但在较高浓度范围(≥30 mmol/L)时酒石酸对PPO的抑制作用更强。但Todaro等[18]研究了不同有机酸对茄子PPO的抑制情况,发现当柠檬酸浓度超过0.4 mol/L时多酚氧化酶活性受到强烈抑制,酒石酸和乙酸对茄子PPO虽然也有抑制作用,但效果不明显。于新等[19]发现100 mg/L的柠檬酸、酒石酸、苹果酸可有效抑制草菇PPO和过氧化物酶的活性。这表明有机酸对PPO活性的影响与PPO的来源以及有机酸的种类和浓度有关。
2.2 酒石酸对PPO热稳定性的影响


图2 不同浓度的酒石酸处理后PPO的热稳定性Fig.2 Thermostability of PPO treated with tartaric acid at various concentrations
低浓度的酒石酸对PPO抑制作用不明显,高浓度的能显著抑制PPO活性,故选取中等浓度(10、15、20 mmol/L)的酒石酸处理后的PPO来做热稳定性实验。由图2可知,经20 mmol/L酒石酸处理后的PPO在4 个温度条件(45、50、55、60 ℃)下均于10 min内基本失活;15 mmol/L酒石酸处理后的PPO在45、50、55、60 ℃时处理30 min后则基本失活;与未经酒石酸处理的PPO相比,经10 mmol/L酒石酸处理的PPO其热稳定性变化不大,在45、50℃处理30 min后相对酶活力基本保持在50%以上;而未经酒石酸处理的PPO其活性保持较好,特别是在50℃以下。经不同浓度酒石酸处理后的PPO在50℃下加热10 min后,其相对酶活力分别为79.6%(0 mmol/L)、73.9%(10 mmol/L)、35.9%(15 mmol/L)、0.7%(20 mmol/L)。由此可见,PPO的热稳定性随着酒石酸浓度的增加而变差,这与其他研究[17,22]发现PPO的热稳定性随着酸度的增加而降低一致。
当酒石 酸浓度在15 mmol/L以下时PPO不经热处理其酶活力均在85%以上,即使是浓度为20 mmol/L的酒石酸处理后其相对酶活力也有63.4%;然而经0、10、15、20 mmol/L的酒石酸处理后的PPO,仅在50℃热处理10 min后,其相对酶活力分别降至79.6%、73.9%、35.9%和0.7%。由此可见,中低浓度(15、20 m mol/L)的酒石酸结合一定温度的热处理在短时间内就能对PPO起到很好的失活效果。Chow等[11]研究发现加热法和抗坏血酸处理联用对苹果PPO会起到更好的失活效果。
2.3 酒石酸对PPO热失活曲线及热敏性的影响
根据图3计算出各曲线的斜率并得出失活速率常数(k),如表1所示。在一定的酒石酸浓度下,随着温度的升高k值明显升高,如酒石酸浓度为15 mmol/L时,45、50、55、60 ℃下的k值分别为3.65×10-2、6.78×10-2、13.91×10-2、42.47×10-2min-1,这和Gouzi等[21]报道的k值随温度升高而升高一致。在一定的温度下,k值随着酒石酸浓度的增加也明显升高,如在50℃下,酒石酸浓度为0、10、15、20 mmol/L时k值分别为1.43×10-2、2.43×10-2、6.78×10-2、57.61×10-2min-1,这与Kanade等[22]报道的k值随酸度升高而升高的结果一致。这也说明了酒石酸浓度越高PPO的热稳定性越差。由此可见,在一定的酒石酸浓度和温度范围内,PPO的失活速率常数(k)值与酒石酸处理浓度和温度都呈正相关性。

图3 酒石酸处理后的PPO在45~60 ℃下的热失活曲线Fig.3 Thermal inactivation curves of tartaric acid-treated PPO in the temperature range of 45-60 ℃
由阿列纽斯定律可计算出各浓度的酒石酸处理后的PPO的Ea,0、10、15、20 mmol/L对应的酶失活活化能分别为191.57、180.05、140.64、67.93 kJ/mol,随着酒石酸处理浓度的升高,酶失活活化能Ea越来越小。Ea表示PPO失活速率k随温度变化的大小:Ea越小,失活速率k随温度的变化就越小。故PPO热敏性随着酒石酸浓度的升高而降低,这与其他研究[17,23]报道一致:经过酸处理后,PPO的Ea随着酸度的增加而减小,热敏性降低。

表1 各浓度酒石酸处理后PPO的k值Table 1 Inactivation rate constants of tartaric acid-treated PPO ×10-2min-1
3 结 论
随着酒石酸浓度的增加,PPO的相对酶活力逐渐降低,当酒石酸浓度达到40 mmol/L时,PPO基本完全失活,相对酶活力仅为原酶活力的1.41%,酒石酸能较好地抑制蘑菇PPO的活性;随着酒石酸浓度的增加,PPO的热稳定性逐渐变差,中低浓度(15、20 mmol/L)的酒石酸结合一定温度的热处理在短时间内就能对PPO起到很好的失活效果;随着酒石酸浓度的增加,失活速率常数(k)值变大,酶失活活化能(Ea)变小,PPO热敏性变低。
[1] GARCÍA S C, BUZALEH A M. Polyphenoloxidase: an enzyme widespread in fruits[J]. Biochemical Education, 1994, 22(3): 152-153.
[2] DICKO M H, HILHORST R, GRUPPEN H, et al. Comparison of content in phenolic compounds, polyphenol oxidase, and peroxidase in grains of fifty sorghum varieties from Burkina Faso[J]. Journal of Agricultural and Food Chemistry, 2002, 50(13): 3780-3788.
[3] NDIAYE C, XU Shiying, WANG Zhang. Steam blanching effect on polyphenoloxidase, peroxidase and colour of mango (Mangifera indica L.) slices[J]. Food Chemistry, 2009, 113(1): 92-95.
[4] SCHWEIGGERT U, SCHIEBER A, CARLE R. Inactivation of peroxidase, polyphenoloxidase, and lipoxygenase in paprika and chili powder after immediate thermal treatment of the plant material[J]. Innovative Food Science and Emerging Technologies, 2005, 6(4): 403-411.
[5] YI Jianyong, JIANG Bin, ZHANG Zhong, et al. Effect of ultrahigh hydrostatic pressure on the activity and structure of mushroom (Agaricus bisporus) polyphenoloxidase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(2): 593-599.
[6] ZHONG Kui, WU Jihong, WANG Zhengfu, et al. Inactivation kinetics and secondary stru ctural change of PEF-treated POD and PPO[J]. Food Chemistry, 2007, 100(1): 115-123.
[7] LIU Wei, LIU Jianhua, XIE Mingyong, et al. Characterization and high-pressure microfluidization-induced activation of polyphenoloxidase from Chinese pear (Pyrus pyrifolia Nakai)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5376-5380.
[8] LIU Wei, LIU Jianhua, LIU Chengmei, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science andEmerging Technologies, 2009, 10(2): 142-147.
[9] YANG Zhenfeng, CAO Shifeng, CAI Yuting, et al. Combination of salicylic acid and ultrasound to control postharvest blue mold caused by Penicillium expansum in peach fruit[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 310-314.
[10] TEREFE N S, YANG Y H, KNOERZER K, et al. High pressure and thermal inactivation kinetics of polyphenol oxidase and peroxidase in str awberry puree[J]. Innovative Food Science and Emerging Technologies, 2010, 11(1): 52-60.
[11] CHOW Y N, LOUARME L, BONAZZI C, et al. Apple polyphenoloxidase inactivation during heating in the presence of ascorbic acid and chlorogenic acid[J]. Food Chemistry, 2011, 129(3): 761-767.
[12] ZHAO Zhengang, ZHU Licai, YU Shujuan, et al. Partial purification and characterization of polyphenol oxidase from sugarcane (Saccharum off i cinarum L.)[J]. Zuckerindustrie, 2011, 136(5): 296-301.
[13] PALMA-OROZCO G, ORTIZ-MORENO A, DORANTESÁLVAREZ L, et al. Purification and partial biochemical characterization of polyphenol oxidase from mamey (Pouteria sapota)[J]. Phytochemistry, 2011, 72(1): 82-88.
[14] ÖZEL A, COLAK A, ARSLAN O, et al. Puri cation and characterisation of a polyphenol oxidase from Boletus erythropus and investigation of its catalytic ef ciency in selected organic solvents[J]. Food Chemistry, 2010, 119(3): 1044-1049.
[15] KUMAR S, MISHRA B B, SAXENA S, et al. Inhibition of pericarp browning and shelf life extension of litchi by combination dip treatment and radiation processing[J]. Food Chemistry, 2012, 131(4): 1223-12 32.
[16] ALTUNKAYA A, GÖKMEN V. Effect of various inhibitors on enzymatic browning, antioxidant activity and total phenol content of fresh lettuce (Lactuca sativa)[J]. Food Chemistry, 2 008, 107(3): 1173-1179.
[17] LIU Wei, ZOU Liqiang, LIU Junping, et al. The effect of citric acid on the activity, thermodynamics and conformation of mushroom polyphenoloxidase[J]. Food Chemistry, 2013, 140(1/2): 289-295.
[18] TODARO A, CAVALLARO R, ARGENTO S, et al. Study and characterization of polyphenol oxidase from eggplant (Solanum melongena L.)[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11244-11248.
[19] 于新, 冯彤, 李远志, 等. 食品添加剂对草菇PPO和POD活性的影响[J].食品工业科技, 2002, 23(5): 10-13.
[20] RAPEANU G, LOEY A V, SMOUT C, et al. Biochemical characterization and process stability of polyphenoloxidase extracted from Victoria grape (Vitis vinifera ssp. Sativa)[J]. Food Chemistry, 2006, 94(2): 253-261.
[21] GOUZI H, DEPAGNE C, CORADIN T. Kinetics and thermodyna mics of the thermal inactivation of polyphenol oxidase in an aqueous extract from Agaricus bisporus[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1): 500-506.
[22] KANADE S R, PAUL B, RAO A G A, et al. The conformational state of polyphenol oxidase from field bean (Dolichlos lablab) upon SDS and acid-pH activation[J]. Biochemical Journal, 2006, 395(3): 551-562.
[23] WEEMAES C A, LUDIKHUYZE L R, van DEN BROECK I, et al. Effect of pH on pressure and thermal inactivation of avocado polyphenol oxidase: a kinetic study[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2785-2792.
Effect of Tartaric Acid on Activity and Thermosensitivity of Polyphenol Oxidase from the Edible Mushroom Agaricus bisporus
ZHOU Lei, LIU Wei*, LIU Jun-ping, ZOU Li-qiang, FANG Zhi-chao
(State Key Laborator y of Food Science and Technology, Nanchang University, Nanchang 330047, China)
The effect of tartaric acid treatment at various concentrations on relative activity, thermostability and thermosensitivity of polyphenol oxidase (PPO) from the edible mushroom Agaricus bisporus was studied. The results showed that the relative activity of PPO decreased gradually with increasing tartaric acid concentration and was only 1.41% of its original activity when the tartaric acid concentration was up to 40 mmol/L. In addition, the thermostability of PPO decreased, and the inactivat ing effect of tartar ic acid combined with heat was enhanced. Inactivation rate constant (k) of PPO increased with increasing tartaric acid concentration, and the k values were 1.43 × 10-2, 2.43 × 10-2, 6.78 × 10-2, 57.61 ×10-2min-1, respectively when the tartaric acid concentrations were 0, 10, 15 and 20 mmol/L at 50 ℃, while the activation energy (Ea) showed the opposite trend, which was calculated to be 191.57, 180.05, 140.64 and 67.93 kJ/mol, respectively, when the tartaric acid con centrations were 0, 10, 15 and 20 mmol/L, suggesting weakened thermosensitivity of PPO.
polyphenol oxidase; tartaric acid; relative activity; thermostability; thermosensitivity
Q554.1
A
1002-6630(2014)15-0178-05
10.7506/spkx1002-6630-201415036
2013-07-30
江西省青年科学家培养对象计划项目(20112BCB23003)
周磊(1990—),男,硕士研究生,研究方向为食品加工与安全。E-mail:ncuskzhoulei@163.com
*通信作者:刘伟(1972—),男,教授,博士,研究方向为食品高新技术与资源综合利用。E-mail:liuwei@ncu.edu.cn

