响应面法优化黄粉虫蛋白制备ACE抑制肽的条件
崔 楠,陶晓赟,李 娟,陈 健,赵立仪,孙爱东*
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
响应面法优化黄粉虫蛋白制备ACE抑制肽的条件
崔 楠,陶晓赟,李 娟,陈 健,赵立仪,孙爱东*
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
以黄粉虫蛋白粉为原料,利用酶解技术对制备血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽进行优化。通过单因素及响应面试验,确定木瓜蛋白酶的酶解工艺,利用酶标法测定酶解产物的ACE抑制率,研究底物质量浓度、加酶量、pH值、酶解时间、酶解温度对ACE抑制肽活性的影响。结果表明:当底物质量浓度为7 g/100 mL、加酶量1%、pH 6.5、酶解时间7 h、酶解温度55 ℃时,黄粉虫蛋白粉酶解产物的ACE抑制率达到58.86%。
黄粉虫蛋白粉;木瓜蛋白酶;ACE抑制肽;酶解条件
血管紧张素转换酶(angiotensin converting enzyme,ACE)是一种膜结合的二肽羧基酶[1],对人体血压有重要的调控作用。ACE通过水解血管紧张素Ⅰ羧基末端的二肽而形成血管紧张素Ⅱ,血管紧张素Ⅱ能引起血管平滑肌的强烈收缩,引起血压升高[2-3]。同时,ACE能使舒缓激肽(人体降压系统中有舒张血管功能的激肽)失活[4]。因此,抑制ACE活性对降低血压有着积极的影响。而化学合成的降压药物对人体有一些毒副作用[5],食源性蛋白质经酶解后得到的降压肽凭借其食用安全性高的特点受到广泛关注[6]。因此从食源性材料中分离得到ACE抑制肽,是未来研制降血压药物的一个趋势[7]。目前,已在多种食源性蛋白中分离得到了ACE抑制肽,这类食源性蛋白又可分为几类,一类是来源于天然植物,如花生、大豆、菜籽、玉米等[8-15];一类来源于动物,如蛋清、蚕蛹、小黄鱼等[16-20];还有一类来源于天然微生物,目前发现的有干酪乳杆菌、瑞士乳杆菌等[21-22]。目前,以黄粉虫蛋白为原料制备ACE抑制肽尚未见报道。
黄粉虫(Terebrio molitor L.)也叫大黄粉虫、黄粉甲,俗称面包虫,属昆虫纲,鞘翅目,拟步行虫科,粉虫属[23]。黄粉虫蛋白含量高、氨基酸种类齐全、含量丰富,目前已有报道利用其制备抗氧化肽[24]、氨基酸保健口服液[25]。Miyoushi等[26]的相关报道表明,ACE更倾向与同疏水性氨基酸的底物结合。黄粉虫中含有大量的疏水性的氨基酸[27],因此以黄粉虫作为制备ACE抑制肽的原料是可行的。本实验以脱脂黄粉虫蛋白粉作为原料,用木瓜蛋白酶进行酶解[28],利用酶标仪测定ACE抑制活性[29],研究在酶解过程中其ACE抑制率的变化,确定酶解黄粉虫ACE抑制肽制备的最佳工艺条件,以期为深入加工、开发黄粉虫蛋白资源及扩展ACE抑制肽的制备原料提供参考。
1 材料与方法
1.1 材料与试剂
脱脂黄粉虫蛋白粉(蛋白质含量63.17%) 重庆涪江生物科技有限公司。
木瓜蛋白酶 PTN6.0S(1.89×104U/g)、ACE、N-[3-(2-呋喃)丙烯醇酰]-2-苯丙氨酰甘氨酰甘氨酸(N-[3-(2-furylacryloyl)]-L-phenyalanyl-glycyl-glycine,FAPGG)美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
HHS4恒温水浴锅 上海跃新科学仪器厂;LB941酶标仪 德国Berthold公司;台式冷冻离心机、FD-1冷冻干燥机 美国Thermo Fisher Scientific公司;PHS-25 pH计 上海精密科学仪器有限公司;FA10004A电子天平 上海精天精密仪器厂。
1.3 方法
1.3.1 ACE抑制肽样品制备工艺流程
黄粉虫蛋白粉→蒸馏水溶解→加酶→恒温酶解→灭酶(沸水浴10 min)→4 ℃、10 000 r/min离心10 min →取上清→旋转蒸发浓缩→冷冻干燥→ ACE抑制肽样品冻干粉
1.3.2 酶解工艺条件的单因素试验设计
1.3.2.1 底物质量浓度对ACE抑制活性的影响
底物质量浓度分别为1、3、5、7、9 g/100 mL,加酶量1%(酶与底物质量分数比)、pH 7.0、温度55 ℃酶解3 h,测定样品的ACE抑制率。
1.3.2.2 加酶量对ACE抑制活性的影响
加酶量分别为0.2%、0.6%、1.0%、1.4%、1.8%,底物质量浓度为7 g/mL、pH 7.0、温度55 ℃酶解3 h,测定样品的ACE抑制率。
1.3.2.3 pH值对ACE抑制活性的影响
pH值分别为5.0、6.0、7.0、8.0、9.0,底物质量浓度为7 g/mL、加酶量1%、温度55 ℃酶解3 h,测定样品的ACE抑制率。
1.3.2.4 酶解时间对ACE抑制活性的影响
酶解时间分别为1、3、5、7、9 h,底物质量浓度为7 g/mL、加酶量1%、pH 7.0、酶解温度55 ℃,测定肽样的ACE抑制率。
1.3.2.5 酶解温度对ACE抑制活性的影响
酶解温度分别为45、50、55、60、65 ℃,底物质量浓度为7 g/mL、加酶量1%、pH 7.0、酶解3 h,测定肽样的ACE抑制率。
1.3.3 酶解工艺条件的响应面试验设计
根据单因素试验结果,运用Box-Benhnken中心组合试验设计原理,选择对ACE抑制率有影响的4 个因素:底物质量浓度、pH值、酶解时间、酶解温度,进行四因素三水平的响应面优化试验,以ACE抑制率作为响应变量。
1.3.4 ACE 抑制率的测定
参照Shalaby等[30]的方法,稍作改动。以FAPGG作为底物,在酶标仪上测定。
ACE溶液现用现配,将1 mL蒸馏水缓缓注入单位为0.25 U的ACE的玻璃瓶中,混合均匀,待用。具体方法如下:将10 μL的ACE水溶液(0.25 U/mL)和10 μL ACE抑制肽(10 mg/mL)样液加入酶标板中暂不混合,然后加入150 μL经过预热(37 ℃、5 min)的底物(1.0 mmol/L FAPGG溶解于50 mmol/L的Tris-HCl,pH 7.5,其中包含0.3 mol/L NaCl)使其开始反应。迅速将微孔板放入酶标仪中,记录在340 nm下的吸光度A1,在反应30 min后再次测定在340 nm下的吸光度A2。空白对照使用10 μL的缓冲液(50 mmol/L的Tris-HCl,pH 7.5,包含 0.3 mol/L NaCl)代替ACE抑制肽样液,空白的起始吸光度记为A01、反应后的记为A02。以吸光度的变化(△A抑制剂= A1-A2,△A空白= A01-A02) 计算ACE抑制率。
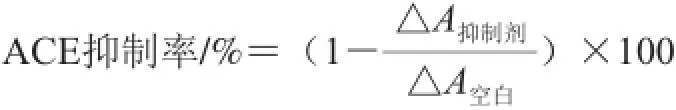
1.4 数据处理
实验数据均为经过3 次平行实验得到的平均值,响应曲面实验数据采用Design Expert 8.0软件绘图并作方差和显著性分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 底物质量浓度对ACE抑制率的影响

图1 底物质量浓度对ACE抑制率的影响Fig.1 Effect of substrate concentration on ACE inhibitory activity
由图1可知,底物质量浓度的在1~7 g/100 mL范围内,随着底物质量浓度的增加,ACE抑制率逐渐升高,在7 g/100 mL时达到最大58.35%,之后随着底物质量浓度增加而降低。这是因为当底物质量浓度较小时,反应底物与酶的结合部位浓度较低,导致ACE抑制率较低;当底物质量浓度过高时,酶解体系变得黏稠,酶被底物所饱和,ACE抑制率下降。
2.1.2 加酶量对ACE抑制率的影响

图2 加酶量对ACE抑制率的影响Fig.2 Effect of enzyme dosage on ACE inhibitory activity
由图2可知,加酶量在0.2%~1.8%范围内对ACE抑制率影响效果不明显,可能是选择的加酶量范围并不会对ACE抑制肽的结构或成分产生重大影响所致。因此,在响应面设计中确定加酶量为1%,不考虑加酶量的变化对酶解产物ACE抑制率的影响。
2.1.3 pH值对ACE抑制率的影响

图3 pH值对ACE抑制率的影响Fig.3 Effect of hydrolysis pH on ACE inhibitory activity
由图3可知,pH值对ACE抑制率有着很大的影响。pH 5~7范围内,随着pH值的升高,ACE抑制率逐渐升高,在pH 7时达到最高为57.47%,这是因为在酸性或碱性条件下,黄粉虫蛋白质结构会发生变化,从而影响了酶解的效果。
2.1.4 酶解时间对ACE抑制率的影响

图4 酶解时间对ACE抑制率的影响Fig.4 Effect of hydrolysis time on ACE inhibitory activity
由图4可知,酶解产物的ACE抑制率随着时间的增长呈先升后降的趋势,这是由于在酶解的初期,酶解反应不完全,具有抑制ACE作用的多肽片段没有完全酶解出来。随着时间的延长,反应越来越充分,ACE抑制率逐渐升高,但是长时间的酶解会将多肽水解变为没有ACE抑制活性的氨基酸,所以ACE抑制率在7 h以后出现下降趋势。考虑到生产成本与效率,选择5 h作为响应面的时间因素的中心值。
2.1.5 酶解温度对ACE抑制率的影响
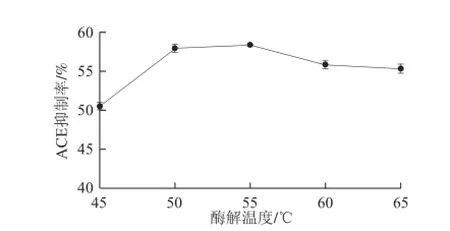
图5 酶解温度对ACE抑制率的影响Fig.5 Effect of hydrolysis temperature on ACE inhibitory activity
由图5可知,酶解产物的ACE抑制率在50 ℃左右达到最大值,在低于50 ℃时,酶解温度的上升加快了酶促反应的进行;而温度高于50 ℃后,木瓜蛋白酶会随着温度的升高而活性减弱。因此选择50 ℃为响应面温度因素的中心值。
2.2 响应面优化试验结果与分析
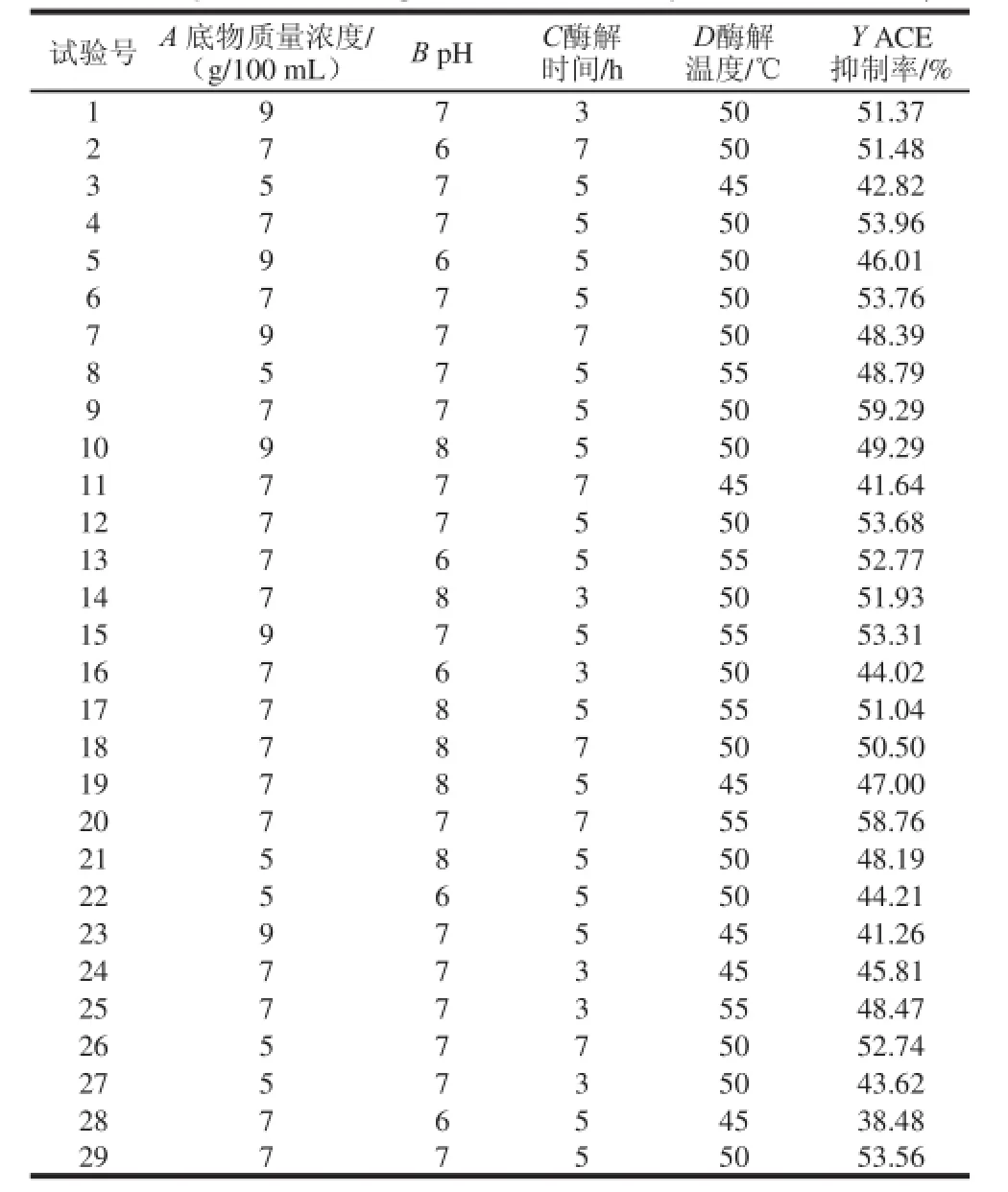
表1 响应曲面法优化酶解条件的试验设计与结果Table1 Experimental design and results for responses surface analysis
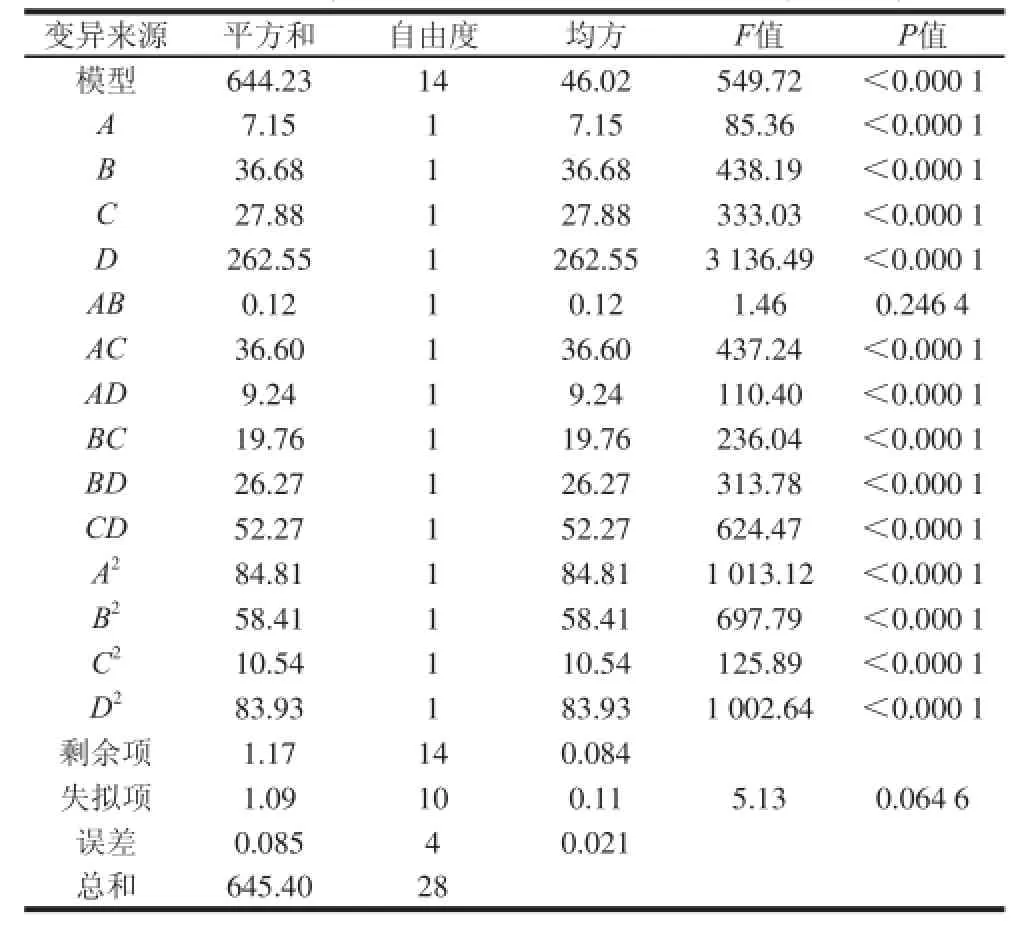
表2 响应面试验结果方差分析Table 2 Analysis of variance for ACE inhibitory activity
响应面试验结果见表1,由表2方差分析可知,模型P值显著,失拟项P=0.064 6>0.05,不显著。说明未知因素对试验结果影响小。R2=0.998 2,说明该模型拟合度良好,试验误差小。其二次方程为:Y=53.74+0.77A+ 1.75B+1.52C+4.68D-0.17AB-3.03AC+1.52AD-2.22BC-2.56BD+3.62CD-3.62A2-3.00B2-1.27C2-3.60D2。
2.3 响应面结果分析

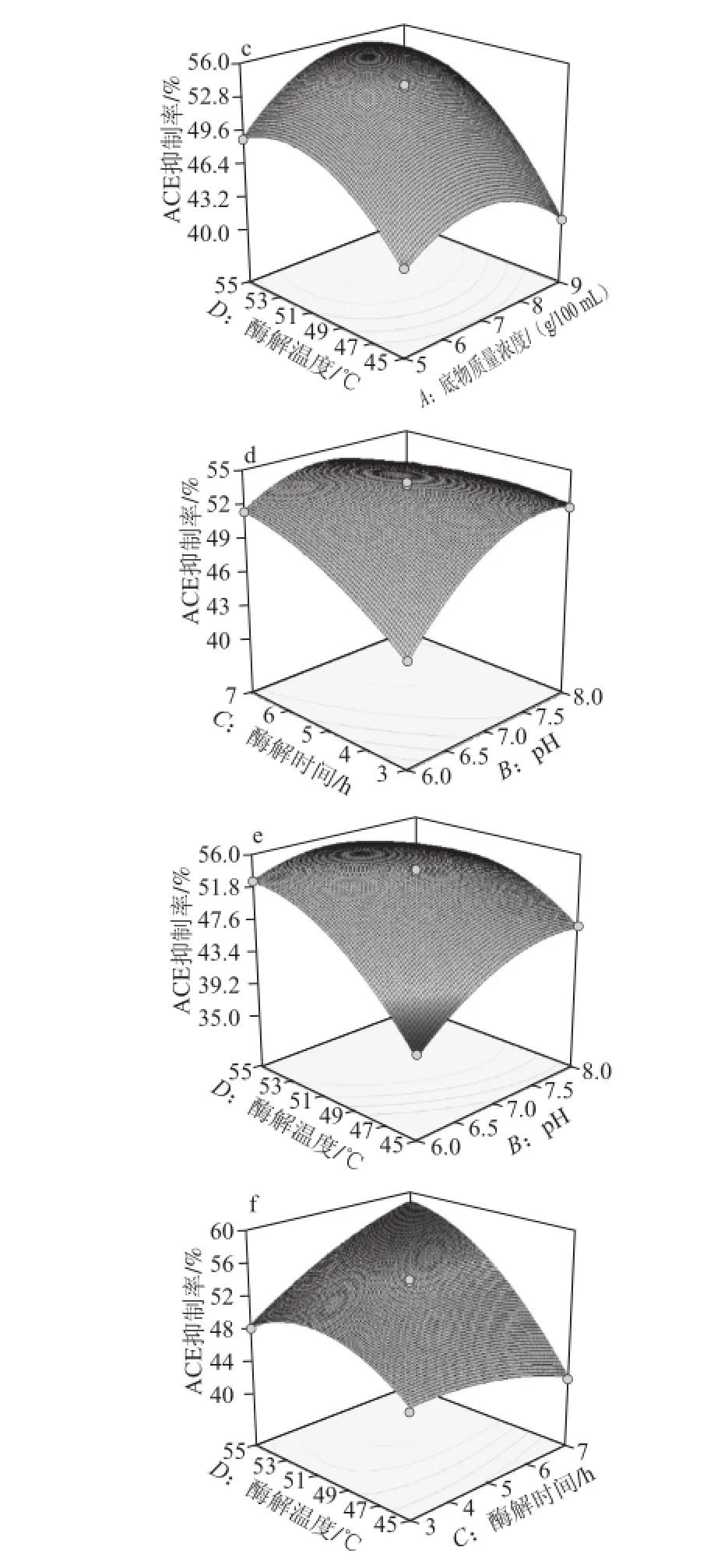
图6 各因素交互影响ACE抑制活性的响应曲面图Fig.6 Response surface and contour plots for the interactive effects of hydrolysis conditions on ACE inhibitory activity
由图6可知,响应值的变化是复杂的二次关系,任意两个因素间均存在着明显的交互作用。
模型优化的最佳酶解条件为:底物质量浓度6.82 g/100 mL、pH 6.5、时间7 h、温度55 ℃。在此条件下,木瓜蛋白酶酶解黄粉虫多肽产物的ACE抑制率模型值为59.48%。采用优化的条件对黄粉虫蛋白粉进行验证实验,为方便操作,条件设为底物质量浓度7 g/100 mL、加酶量1%、pH 6.5、时间7 h、温度55 ℃。这一条件下得到黄粉虫蛋白粉酶解产物的ACE抑制率为58.86%,模型值与实验值相对偏差为1.1%,说明利用响应曲面法优化得到的黄粉虫蛋白粉的酶解工艺条件参数准确可靠,利用本实验建立的模型在实践中进行预测是可行的。
3 结 论
木瓜蛋白酶酶解黄粉虫蛋白粉制备ACE抑制肽的最优工艺参数:底物质量浓度7 g/100 mL、加酶量1%、pH 6.5、时间7 h、温度 55 ℃。此时获得的酶解产物的ACE抑制率最高,达58.86%。该方法制备的ACE抑制肽具有较高的活性,其ACE抑制率在已知的通过动物蛋白制备出的ACE抑制肽属于中上水平。验证实验表明此模型具有较好的预测能力。研究成果对于进一步分离纯化黄粉虫ACE抑制肽和研究其理化指标具有重要的参考价值。
[1] 赵海珍, 陆兆新, 刘战民. 天然食品来源的血管紧张素转换酶抑制肽的研究进展[J]. 中国生化药物杂志, 2004 , 25(5): 315-317.
[2] 吴炜亮, 吴国杰, 梁道双, 等. ACE 抑制肽的生理功能和研究进展[J].现代食品科技, 2006 , 22(3): 251-254.
[3] 石艳军, 金义鑫, 袁琳, 等. 食品蛋白质中血管紧张素转化酶抑制肽的研究[J]. 生物技术通报, 2004(6): 6-10.
[4] CUSHMANH D W, CHEUNG H S. Spectrophotometricassay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[5] 李莹, 曾晓雄, 周剑忠, 等. 泥鳅 ACE 抑制肽的体外活性研究[J]. 食品工业科技, 2012, 33(17): 127-130.
[6] 刘志国, 吴琼, 吕玲肖, 等. 酶解米糠蛋白分离提取ACE抑制肽及其结构研究[J]. 食品科学, 2007, 28(3): 223-227.
[7] FUJITA H, YAMAGAMI T, OHSHIMA K. Effects of all aceinhibitory agent, katsuobushi oligopeptide, in the spontaneously hypertensive rat and in borderline and mildly hypertensive subjects[J]. Nutrition Research, 2001, 21(8): 1149-1158.
[8] 江利华. 花生ACE抑制肽的分离纯化、结构鉴定及体内降血压功能研究[J]. 食品工业科技, 2009, 30(10): 94-100.
[9] 任欢. 菜籽蛋白ACE抑制肽的制备及分离纯化的研究[D]. 湖南: 湖南农业大学, 2011.
[10] YUST M M, PEDROCHE J, GIRON-CALLE J, et al. Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J]. Food Chemistry, 2003, 81(3): 363-369.
[11] 吴建平, 丁霄霖. 大豆降压肽的研制 (I): 生产高活性ACEI肽酶系的筛选[J]. 中国油脂, 1998, 23(2): 49-51.
[12] HIROFUMI M, TOSHIAKI K. Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides from wheat gliadin hydrolysate[J]. Nahrung , 2003, 47(5): 354-358.
[13] 黎观虹, 施用辉, 乐国伟. 花生分离蛋白碱性蛋白酶Alcalase水解物具有血管紧张素转化酶抑制活性[J]. 食品科学, 2005, 26(6): 55-61.
[14] MA M S, BAE I Y, LEE H G, et al. Purification and identification of angiotensin I-converting enzyme inhibitory peptide from buckwheat (Fagopyrum esculentum Moench)[J]. Food Chemistry, 2006, 96(1): 36-42.
[15] 刘萍, 陈黎斌, 杨严俊. 酶解玉米蛋白制备降血压肽的研究[J]. 食品工业科技, 2006, 27(5): 117-122.
[16] 张瑞东, 迟玉杰, 阮长青. 酶解蛋清蛋白制备ACE抑制肽的工艺研究[J]. 食品科学, 2010, 31(14): 1-3.
[17] 李勇, 王颖, 黄先智, 等. 酶解脱脂蚕蛹蛋白制备ACE抑制肽[J]. 食品科学, 2012, 33(17): 151-157.
[18] 蔡丽丽, 徐鑫, 刘国艳, 等. 响应曲面法优化小黄鱼ACE抑制肽的酶解条件[J]. 食品科学, 2011, 32(23): 167-171.
[19] FERREIRA I, PINHO O, MOTA M V, et al. Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates[J]. International Dairy Journal, 2007, 17(5): 481-487.
[20] RUIZ J Á G, RAMOS M, RECIO I. Angiotensin convertingenzyme inhibitory activity of peptides isolated from Manchego cheese. Stability under simulated gastrointestinal digestion[J]. International Dairy Journal, 2004, 14(12): 1075-1080.
[21] 张子健. 干酪乳杆菌D400产ACE抑制肽的研究[D]. 河北: 河北农业大学, 2010.
[22] 张佳程, 王海燕, 褚庆环. 发酵乳中ACE抑制剂的超滤分离[J]. 中国乳品工业, 2004, 32(1): 32-34.
[23] 王文亮, 孙爱东. 黄粉虫在食品加工中的开发利用[J]. 食品与发酵工业, 2005, 31(5): 87-89.
[24] 张莉莎, 张建新. 黄粉虫抗氧化活性肽的分离纯化研究[J]. 食品科学, 2009, 30(22): 180-183.
[25] 王文亮. 黄粉虫氨基酸保健口服液的研究[D]. 山东: 山东农业大学, 2006.
[26] MIYOSHI S, ISHIKAWA H, KANEKO T, et al. Structures and activity of angiotensin-converting enzyme inhibitors in analpha-zein hydrolysate[J]. Agricultural and Biological Chemistry, 1991, 55(5): 1313-1318.
[27] 陈杰林, 白卫东, 李伟敏. 黄粉虫蛋白分析及酶解工艺研究[J]. 农牧产品开发, 1999(1): 24-25.
[28] 王文亮, 孙爱东, 王守经, 等. 木瓜蛋白酶水解黄粉虫蛋白质工艺条件的优化[J]. 食品与药品, 2007, 9(8): 5-7.
[29] VERMEIRSSEN V, CAMP J V, VERTRAETE W. Optimisation and validation of an angiotensin-converting enzyme inhibition assay for the screening of bioactive peptides[J]. Journal of Biochemical and Biophysical Methods, 2002, 51(1): 75-87.
[30] SHALABY S M, ZAKORA M, OTTE J. Performance of two commonlyused angiotensin-I-converting enzyme inhibition assays using FAPGG and HHL as substrates[J]. Journal of Dairy Research, 2006, 73(2): 178-186.
Optimization of Preparation of Angiotensin-I Converting Enzyme Inhibitory Peptides Derived from Terebrio molitor L. Protein by Response Surface Methodology
CUI Nan, TAO Xiao-yun, LI Juan, CHEN Jian, ZHAO Li-yi, SUN Ai-dong*
(Beijing Key Laboratory of Forestry Food Processing and Safety, College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China)
In this study, Tenebrio molitor protein powder was hydrolyzed by papain to prepare angiotensin-I converting enzyme (ACE) inhibitory peptides. Single factor design (involving temperature, pH, substrate concentration, enzyme dosage and hydrolysis time) and response surface methodology were used to determine the optimal hydrolysis conditions for preparing ACE inhibitory peptides. ACE inhibitory rates of hydrolysates were determined by enzyme-linked immunosorbent assay (ELISA). The optimum conditions were determined as follows: substrate concentration 7 g/100 mL, enzyme dosage 1%, pH 6.5, hydrolysis time 7 h and temperature 55 ℃. The ACE inhibitory rate obtained under these conditions was 58.86%.
Tenebrio molitor protein powder; papain; ACE inhibitory peptides; hydrolysis conditions
TS218
A
1002-6630(2014)15-0156-05
10.7506/spkx1002-6630-201415032
2013-10-07
国家高技术研究发展计划(863计划)项目(2013AA102206)
崔楠(1989—),男,硕士研究生,研究方向为食品质量与安全。E-mail:cn1867@126.com
*通信作者:孙爱东(1968—),女,教授,博士,研究方向为天然产物生理活性物质的开发与利用。E-mail:adsun68@163.com

