肠出血性大肠杆菌O157:H7变种Q蛋白对志贺毒素表达的影响
李嘉文,郑冬冬,王宏勋,刘志国,余晓丽,周帼萍,李 睿,*
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.河南医药技师学院制药工程系,河南 开封 475000;3.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
肠出血性大肠杆菌O157:H7变种Q蛋白对志贺毒素表达的影响
李嘉文1,2,郑冬冬1,王宏勋3,刘志国1,余晓丽1,周帼萍1,李 睿1,*
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.河南医药技师学院制药工程系,河南 开封 475000;3.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
1株肠出血性大肠杆菌O15 7:H7变种EC169菌株,携带stx基因但不表达志贺毒素。通过高效热不对称交错聚合酶链式反应(high-efficiency thermal asymmetric interlaced polymerase chain reaction,hiTAIL-PCR)hiTAILPCR扩增得到EC169 stx1及其上游核苷酸片段并克隆测序,结果表明:EC169 q基因与标准株sakai q基因相比存在6个SNP位点。通过PCR扩增O157:H7高毒株EC150 q基因全长,并构建表达载体pkk223-q分别转化EC169和低毒株EC157。反转录荧光定量PCR实验结果表明,外源q基因在EC169和EC157重组菌中可高效表达,并引起EC157stx转录水平上调,但EC169重组菌stx转录水平不变。反向乳胶凝集实验结果亦证实EC157重组菌志贺毒素表达量提高,而EC169重组菌志贺毒素表达量不变。Q蛋白变异可能并非EC169志贺毒素不表达的主要原因。
大肠杆菌O157:H7;Q蛋白;反转录荧光定量PCR;志贺毒素;hiTAIL-PCR
肠出血性大肠杆菌O157:H7是一类十分重要的食源性致病菌,感染人体后会出现腹痛、腹泻、恶心或呕吐,部分患者还会有发热症状出现。可引起胃肠道以及全身性的疾病,如出血性肠炎和溶血性尿毒综合征,临床表现为溶血性贫血、急性肾衰竭、凝血功能障碍、血小板减少等[1-2]。感染严重者可导致病人死亡,一些重症患者还会产生严重的神经系统并发症[3-4]。1982年大肠杆菌O157:H7被认定为严重致病菌,其感染率也于20世纪90年代后逐年升高[5]。患者感染大肠杆菌O157:H7后,在使用抗生素治疗时,有诱导志贺毒素表达和加剧病人病情的危险[6]。以上这些特点使肠出血性大肠杆菌O157:H7成为全球关注的焦点。
肠出血性大肠杆菌O157:H7的主要毒力因子是志贺毒素。志贺毒素(Shiga toxin,Stx)由噬菌体上的stx基因编码[7-8]。stx基因位于Stx噬菌体的晚期操纵子中,有stx1和stx2两种类型,分别编码Stx1和Stx2两种毒素[9-10]。q基因是晚期转录的抗终止基因,它编码的Q蛋白作用于晚期启动子PR’,激活stx基因转录,所以志贺毒素的表达与q基因密切相关[11](图1)。

图1 1 stxstx基因的表达调控[12][12]Fig.1 Expression and regulation of stx gene[12]
Koitabashi等[13-14]从日本、泰国、中国山东省等地牛肉标本分离到了数株菌,这些菌属于O157:H7或O157:H-血清型,都携带stx2基因,但不产志贺毒素2,经丝裂霉素C诱导,仍不能产生志贺毒素,研究发现这些菌q基因序列存在较大变异,可能由于Q蛋白活性弱导致Stx2表达量低。目前仅日本Miyamoto实验室发表了类似的研究报告,但该类肠出血性大肠杆菌变种的志贺毒素基因表达调控机制尚不清楚[15]。本实验室有1株日本Miyamoto实验室赠送的肠出血性大肠杆菌O157:H7临床株EC169,携带stx1和stx2基因但不产志贺毒素[16]。携带stx1但不产Stx1的O157菌株是否也由于独特的q基因造成Q蛋白活性弱,造成Stx1不能正常表达,目前尚无报道。
本实验拟研究肠出血性大肠杆菌O157:H7变种Q蛋白对志贺毒素表达的影响,为进一步研究大肠杆菌志贺毒素的表达调控提供参考。
1 材料与方法
1.1 材料与试剂
肠出血性大肠杆菌O157:H7临床株:高毒株EC150与变种EC169由日本九州大学生命科学与技术学院Miyamoto实验室赠送。肠出血性大肠杆菌O157:H7质控菌株:低毒株EC157由武汉市疾病预防与控制中心赠送。质粒pkk223由浙江工业大学朱廷恒老师赠送。
大肠杆菌DH5α 北京鼎国昌 盛生物技术有限公司;pGEM-T Easy载体 美国Promega公司;DNA提取试剂盒、PCR产物纯化试剂盒 美国Omega Bio-Tek公司;DNA Marker、Ex Taq PCR试剂盒、DNA凝胶回收试剂盒、RNA提取试剂盒、反转录荧光定量PCR试剂盒、限制性内切酶EcoRⅠ、HindⅢ等 日本TaKaRa公司;VTEC-RPLA检测试剂盒 日本生研公司;GoldView核酸染料 北京博大泰克生物基因技术有限公司;氨苄青霉素、异丙基-β-D-硫代半乳糖苷、5-溴-4-氯-3-吲哚-β-D-半乳糖苷、引物合成 北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
5424R型台式冷冻高速离心机 德国Eppendorf公司;CF15R型立式冷冻离心机 日本Hitachi公司;Spectrum752型紫外-可见分光光度计 上海光谱仪器有限公司;Tgradient型PCR仪 德国Biometra公司;ABI7500型荧光定量PCR仪 美国应用生物系统公司;Dyy-8C型电泳仪、DyCP-31D型电泳槽 北京市六一仪器厂;GBox-HR-E-M型凝胶成像仪 英国Syngene公司。
1.3 方法
1.3.1 EC169 q-stx1区hiTAIL-PCR扩增与克隆测序
高效热不对称交错聚合酶链式反应(high-efficiency thermal asymmetric interlaced polymerase chain reaction,hiTAIL-PCR)实验中长简并引物(long arbitrary degenerate primer,LAD)采用LIU yaoguang等[17]设计的4条简并引物LAD1-1、LAD1-2、LAD1-3、LAD1-4,并去掉了所添加的酶切位点。特异性引物(special primer,SP)为自己设计,SP1和SP2之间间隔306 bp,SP2和SP3之间间隔503 bp。LAD系列简并引物分别与SP1用于第l轮PCR扩增,SP2和SP3分别与AC1用于第2和第3轮PCR扩增。序列见表1[17]。
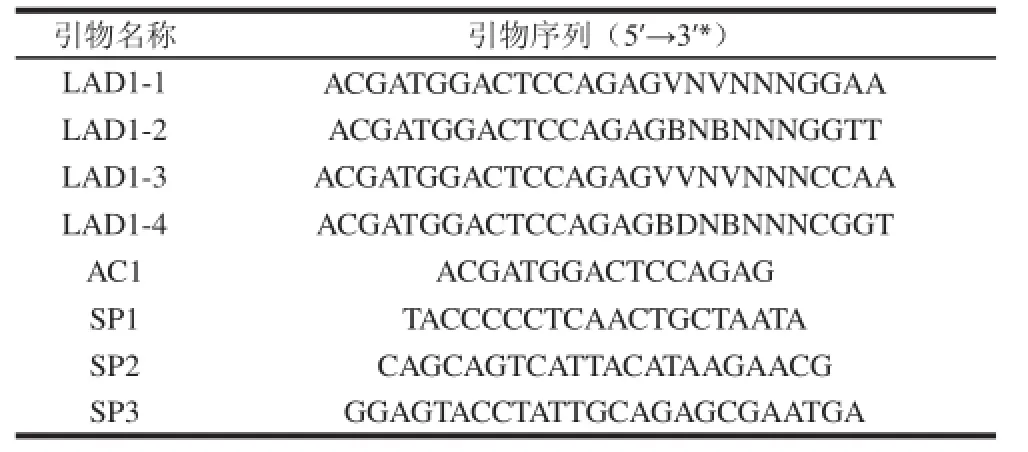
表1 hiTAIL-PCR引物名称及序列Table 1 Primers used for hiTAIL-PCR
EC169基因组DNA采用细菌基因组试剂盒提取。hiTAIL-PCR预扩增反应总体积为20 μL,PCR反应体系为:2 μL的10×Ex Taq buffer、2 μL 2.5 mmol/L dNTP、1.5 μL 10 μmol/L SP1、1 μL20 μmol/L的 LAD、2 μL模板DNA、0.2 μL Ex Taq DNA聚合酶,加无菌双蒸水至总体积20 μL。取稀释了100 倍的预扩增产物1 μL作为第1轮hiTAIL-PCR反应的模板。第1轮hiTAILPCR反应总体积为25 μL,反应体系如下:2.5 μL的10×Ex Taq buffer、2.64 μL 2.5 mmol/L dNTP、2 μL 10 μmol/L SP2、2 μL 10 μmol/L的ACl、1 μL模板DNA、0.2 μL Ex Taq DNA聚合酶,加无菌双蒸水至总体积25 μL。取稀释了20 倍的第1轮hiTAIL-PCR产物做为第2轮hiTAIL-PCR反应的模板。第2轮hiTAIL-PCR反应总体积为50 μL,反应体系如下:5 μL 10×Ex Taq buffer、4 μL 2.5 mmol/L dNTP、2 μL 10 μmol/L SP3、2 μL 10 μmol/L的AC1、1 μL模板DNA、0.3 μL Ex Taq DNA聚合酶,加无菌双蒸水至总体积50 μL。3轮hiTAIL-PCR反应条件见表2[17]。将PCR扩增得到的目的条带切胶回收,并克隆到pGEM-T Easy测序载体,送往生工生物工程(上海)有限公司测序。
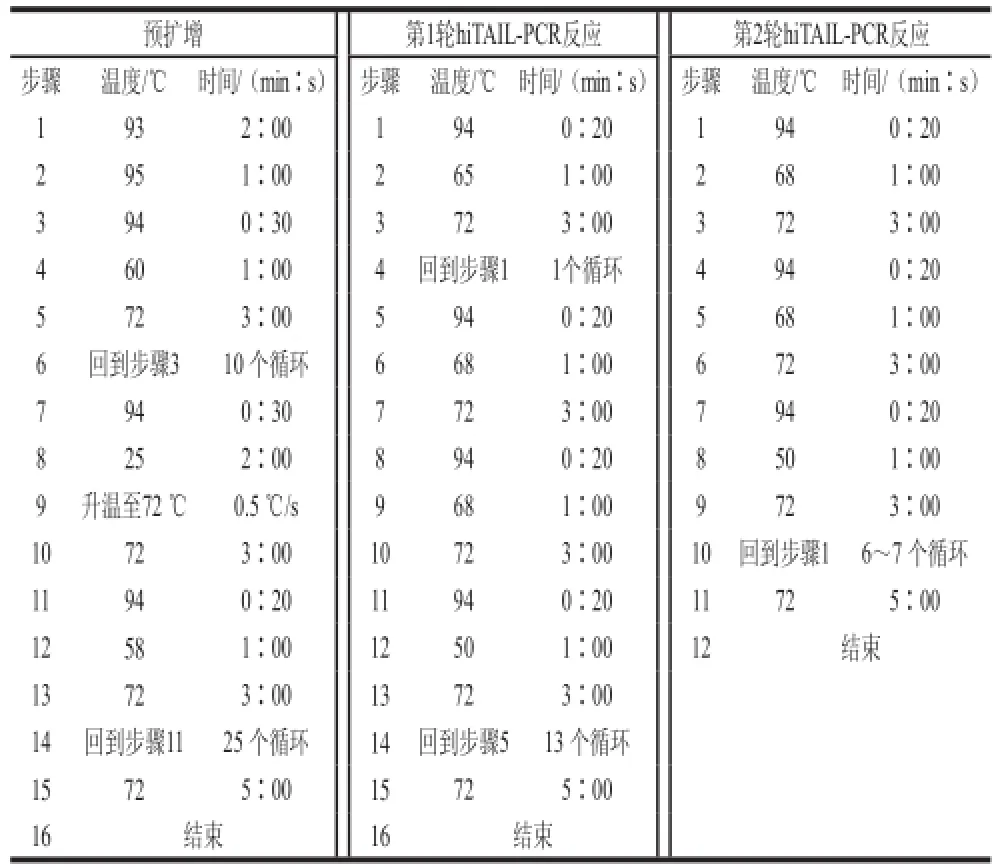
表2 hiTAIL-PCR循环条件Table 2 Thermal conditions for hiTAIL-PCR
1.3.2 构建表达载体pkk223-q及重组子的转化
使用primer5设计能够扩增高毒株EC150 q基因全长的引物,并在上游引物5’端加上EcoRⅠ的酶切位点,下游引物5’端加上HindⅢ的酶切位点。上游引物序列(5’→3’):GAATTCATACAC TGGCGATAAA,下游引物序列(5’→3’):AAGCTTATGCAGATTTTTAC GA,产物大小为509 bp。
PCR扩增反应体系为25 μL,其中dddH2O 18.3 μL,10×Ex Taq buffer 2.5 μL,2.5 mmol/L dNTP 2.0 μL, 10 μmol/L 上下游引物各 0.5 μL, Ex Taq酶0.2 μL,EC150 DNA 1.0 μL。PCR反应条件为:94 ℃ 5 min;94℃ 1 min,50 ℃ 30 s,72℃ 45 s,30 个循环;72 ℃ 10 min。灭菌三蒸水作为阴性对照。将PCR产物纯化备用。
将pkk223载体用EcoRⅠ和HindⅢ酶切,用1%琼脂糖凝胶电泳分离后进行切胶回收,将回收的目的条带与EC150 q基因PCR产物连接,得到重组载体pkk223-q,转化感受态细胞EC169和EC157,构建重组菌,菌落PCR验证阳性克隆[18]。
1.3.3 丝裂霉素C诱导细菌
将EC157、EC169及重组菌接种到LB液体培养基,向培养基加入氨苄青霉素(ampicillin,Amp)至终质量浓度为80 μg/mL,37 ℃、150 r/min培养过夜。取菌液1 mL加入到4 mL新鲜的LB液体培养基中, 37 ℃、150 r/min培养2 h。加入丝裂霉素C至终质量浓度0.5 μg/mL,37 ℃、150 r/min培养4 h。
1.3.4 反转录荧光定量PCR分析基因转录
采用RNAiso Plus试剂盒提取EC157、EC169及重组菌的RNA。去除基因组DNA后,用PrimerScript RT试剂盒反转录得到cDNA。采用SyBR Premix ExTaqTMⅡ试剂盒进行荧光定量PCR。反应体系为:12.5 μL的SyBR Premix ExTaqTMⅡ(2 M),上下游引物各1 μL,ROX Reference Dye(50×)0.5 μL,cDNA 1 μL,最后加RNase Free ddH2O至总体积为25 μL。以16S rRNA作为内参基因。q基因扩增上游引物为:CCGCAGTGCTGTGACGATGA,下游引物为:AATCCCCTCCGCTTTGTGAA。目的片段大小为189 bp。分别采用TaKaRa公司的EVS和EVT(RR105A)引物对扩增stx1和stx2基因。q、stx1、stx23 个基因的荧光定量PCR的反应体系和扩增条件相同。扩增反应具体条件为:95 ℃预变性10 s;95 ℃ 5 s,55 ℃ 15 s,72 ℃ 30 s,40 个循环,在每一循环的退火阶段收集荧光进行实时检测。反应结束后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s,记录荧光信号的变化,得出扩增产物的熔解曲线。
1.3.5 反向乳胶凝集(reverse passive latex agglutination,RPLA)实验
将EC169、EC157及重组菌接种于含80 μg/mL Amp的LB液体培养基中,37 ℃、150 r/min摇床过夜培养。取60 μL接种于3 mL新鲜CA-yE液体培养基中,36℃、130 r/min摇床培养2 h。向每管中加入异丙基-β-D-硫代半乳糖苷(终浓度为1 μmol/L)诱导毒素的表达,36 ℃、130 r/min摇床培养6 h。取3 mL菌液于离心管中900×g离心15 min,取上清即为RPLA检样。按VTEC-RPLA试剂盒说明书检测大肠杆菌志贺毒素滴度。
1.3.6 噬菌体的诱导
将EC157、EC169菌株接种于5 mL LB液体培养基中,37 ℃、150 r/min振荡培养至OD600nm=0.8,将其转入20 mL的LB液体培养基,并加入丝裂霉素C至终浓度为0.5 μg/mL,另设不加丝裂霉素C的组为对照。然后37 ℃、120 r/min继续振荡培养14 h,加入50 μL氯仿继续震荡培养15 min。紫外-可见分光光度计测其OD600nm值。
2 结果与分析
2.1 EC169 q-stx1区序列的hiTAIL-PCR扩增与克隆测序
以提取的EC169基因组DNA作为模板,将三轮扩增的产物进行电泳,通过在胶上观察第一轮和第二轮PCR产物条带相差的大小,是否与设计的SP2和SP3相差的大小一致来判断是否为目的条带。电泳检测结果如图2所示。用LAD1-3作为随机引物扩增时在2 000 bp和1 000 bp都出现了特异 性条带,并且两条条带的第3轮产物与第2轮产物的条带大小差值与预期的503 bp都吻合,由此可初步判断这两条条带均为目的条带。为了获得更长的stx1基因上游序列,将泳道 9中2 000 bp的条带进行切胶回收并克隆测序,得到了EC169 stx1基因上游序列。
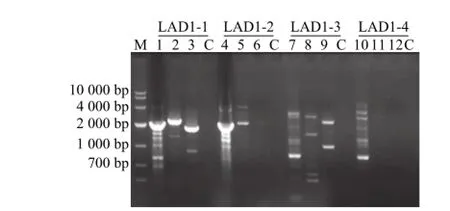
图2 EC169 q--stx1区 hiTAIL-PCR扩增结果Fig.2 hiTAIL-PCR products of q-stx1region in EC169
将测序得 到的stx1基因及其上游q基因序列用DNAstar软件进行序列拼接,并上传至NCBI GenBank数据库中,序列号为JQ327854.1。对EC169 stx1基因上游序列进行分析,晚期基因启动子PR’、终止子tR’及stx1基因启动子Pstx1均未发现突变。EC169的q基因与日本Sakai菌株相比有6 个SNP位点,相似性达98.6%。
2.2 反转录荧光定量PCR分析基因转录水平
由图3可知,经过丝裂霉素C诱导后,EC157重组菌和EC157的3个基因转录水平都存在差异。EC157重组菌q基因转录水平明显高于EC157,说明外源的q基因导入EC157重组菌后成功表达。EC157重组菌stx1和stx2基因转录水平均高于EC157,说明抗终止子Q蛋白在EC157重组菌中的高效表达,能促使stx基因的表达显著上调。

图3 EC157和EC157重组菌基因转录水平Fig.3 Relative mRNA transcription levels in EC157 and EC157 recombinant bacteria
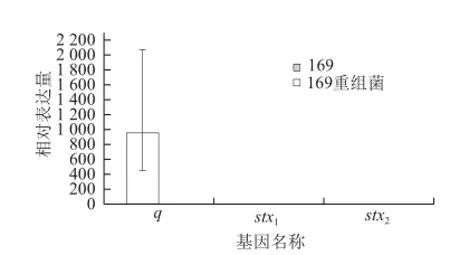
图4 EC169和EC169重组菌基因转录水平Fig.4 Relative mRNA transcription levels in EC169 and EC169 recombinant bacteria
由图4可知,经过丝裂霉素C诱导后, EC169重组菌中q基因转录水平较高,而未导入外源q基因的EC169 q基因没有mRNA的转录。EC169重组菌和EC169的stx1基因和stx2基因也没有mRNA的转录。说明外源q基因导入EC169后能高效表达,但并未激活下游stx1基因和stx2基因的表达。
2.3 RPLA实验结果
按VTEC-RPLA试剂盒说明书检测大肠杆菌志贺毒素,在明亮处垫上黑纸观察凝集现象。实验结果显示EC169、EC169重组菌志贺毒素1型和2型凝集价均小于1:2,说明志贺毒素产量很低无法检出。EC157志贺毒素1型和2型凝集价分别为1:16和1:32,EC157重组菌志贺毒素滴度均有所上升,志贺毒素1型和2型凝集价达到了1:32和1:64。
2.4 噬菌体的诱导
未经丝裂霉素C诱导的EC157、EC169菌液浑浊,诱导后的EC157菌液较澄清但仍有少量菌体。而EC169菌液仍然较浑浊。分别用紫外-可见分光光度计测其OD600nm值,未经诱导的EC157O的D600nm值为1.770,EC169 O的D600nm值为1.745。经丝裂霉素C诱导后EC157的OD600nm值为0.180,EC169的OD600nm值为1.553。
3 结 论
肠出血性大肠杆菌O157:H7作为一种危害性极大的致病菌已引起人们的重视,研究也日益深入,但大部分集中在检测和防控方面,志贺毒素调控机制的研究却相对较少[19-20]。Koitabashi等[14]对一株携带stx2基因但不产Stx2毒素的O157菌株Thai-12研究发现,Thai-12 Stx噬菌体为缺陷型,不能正常复制,无法诱导出游离噬菌体。但将标准株EDL933的q基因导入菌株Thai-12后,stx2表达量大幅提高。推断Q蛋白活性弱是导致Thai-12 stx2不能表达的主要原因之一[14]。
本实验对一株携带stx1基因但不产志贺毒素的肠出血性大肠杆菌O157:H7 EC169进行研究,结果发现EC169 q基因与sakai标准株q基因相比存在6个SNP位点,但stx1基因的启动子并未突变也没有缺失。据文献报道,丝裂霉素C可诱导大肠杆菌释放噬菌体,提高志贺毒素表达量[21]。将高毒株EC150 q 基因导入低毒株EC157和无毒株EC169,诱导后通过反转录荧光定量PCR和RPLA实验,检测各个基因的转录和表达水平。经过丝裂霉素C诱导,EC157重组菌的q、stx1和stx2基因的转录水平明显高于EC157,说明外源q基因在EC157重组菌中正常表达,并对下游stx基因转录的具有正调控作用。Mahesh等[22]也报道了高毒株中Stx噬菌体上的q基因与志贺毒素产量有相关性。
丝裂霉素C诱导后,EC169重组菌q基因转录水平显著高于EC169,说明外源q 基因在EC169重组菌中顺利表达,但仍然检测不到stx1基因和stx2基因的转录。RPLA实验进一步证实EC157重组菌中志贺毒素的表达量提高,而EC169重组菌中志贺毒素仍不能表达。噬菌体诱导实验证实EC157中噬菌体可被诱导,而EC169 噬菌体可能为缺陷型噬菌体。Koitabashi等[14]报道的Thai-12 Stx噬菌体为缺陷型,但导入外源q基因能大幅提高Thai-12菌株stx2基因表达量,本实验的菌株EC169则观察不到此类现象,推测Q蛋白变异可能不是EC169不表达志贺毒素的主要原因。
[1] CHANGH G H, TSERENPUNTSAG B, KACICA M, et al. Hemolytic uremic syndrome incidence in New York[J]. Emerging Infectious Diseases, 2004, 10(5): 928-931.
[2] BIDET P, MARIANI-KURKDJIAN P, GRIMONT F, et al. Characterization of Escherichia coli O157: H7 isolates causing haemolytic uraemic syndrome in France[J]. Journal of Medical Microbiology, 2005, 54(1): 71-75.
[3] LAW D. Virulence factors of Escherichia coli O157 and other Shiga toxin-producing E. coli[J]. Journal of Applied Microbiology, 2000, 88(5): 729-745.
[4] PHILLIPS C A. The epid emiology, detection and control of Escherichia coli O157[J]. Journal of the Science of Food and Agriculture, 1999, 79(11): 1367-1381.
[5] AHN C K, KLEIN E, TARR P I. Isolation of patients acutely infected with Escherichia coli O157: H7: low-tech, highly effective prevention of hemolytic uremic syndrome[J]. Clinical Infectious Diseases, 2008, 46(8): 1197-1199.
[6] WONG C S, JELACIC S, HABEEB R L, et al. The risk of the hemolytic-uremic syndrome after antibiotic treatment of Escherich ia coli O157: H7 infections[J]. New England Journal of Medicine, 2000, 342: 1930-1936.
[7] 陈洪章, 邹全明. 肠出血性大肠杆菌 (EHEC) O157: H7志贺毒素研究进展[J]. 中国人兽共患病学报, 2007, 23(1): 83-85.
[8] FENG P, LAMPEL K A, KARCH H, et al. Genotypic and phenotypic changes in the emergence of Escherichia coli O157: H7[J]. Journal of Infectious Diseases, 1998, 177(6): 1750-1753.
[9] CHAHED A. Survey of the contarnination of foodstuffs of amimal origin by shiga toxin producing Escherjchia coli serotype O157:H7 in Belgium from 1999 to 2003[J]. Euro Surveill, 2005, 10(3): 33-36.
[10] EZAWA A, GOCHO F, KAWATA K, et al. High prevalence of enterohemorrhagic Escherichia coli (EHEC) O157 from cattle in selected regions of Japan[J]. The Journal of Veterinary Medical Science, 2004, 66(5): 585-587.
[11] SCHMIDT H. Shiga-toxin-converting bacteriophages[J]. Research in Microbiology, 2001, 152(8): 687-695.
[12] WAGNER P L, JLIVNY, NEELY M N, et al. Bacteriophage control of Shiga toxin 1 production and release by Escherichia coli[J]. Molecular Microbiology, 2002, 44(4): 957-970.
[13] KOITABASHI T, CUI S, KAMRUZZAMAN M, et al. Isolation and characterization of the Shiga toxin gene (stx) bearing Escherichia coli O157 and non-O157 from retail meats in Shandong province, China, and characterization of the O157-derived stx2 phages[J]. Journal of Food Protection, 2008, 71(4): 706-713.
[14] KOITABASHI T, VUDDHAKUL V, RADU S, et al. Genetic characterization of Escherichia coli O157: H7/-strains carrying the stx2gene but not producing Shiga toxin 2[J]. Microbiology and Immunology, 2006, 50(2): 135-148.
[15] LI Rui, HARADA T, HONJOH K, et al. Phylogenetic analysis and Shiga toxin production profiling of Shiga toxin-producing enterohemorrhagic Escherichia coli clinical isolates[J]. Microbial Pathogenesis, 2010, 49: 246-251.
[16] 戴诗皎, 李睿, 刘志国, 等. 产志贺毒素突变株的毒力分析[J]. 中国酿造, 2010, 29(10): 145-147.
[17] LIU yaoguang, CHEN yuanling. High-eff i ciency thermal asymmetric interlaced PCR for amplifyication of unknown fl anking sequences[J]. BioTechniques, 2007, 43: 649-656.
[18] 萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 黄培堂, 王嘉玺,朱厚础, 等, 译. 3版. 北京: 科学出版社, 2002.
[19] JACOB M E, SHI Xiaorong, AN Baoyan, et al. Evaluation of a multiplex real-time polymerase chain reaction for the quantification of Escherichia coli O157 in cattle feces[J]. Foodborne Pathogens and Disease, 2012, 9(1): 79-85.
[20] yOSHITOMI K J, JINNEMAN K C, ZAPATA R, et al. Detection and isolation of low levels of E. coli O157: H7 in Cilantro by real-time PCR, immunomagnetic separation, and cultural methods with and without an acid treatment[J]. Journal of Food Science, 2012, 77(8): 481-489.
[21] KIMMITT P T, HARWOOD C R, BARER M R. Toxin gene expression by shiga toxin-producing Escherichia coli: the role of antibiotics and the bacterial SOS response[J]. Emerging Infectious Diseases, 2000, 6(5): 458-465.
[22] MAHESH N, GALEB S A, AVISHEK M, et al. Shiga toxin 2 overexpression in Escherichia coli O157:H7 strains associated with severe human disease[J]. Microbial Pathogenesis, 2011, 51(6): 466-470.
Effect of Protein Q on Shiga Toxin Expression in Enterohemorrhage Escherichia coli O157 Variant
LI Jia-wen1,2, ZHENG Dong-dong1, WANG Hong-xun3, LIU Zhi-guo1, YU Xiao-li1, ZHOU Guo-ping1, LI Rui1,*
(1. College of Biological and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Department of Pharmaceutical Engineering, Henan Medicine Technician College, Kaifeng 475000, China; 3. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
An enterohemorrhagic Escherichia coli (EHEC) O157: H7 strain EC169 carrying both stx1and stx2genes but not producing Shiga toxins was used in this study to investigate the reason for these characteristics. The stx1gene and its upstream region from EC169 were amplified by hiTAIL-PCR. Sequencing data showed that EC169 q gene had 6 single nucleotide polymorphism (SNP) sites compared with the corresponding region of the typical strain sakai. A highly virulent O157:H7 strain EC150 and a hypovirulent O157: H7 strain EC157 were tested in this study. The full length of EC150 q gene was amplified and connected to the expression vector pkk223. The recombinant plasmid was then transformed into EC169 and EC157, respectively. The qRT-PCR results showed that the pkk223-q vector was efficiently expressed in the two recombinant strains, respectively. qRT-PCR and RPLA results demonstrated that the level of Shiga-toxin expression was improved in EC157 recombinant strain, but its expression was not changed in EC169 recombinant strain. These results suggest that the SNP variation of protein Q might not be responsible for the non-expression of Shiga-toxins in EC169, suggesting that other mechanisms may be involved in controlling the expression of Shiga-toxins in EC169. This study might contribute to study the control and regulation of Stx phage.
E. coli O157: H7; protein Q; qRT-PCR; Shiga-toxin; hiTAIL-PCR
R378.2
A
1002-6630(2014)15-0151-05
10.7506/spkx1002-6630-201415031
2013-10-21
国家高技术研究发展计划(863计划)项目(2012AA101703-3);教育部留学回国人员科研启动基金项目(教外司留20111139);湖北省教育厅优秀中青年人才计划项目(Q20111710);武汉市科技局国际科技合作计划项目(2013030409020113)
李嘉文(1988—),男,硕士研究生,主要从事食品安全和食品微生物研究。E-mail:821483258@qq.com
*通信作者:李睿(1972—),女,教授,博士,主要从事食品安全和食品微生物研究。E-mail:liruiwuhan@163.com

