马铃薯抗性淀粉消化前后的益生作用与结构变化
谢 涛,张淑远,王美桂
(湖南工程学院化学化工学院,湖南 湘潭 411104)
马铃薯抗性淀粉消化前后的益生作用与结构变化
谢 涛,张淑远,王美桂
(湖南工程学院化学化工学院,湖南 湘潭 411104)
制备与纯化得到马铃薯抗性淀粉及消化抗性淀粉,研究其益生作用与结构变化。结果表明:马铃薯抗性淀粉及消化抗性淀粉对双歧杆菌和乳酸杆菌都有显著的增殖作用,对大肠杆菌和产气荚膜梭菌有强抑制作用,对粪肠球菌、梭状杆菌、兼性细菌没有影响;它们的发酵液总酸度增大,说明它们能被肠道益生菌发酵利用;马铃薯抗性淀粉经消化处理后比表面积增加,经发酵后比表面积更大;马铃薯抗性淀粉的平均聚合度较之原淀粉显著变小,马铃薯抗性淀粉或消化抗性淀粉发酵后的平均聚合度降低;马铃薯抗性淀粉经消化前后的晶型均为B型,其抗性淀粉及消化抗性淀粉发酵后的晶型都转变为A型,微晶度、亚微晶度及总结晶度较之发酵前都明显降低。
马铃薯;抗性淀粉;益生作用;结构变化
抗性淀粉作为一种新型的益生元制剂,具有来源广泛、制备工艺简单、口感好等优点,在国外已被广泛研究[1-4]。近些年来许多学者将研究的视角转向了非粮淀粉资源[5-6]。国内外已有许多关于马铃薯抗性淀粉的研究,但大多数研究主要集中在对其制备工艺的优化方面[7-9],而针对马铃薯抗性淀粉特别是其消化抗性淀粉的生物活性的研究,尚未引起国内外学者的普遍关注[10-12]。
本实验采用二次循环压热法制备并纯化得到了马铃薯抗性淀粉,再经人工胃液和人工胃肠液处理制得2 个消化抗性淀粉样品,然后研究了这3 个样品的益生作用及其结构变化,以期探讨消化前后的抗性淀粉在益生作用过程中可能的结构变化及更多的功能。
1 材料与方法
1.1 培养基与试剂
选择性培养基:麦康凯琼脂培养基(大肠杆菌)、甘露醇氯化钠琼脂培养基(双歧杆菌)、LAMVAB琼脂培养基(乳酸杆菌)、麦芽糖琼脂培养基(粪肠球菌)、亚硫酸盐-环丝氨酸琼脂培养基(梭状杆菌)、甘露醇琼脂培养基(产气荚膜梭菌)、需氧-厌氧菌琼脂培养基 美国Life Tech公司。
耐热α-淀粉酶、糖化酶、胃蛋白酶、胰酶-5.0 美国Sigma公司;其他试剂均为分析纯。
1.2 抗性淀粉的制备与纯化
制备:用蒸馏水配制质量分数30%的淀粉乳液,调节pH 6.0,沸水浴30 min后,121 ℃高温高压处理4 0 min。冷却,4 ℃放置24 h。重复高温高压和冷却步骤,80 ℃烘干,粉碎过100 目筛得粗抗性淀粉。
纯化:取粗抗性淀粉用耐热α-淀粉酶在70 ℃水解1 h,加入过量糖化酶,55 ℃水解2 h,离心(3000 r/min、30 min),水洗离心多次,最后用体积分数95%乙醇的清洗、干 燥、粉碎,过200 目筛,得纯抗性淀粉(resistant starch,RS)。
1.3 胃液、胃肠液消化抗性淀粉的制备
[13]的方法制备人工胃液和人工胃肠液消化抗性淀粉,分别简称为DRSAGJ、DRSAGIJ。
1.4 体外厌氧发酵
1.4.1 培养基
改良MRS培养基:以质量分数2%的抗性淀粉或消化抗性淀粉取代MRS培养基中的葡萄糖作为碳源,以2%马铃薯原淀粉作为对照。选择性培养基:同1.1节。
1.4.2 厌氧发酵
取23~31 岁健康男子(此前至少3 个月未注射抗生素,没有预先服用已知的益生元或益生菌,没有胃肠病史)的粪便,将粪便用磷酸盐缓冲溶液制成均匀的悬浊液。取12 个50 mL的锥形瓶,设3 个平行,每个装入20 mL改良MRS培养基,于121 ℃、105Pa灭菌20 min后,每个锥形瓶接入等量已多次用MRS培养基活化的粪便培养物,密封,37℃厌氧培养至10、20、30 h分别取样,用于肠道微生物菌群组成和总酸度的测定分析。
1.4.3 肠道菌群分析
取样品液1 mL,用生理盐水稀释一定倍数后涂布于选择性平板上,于37 ℃需/厌氧培养48~72 h后,使用全自动菌落分析仪计数。
1.4.4 发酵液总酸度测定
参照GB/T 12456—2008 《食品中总酸的测定》法测定每份发酵液的总酸度,并以乳酸含量表示。
1.4.5 发酵残余物制备
取10 mL发酵液,离心(15 min、3 000×g),沉淀用10 mL蒸馏水清洗3次后烘干,粉碎过100目筛,这些发酵残余物分别称为发酵抗性淀粉(fermented resistant starch,FRS)、发酵胃液消化抗性淀粉(FDRSAGJ)和发酵胃肠液消化抗性淀粉(FDRSAGIJ)。
1.5 结构测定
平均聚合度(DP值)测定采用碘吸收法[14];扫描电子显微分析参照文献[15]的方法测定;X射线衍射分析参照文献[16]的方法。
1.6 数据分析
所有数据为3个平行实验的平均值,且采用SPSS 20.0进行方差分析。
2 结果与分析
2.1 马铃薯抗性淀粉及消化抗性淀粉对肠道菌群生长的影响
马铃薯抗性淀粉及胃肠液消化抗性淀粉对肠道菌群生长的影响见表1。发酵至第30小时各种肠道微生物生长已处于衰老期,导致活细胞数目减少。当发酵到20 h后,马铃薯抗性淀粉及其胃肠液消化抗性淀粉对双歧杆菌和乳酸杆菌都有显著的增殖作用,对大肠杆菌和产气荚膜梭菌的抑制作用极显著,对粪肠球菌、梭状杆菌无影响。马铃薯胃肠液消化抗性淀粉比其抗性淀粉对双歧杆菌、乳酸杆菌增殖效果更明显,对产气荚膜菌的抑制作用也更强些,说明抗性淀粉经消化道环境的作用是其发挥益生作用所必需的,即消化抗性淀粉具有更好的益生作用,这与文献[10,12]报道的结果非常一致。

表1 马铃薯抗性淀粉及消化抗性淀粉对肠道菌群生长的影响Table 1 Effects of potato resistant starches before and after digestion on intestinal bacteria lg(CFU/mL)
2.2 发酵液的酸度分析

表2 马铃薯抗性淀粉及消化抗性淀粉发酵液的总酸度(以乳酸表示)Table 2 Total acidities of fermentation liquids from resistant starches before and after digestion (expressed as lactic acid) g/L
发酵液的总酸度在一定程度上代表了益生菌,尤其是双歧杆菌和乳酸杆菌的增殖情况,双歧杆菌和乳酸杆菌的增殖会促进丙酸、丁酸、乳酸等合成[17]。表2为添加不同马铃薯抗性淀粉和胃肠液消化抗性淀粉发酵后的总酸度(以乳酸质量浓度表示)。从表2可知,马铃薯抗性淀粉及消化抗性淀粉的发酵液总酸度均比对照值要高(P<0.01),说明抗性淀粉及消化抗性淀粉有利于产生更多的短链脂肪酸,而且后者 产生的要多些,这在文献[18]中也有报道。
2.3 发酵前后马铃薯抗性淀粉及消化抗性淀粉的超微结构变化

图1 发酵前后马铃薯抗性淀粉及消化抗性淀粉的超微结构(3 000×)Fig.1 Ultrastructures of resistant starch and digested resistant starch before and after fermentation (3 000 ×)
由图1可知,经压热制备的马铃薯抗性淀粉颗粒是层与层堆积而成的叠层结构,表面粗糙;这是因为受压热处理后的淀粉分子在冷却过程中,直链淀粉分子相互靠近形成新的双螺旋并沉降,而且纯化作用加速了无定形部分的酶解,剩下高度结晶的直链淀粉。马铃薯抗性淀粉经人工胃液消化后,由于强酸侵蚀作用,叠层结构上出现大小、长短不一的裂缝,开始崩裂解体(图1B)。而后经人工胃肠液联合作用,叠层结构崩解成大小不一、散乱堆积的片层(图1C)。马铃薯抗性淀粉经发酵后,单一的叠层结构崩解,每层裂解成大小不一的片层(图1D)。人工胃液消化的马铃薯抗性淀粉经发酵后,叠层结构最终崩解成大小不一、散乱堆积的片层(图1E)。而人工胃肠液消化的抗性淀粉发酵后,散乱堆积的片层继续裂解,更小的片层堆积方式更加有序(图1F)。
2.4 发酵前后抗性淀粉、消化抗性淀粉的平均聚合度变化
由表3可知,马铃薯抗性淀粉的λmax和DP值都比其原淀粉的小,特别是DP值发生了显著变化。这是由于压热处理使部分直链淀粉分子断裂,支链淀粉的部分支链断裂转化为直链淀粉,故而抗性淀粉的DP值要比其原淀粉的小;同时直链淀粉分子越大,越容易断裂。消化前后的马铃薯抗性淀粉的DP值几无变化,说明消化作用主要影响抗性淀粉分子的微观结构。发酵后马铃薯抗性淀粉或消 化抗性淀粉较之发酵前的DP值出现了较显著的下降。再有,经胃肠液消化过的马铃薯抗性淀粉经发酵后的DP值比其发酵抗性淀粉经的DP值减小,由此进一步说明胃肠液的消化作用对抗性淀粉在肠道内的益生作用是必要的,表2和图2也证明了这一点。

表3 马铃薯抗性淀粉及消化抗性淀粉发酵前后的平均聚合度Table 3 Average degree of polymerization of resistant starch and digested resistant starch before and after fermentation
2.5 发酵前后抗性淀粉、消化抗性淀粉的结晶度变化
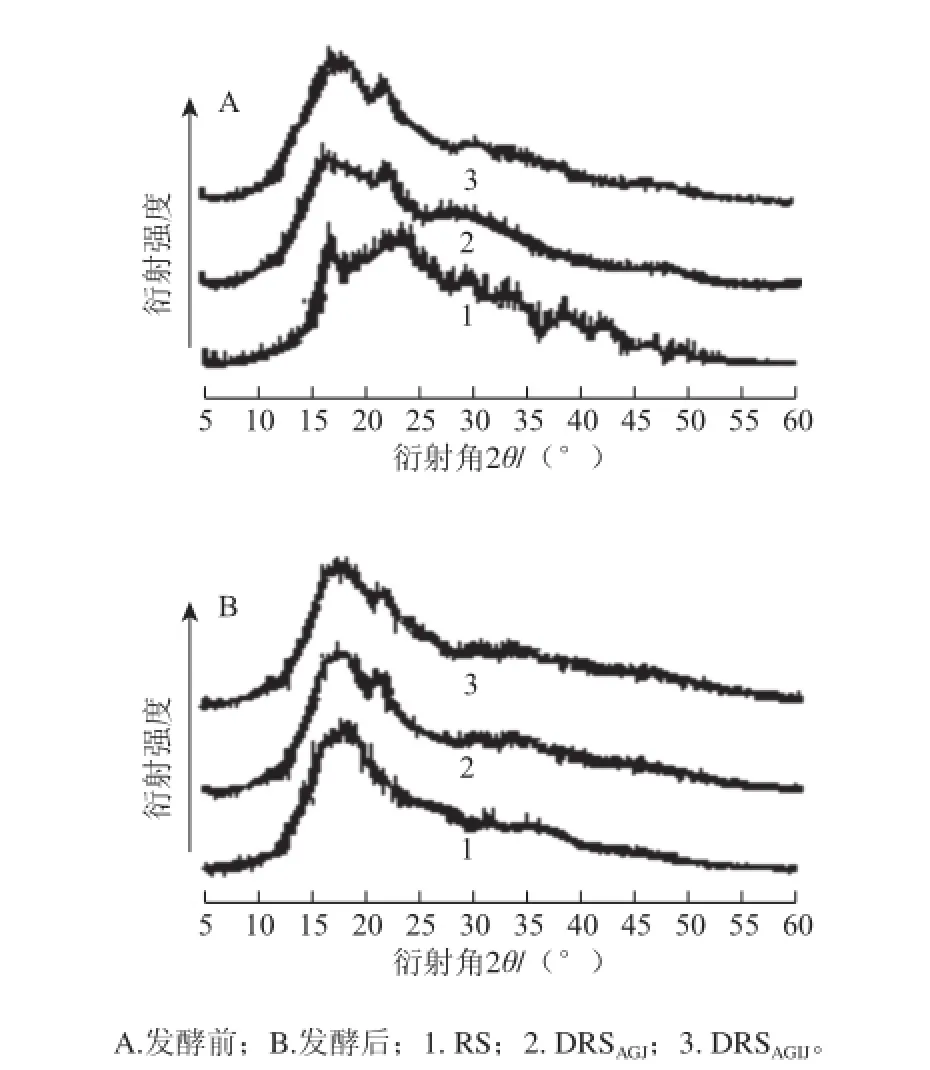
图2 马铃薯抗性淀粉及消化抗性淀粉发酵前后的X射线衍射图谱Fig.2 X-ray diffraction pat terns of resistant starch and digested resistant starches before and after fermentation
淀粉是主要由A型和B型晶体及少量V型晶体组成的混合物。由图2、表4可知,马铃薯抗性淀粉的晶型为B型,说明在制备抗性淀粉的过程中,其分子链通过断裂、重组,形成了更为稳定的晶体结构。马铃薯抗性淀粉经胃液或胃肠液消化后的晶型仍为B型,与抗性淀粉相比,胃液消化抗性淀粉的微晶度、亚微晶度及总结晶度基本没有变化,但胃肠液消化抗性淀粉亚微晶度与总结晶度有较大降低,说明经过人工胃液的强酸侵蚀与分散作用,增强了人工肠液的消化作用。马铃薯抗性淀粉及其消化抗性淀粉经发酵后,晶型都转变为A型,微晶度、亚微晶度及总结晶度较之发酵前都显著降低,说明发酵作用对马铃薯抗性淀粉及消化抗性淀粉的结晶结构有较大影响。
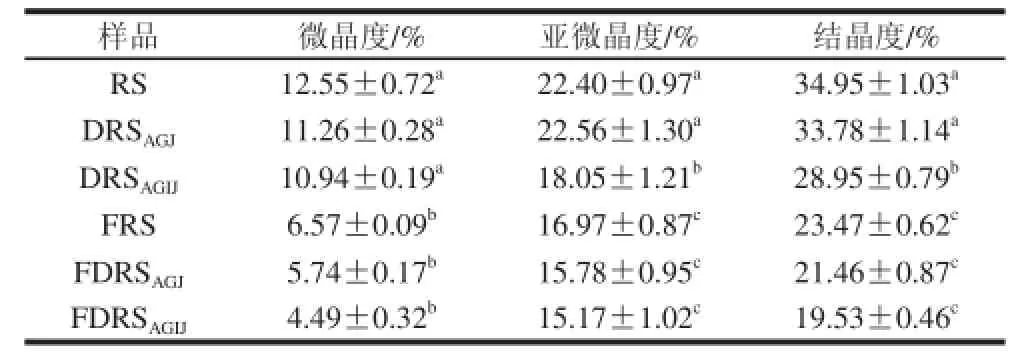
表4 马铃薯抗性淀粉及消化抗性淀粉发酵前后的结晶参数Table 4 Crystallization parameters of resistant starch and digested resistant starches before and after fermentation
3 结 论
马铃薯抗性淀粉及消化抗性淀粉对双歧杆菌和乳酸杆菌都有显著的增殖作用,对大肠杆菌和产气荚膜梭菌有强抑制作用,对粪肠球菌、梭状杆菌、兼性细菌无明显影响。它们的发酵液总酸度增大,说明它们被肠道益生菌发酵利用产生了更多的短链脂肪酸。
马铃薯抗性淀粉经人工胃液、胃肠液消化处理后结构越来越疏松,且比表面积增加;马铃薯抗性淀粉及其消化抗性淀粉经发酵后,它们进一步裂解为以细小片层为主体的可能具有更大比表面积和堆积密度的结构,这种结构变化可能与抗性淀粉在肠道中发挥的其他生理功能有关。
马铃薯抗性淀粉的DP值较之原淀粉显著变小。消化前后马铃薯抗性淀粉的DP值基本没有变化,说明胃肠液主要作用于抗性淀粉的微观结构。胃肠液消化过的马铃薯抗性淀粉经发酵后的DP值比马铃薯抗性淀粉经发酵后的DP值要小。
马铃薯抗性淀粉经胃液或胃肠液消化前的晶型均为B型,胃肠液消化抗性淀粉亚微晶度与总结晶度有所降低。马铃薯抗性淀粉及消化抗性淀粉经发酵后,晶型都转变为A型,微晶度、亚微晶度及总结晶度较之发酵前都明显降低。
参考文献:
[1] FUENTES-ARAGOZAE E, RIQUELME-NAVARRETE M J, SÁNCHEZ-ZAPATA E, et al. Resistant starch as functional ingredient: a review[J]. Food Research International, 2010, 43(4): 931-942.
[2] 郭秀兰, 唐仁勇. 抗性淀粉营养特性及生物学作用的研究进展[J].食品研究与开发, 2011, 32(10): 165-169.
[3] PERERA A, MEDA V, TYLER R T. Resistant starch: a review of analytical protocols for determining resistant starch and of factors affecting the resistant starch content of foods[J]. Food Research International, 2010, 43(5): 1959-1974.
[4] ANTHONY C D, GUILHEM P, ROBERT G G, et al. Digestion of starch: in vivo and in vitro kinetic models used to characterize oligosaccharide or glucose release[J]. Carbohydrate Polymers, 2010, 80(2): 599-617.
[5] JIRANUNTAKUL W, PUTTANLEK C, RUNGSARDTHONG V, et al. Microstructural and physicochemical properties of heat-moisture treated waxy and normal starches[J]. Journal of Food Engineering, 2011, 104(2): 246-258.
[6] SANKHON A, YAO W R, WANG H Y, et al. The yield of improvement of resistant starches from Africa Locust (Parkia biglobosa): the influence of heat-moisture, autoclaving-cooling and cross-linking treatments[J]. American Journal of Food Technology, 2012, 7(7): 386-397.
[7] 曹力心. 马铃薯抗性淀粉的制备工艺及活性研究[D]. 天津: 天津科技大学, 2006.
[8] 连喜军, 王吰, 刘旭. α-淀粉酶水解马铃薯淀粉制备抗性淀粉[J]. 粮食与油脂, 2009, 15(8): 11-14.
[9] 王振强, 申森, 樊欣. 马铃薯抗性淀粉压热制备性质[J]. 湖北农业科学, 2012, 51(10): 2085-2088.
[10] LOPEZ-RUBIO A, FLANAGAN B M, GILBERT E P. Molecular rearrangement of starch during in vitro digestion: toward a better understanding of enzyme resistant starch formation in processed starches[J]. Biomacromolecules, 2008, 9(7): 1951-1958.
[11] MUTUNGI C, ONYANGO C, ROST F, et al. Structural and physicochemical properties and in vitro digestibility of recrystallized linear α-D-(1→4) glucans derived from mild-acid modified cassava starch[J]. Food Research International, 2010, 43(4): 1144-1154.
[12] MUTUNGI C, OOYANGO C, DOERT T, et al. Long- and short-range structural changes of recrystallised cassava starch subjected to in vitro digestion[J]. Food Hydrocolloids, 2011, 25(2): 477-485.
[13] 曾红华, 谢涛, 杨莉, 等. 几种薯类与豆类抗性淀粉的抗消化性及其益生效应[J]. 中国粮油学报, 2012, 27(11): 31-33.
[14] TAKEDA C, TAKEDA Y, HIZUKURI S. Physicochemical properties of lily starch[J]. Cereal Chemistry, 1983, 60(1): 212-216.
[15] SUSHIL D, ASHOK K S, MICHAEL J G. Effect of cryo-milling on starches: functionality and digestibility[J]. Food Hydrocolloids, 2010, 24(1): 152-163.
[16] 谢涛, 张淑远, 王美桂, 等. 重结晶红薯淀粉体外消化前后益生作用与结构变化[J]. 农业机械学报, 2013, 44(8): 203-208.
[17] MARZORATI M, VERHELST A, LUTA G, et al. in vitro modulation of the human gastrointestinal microbial community by plant-derived polysaccharide-rich dietary supplements[J]. International Journal of Food Microbiology, 2010, 139(3): 168-176.
[18] 谢涛, 张儒. 锥栗直链淀粉-脂肪酸复合物的体外消化及益生元活性[J].中国粮油学报, 2012, 27(8): 20-23.
Probiotic Functions and Structural Changes of Potato Resistant Starch before and after Digestion
XIE Tao, ZHANG Shu-yuan, WANG Mei-gui
(College of Chemical Engineering, Hunan Institute of Engineering, Xiangtan 411104, China)
Potato resistant starches before and after in vitro digestion were made and purif i ed. Their probiotic functions and structural changes were intensively studied. The results demonstrated that the undigested and digested resistant starches had good proliferative effects on bif i dobacterium and lactobacillus, but inhibitory effects on Escherichia coli and Clostridium perfringens, and no inf l uence on Enterococcus faecalis, Corynebacterium fusifome or facultative bacteria. The increase in total acidity after fermentation demonstrated that both these resistant starches could be utilized by intestinal probiotics. After digestion, the resistant starch had increased specif i c surface area, which was further increased after in vitro anaerobic fermentation. In comparison with the native starch, average degree of polymerization of the resistant starch was decreased signif i cantly and along with the digested resistant starch, was further reduced after fermentation. Both the resistant starch and its digestion product in vitro were type-B crystals. After fermentation, the crystal type became type A, and the degrees of microcrystallization and submicrocrystallization as well as total crystallinity were obviously decreased compared with those measured before fermentation.
potato; resistant starch; probotic function; structural change
TS235.2
A
1002-6630(2014)15-0105-04
10.7506/spkx1002-6630-201415021
2013-10-21
湖南省自然科学基金项目(2011JJ6009);国家级大学生创新创业训练计划项目(201211342014)
谢涛(1970—),男,教授,博士,主要从事再生资源与食品、生物化工研究。E-mail:xt1105@aliyun.com

