脊尾白虾酚氧化酶原基因克隆及表达分析*
李 洋 刘 萍 李 健 李吉涛 马 朋 高保全 段亚飞
(1.中国水产科学研究院黄海水产研究所 青岛 266071;2.大连海洋大学 大连 116023;3.上海海洋大学 上海 201306)
脊尾白虾(Exopalaemon carinicauda)又名白虾、小白虾、五须虾、青虾等,隶属于节肢动物门(Arthropoda)、甲壳纲(Curstacea)、十足目(Decapoda)、长臂虾科(Palaemonidae)、白虾属(Exopalaemon),属于热温带海区底栖虾类,尤以黄、渤海产量最高(刘瑞玉,1955)。因脊尾白虾具有生长快、繁殖强和适应性广等优点,随着沿海滩涂的开发利用,特别是近年来脊尾白虾养殖面积不断扩大,已成为池塘单养、鱼虾贝类混养和虾池秋冬季养殖的重要品种(王兴强等,2005)。
酚氧化酶(penoloxidase,PO)是一种广泛分布于动植物、微生物中含有铜离子结合位点的氧化酶,在分子氧作用下将酚类氧化成邻苯醌,醌类可抑制微生物的感染并参与到宿主的防御反应中(白霜等,2008)。而酚氧化酶一般情况下以无活性的酶原形式—酚氧化酶原(prophenoloxidase,proPO)存在,proPO通过酚氧化酶级联反应转化成具有活性的 PO(Nappiet al,2005)。酚氧化酶原激活系统由proPO、PO、丝氨酸蛋白酶、丝氨酸蛋白酶抑制剂以及一些模式识别蛋白所构成,在整个非特异性免疫机制中起到非常重要的作用并发挥多种功能(Cereniuset al,2004)。目前为止,proPO基因已经从罗氏沼虾Macrobarchium rosenbergii(DQ182596)、斑节对虾Penaeus monodon(AF521948)、中国对虾Fenneropenaeus chinensis(EU 015060)、凡纳对虾Litopenaeus vannamei(AY723296)、日本对虾Marsupenaeus japonicus(AB065371,AB073223)、短钩对虾Penaeus semisculcatus(AF521949)、美国龙虾Homarus americanus(AY655139)、欧洲龙虾Homarus gammarus(AJ581662)等虾类动物上克隆得到,所有的 proPOs均包含两个铜离子结合位点,一段保守的区域和一个蛋白水解激活位点,但是均缺乏信号肽。但是关于脊尾白虾proPO基因的研究还未见报道。
大量研究表明,养殖环境变化尤其是盐度突变会削弱水产动物的免疫系统中酚氧化酶的活性(Vargas-Alboreset al,1998;Danielet al,2006;Bindhuet al,2007;Liet al,2010)。近年来脊尾白虾的低盐驯化和养殖已经广泛开展,而盐度变化对脊尾白虾免疫功能的影响机理尚不清楚。因此,本研究克隆了脊尾白虾酚氧化酶原基因,利用荧光定量 PCR方法分析其组织表达分布,并分析了盐度变化对酚氧化酶原基因表达的影响,以期为脊尾白虾健康养殖提供理论依据和参考。
1 材料与方法
1.1 实验材料
实验所用脊尾白虾来自昌邑海丰水产养殖有限责任公司,选取体长在(4.50±0.50)cm的健康活虾,实验前于200L的PVC桶中暂养一周时间,水温21°C,盐度32,pH8.0,连续充气,早晚各投喂混合饵料一次。
盐度胁迫实验
设置盐度梯度为 4、11、18、25、32、39、46;取样时间设定为 0、2、4、8、16、24、32、48、72h。每个梯度设置3个平行,每桶135只脊尾白虾,取样时每个时间点每个平行组取15只虾进行血淋巴和鳃组织样品采集,每 5只虾的样品合并到一个采样管中。鳃组织样品取完后立刻放入液氮罐中,血液样品800g 4°C离心10min取血细胞加入Trizol(Invitrogen)后放入液氮罐中保存。
1.2 实验方法
1.2.1 脊尾白虾总RNA提取及cDNA的合成 采集脊尾白虾不同组织样品,液氮研磨,每 50mg组织中加1ml Trizol,提取总RNA,所得总RNA使用紫外分光光度计定量检测,用 1.5%琼脂糖凝胶电泳确认其完整性,保证所提总 RNA质量高,可以满足后续实验要求。用RQ1 RNase-free DNase(Promega)消化总RNA样品中残留的DNA。脊尾白虾cDNA合成体系(25μL)为:1μL(1μg/μL)消化处理后的RNA,Oligo d(T)2.5μL,H2O 5μL,72°C 水浴 5min,–80°C 冰浴 2min,5μL 5×缓冲液,1.25μL dNTP(10mmol/L),0.625μL RNase抑制剂,1.25μL M-MLV逆转录酶,DEPC(焦碳酸二乙酯)水4.375μL。轻轻混匀,离心,42°C保温1h,70°C保温15min。所得产物–20°C保存备用。
1.2.2 脊尾白虾酚氧化酶原基因 cDNA片段的克隆参照 GenBank上已公布的酚氧化酶原基因序列:日本囊对虾(Marsupenaeus japonicus)(AB073223)、中华绒螯蟹(Eriocheir sinensis)(EF493829)、美洲螯龙虾(Homarus americanus)(AY655139)以及龙虾(Homarus gammarus)(AJ581662),采用 Clustalx软件进行对比,进行兼并引物设计proPOF、proPOR(见表1),引物由生工生物工程(上海)股份有限公司合成。

表1 实验中所用的引物序列Tab.1 Primer sequences used in this study
以脊尾白虾血细胞cDNA为模板进行扩增,其反应体系如下(25μL):cDNA 1μL,10×缓冲液 2.5μL,MgCl21.5μL,dNTP 0.5μL,proPOF 2.5μL,proPOR 2.5μL,Taq DNA 聚合酶 0.25μL。反应程序:95°C 变性5min,1个循环;94°C变性30s,55°C退火30s,72°C延伸30s,28个循环;72°C延伸10min,1个循环;4°C保存。所得 PCR扩增产物经琼脂糖凝胶电泳验证扩增结果及片段大小,使用 DNA胶回收试剂盒进行胶回收纯化,与 pMD18-T载体进行连接,重组质粒转化至 Top10感受态细胞,挑选阳性克隆经 PCR验证由生工生物工程(上海)股份有限公司测序。
1.2.3 proPO 基因的 3′RACE 和 5′RACE 扩增 以测序所得proPO基因片段为模板设计3′和5′RACE所需引物 proPO 3′race1、proPO 3′race2、proPO 5′race1、proPO 5′race2(见表1),使用 SMARTTMRACE 试剂盒说明进行3′和5′RACE扩增,反应条件如下:94°C变性5min,1个循环;94°C变性30s,72°C延伸3min,5个循环;94°C变性30s,70°C退火30s,72°C延伸3min,5个循环;94°C变性 30s,68°C退火 30s,72°C延伸3min,25个循环;72°C延伸10min,1个循环;4°C保存。扩增产物回收纯化,克隆、测序。
1.2.4 序列拼接与生物信息学分析 测序结果使用NCBI网站提供的VecScreen工具进行载体去除与序列拼接(http://www.ncbi.nlm.nih.gov/VecScreen/VecScreen.html),拼接所得序列使用 NCBI提供的BLAST程序进行比对(http://blast.ncbi.nlm.nih.gov/Blast/),利用 DNAMAN 软件进行蛋白质的翻译,利用EditSeq程序进行开放阅读框的预测。利用SMART和 Interpro Scan软件进行蛋白质功能域及结构域的预测与分析,分别利用Clustalx和MEGA进行多重序列比对和系统进化树构建。
1.2.5 荧光定量PCR方法分析proPO组织表达和盐度胁迫后的表达变化 提取脊尾白虾血细胞、鳃、肝胰腺和肌肉中的总 RNA,分别合成 cDNA,以 proPO基因的 cDNA序列为模板,设计引物 proPO HF和proPO HR(见表1),根据已公布的脊尾白虾线粒体RNA设计一对内参引物18S HF和18S HR(见表1)利用定量RT-PCR方法进行组织表达检测。RT-PCR扩增体系(20μL)为:SYBR Premix Ex TaqTMⅡ(2×),10μL;PCR Forward Primer(10μmol/L),0.8μL;PCR Reverse Primer(10μmol/L),0.8μl;ROX Reference Dye Ⅱ(50×)*3,0.4μL;DNA 模板,0.6μL;dH2O,7.4μL。反应程序为:95°C 30s;95°C 5s,60°C 34s,40 个循环;95°C 15s,60°C 1min,95°C 15s。每份样品做 3 组平行,结果采用2–△△Ct法进行分析。以不同盐度处理组的脊尾白虾血淋巴和鳃总 RNA为模板,合成 cDNA,利用RT-PCR方法进行proPO在盐度胁迫下表达变化特征的检测。
2 结果与分析
2.1 脊尾白虾proPO基因cDNA全长的克隆与序列分析
所提总RNA质量较高(图1a),以反转录cDNA为模板,扩增获得长约400bp的中间片段(图1b)。利用3′和5′RACE分别获得一条长约1500bp和1200bp的特异性条带(图1c)。

图1 脊尾白虾电泳图谱Fig.1 The electrophoretogram of E.carinicauda
脊尾白虾proPO基因cDNA全长3092 bp。利用EditSeq程序分析,其开放阅读框(ORF)为2013bp,编码671个蛋白质,其5′端和3′端各包含64bp和1015bp的非编码区,且包括1个polyA尾结构、1个加尾信号AATAAA结构和与Cu结合的氨基酸残基特征序列(图2)。该基因所编码的蛋白推导分子量为 74.82kDa,理论等电点为6.23。使用SMART工具进行分析,脊尾白虾酚氧化酶原基因蛋白含有 3个串联的血蓝蛋白结构域分别为 Hemocyanin-N 结构域(43—120)、Hemocyanin-M结构域(124—396)和Hemocyanin-C结构域(402—666)(图3)。脊尾白虾 proPO 基因 cDNA序列已提交GenBank(登录号:JQ812983)。
2.2 同源序列比对及构建系统进化树
通过NCBI网站提供Blast软件对编码甲壳动物酚氧化酶原基因的氨基酸序列进行比对(图4),该序列与罗氏沼虾(Macrobrachium rosenberqii,DQ182596)同源性为 78%、与凡纳滨对虾(Litopenaeus vannamei,EF565469)同源性为 66%、与斑节对虾(Penaeus monodon,AF521948)、中国对虾(Fenneropenaeus chinensis,EU015060)、南美短沟白对虾(Penaeus semisulcatus,AF521949)的同源性均为65%。利用MEGA4.0软件对所比对的proPO氨基酸序列进行系统树构建如图5,其中脊尾白虾与罗氏沼虾、中华绒螯蟹聚为一个亚群,中国对虾、凡纳滨对虾、斑节对虾等聚为一个亚群,表明酚氧化酶原基因在进化过程中具有较高的保守性。
2.3 脊尾白虾proPO基因在各组织中的表达分布
利用RT-PCR技术对脊尾白虾各组织中porPO的表达量进行分析(图6),proPO的表达量在血淋巴中最高,其次为鳃和肝胰腺,在肌肉中的表达量最低。
2.4 脊尾白虾盐度胁迫后血淋巴和肝胰腺proPO表达变化情况
不同盐度胁迫后各组织 proPO的变化特征如图7,在血细胞中,proPO表达量随着盐度胁迫时间的延长逐渐升高,至24h时各处理组proPO基因表达量均达到最高,且与对照组 proPO基因表达量差异显著(P<0.05),胁迫48h后对照组与各处理组proPO基因表达量差异不显著(P>0.05),趋于稳定。
盐度胁迫后proPO基因在鳃中的表达变化如图8所示,低盐度处理组(盐度 4、11、18、25)在胁迫后2h proPO基因表达量达到最高,且与对照组和高盐度处理组 proPO基因表达量差异显著(P<0.05),随后逐渐下降;而高盐度处理组(盐度39、46)在胁迫后8h和24h proPO基因表达量出现2次波动,且与对照组差异显著(P<0.05),随后各处理组 proPO基因表达量逐渐恢复至正常水平。
3 讨论

图2 脊尾白虾proPO基因的cDNA核苷酸序列及其预测的氨基酸序列Fig.2 cDNA sequence and deduced amino acid sequence of prophenoloxidase gene in E.carinicauda

图3 脊尾白虾酚氧化酶原中三个血蓝蛋白结构域Fig.3 Distribution of three tandem hemocyan in domains of proPO from E.carinicauda

图4 脊尾白虾proPO氨基酸序列与其他物种proPOs氨基酸序列比较Fig.4 Amino-acid sequence alignment of E.carinicauda proPO with different animals propos

图5 利用MEGA4软件NJ法构建的proPO系统进化树Fig.5 NJ tree based on proPO amino acid sequences using MEGA 4
甲壳动物酚氧化酶在免疫反应时通过黑化作用的形式参与宿主的防御反应(Ashidaet al,1990)。酚氧化酶一般情况下以无活性的酶原形式存在即酚氧化酶原proPO,proPO通过酚氧化酶级联反应转化成具有活性的 PO,酚氧化酶原激活系统在非特异性免疫系统中起着非常重要的作用(Soderhallet al,1998)。近年来,人们认识到酚氧化酶原激活系统在环境应激反应中也具有重要的作用,对于酚氧化酶原基因的克隆及表达方面进行了大量的研究。三疣梭子蟹Portunus trituberculatus、中华绒螯蟹Eriocheir sinensis、锯缘青蟹Scylla serrata、短沟对虾P.semisculcatus、罗氏沼虾M.rosenbergii、日本对虾M.japonicus等甲壳动物酚氧化酶原基因已经被克隆得到(叶星等,2003;Liuet al,2006;Koet al,2007;Gaiet al,2008;Chenet al,2010;孙杰等,2010)。本研究通过同源克隆方法得到脊尾白虾酚氧化酶原基因的全序列,该基因cDNA全长为3092bp,开放阅读框为2013bp长,编码671个氨基酸,其预测分子量为74.82kDa,甲壳动物酚氧化酶是一种含双铜的氧化还原酶,其分子量在70kDa左右(汪小峰等,2003)。通过氨基酸序列比对发现其与罗氏沼虾M.rosenberqii的同源性最高达到78%;另外发现脊尾白虾proPO cDNA序列中含有 3个串联的血蓝蛋白特征结构域分别为Hemocyanin-N 结构域(残基 43—120)、Hemocyanin-M结构域(残基 124—396)、Hemocyanin-C结构域(残基402—666),而且与其他甲壳动物酚氧化酶原保守血蓝蛋白结构域之间的相似性很高,证明甲壳动物的proPO基因也是血蓝蛋白基因家族的一员。利用RT-PCR技术分析了脊尾白虾proPO基因在4种组织中的表达分布,结果发现proPO基因在血细胞中的表达量是最高的,在肌肉中的表达量最低,这与斑节对虾(Pitiet al,2009)和中国对虾(孙杰等,2010)的研究结果相一致。

图6 脊尾白虾proPO在不同组织中的表达Fig.6 Real time PCR analysis of proPO gene expression from different tissues of E.carinicauda
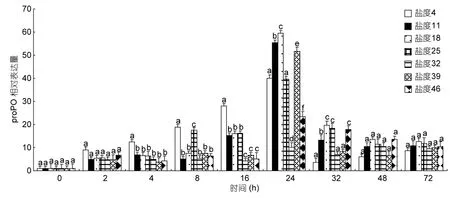
图7 盐度胁迫后proPO基因在血细胞中的表达变化Fig.7 The expression of proPO in haemocytes after salinity stress

图8 盐度胁迫后proPO基因在鳃组织中的表达变化Fig.8 The expression of proPO in gills after salinity stress
集约化养殖中的虾类面临着各种环境应激,环境因子(温度、盐度、溶解氧、pH和氨氮等)的改变都可引发虾机体的应激反应,这虽是一种保护性反应,但若长期处于应激状态下,虾机体的免疫功能会受到抑制,容易诱发疾病甚至死亡。为了了解养殖过程中的环境因子突变带来的潜在性危害,必须进一步探讨虾免疫和环境胁迫之间的相互关系。已有研究表明,盐度变化能够影响血淋巴 proPO的活性(Vargas- Alboreset al,1998)。盐度从20升至45会显著削弱波纹龙虾Panulirus homarusPO的活性(Bindhuet al,2007);而低盐度胁迫会降低悉尼岩石牡蛎Saccostrea glomerataPO的活性(Danielet al,2006)。本研究在不同盐度不同时间的胁迫作用下,脊尾白虾proPO基因在血细胞和鳃组织中的表达变化呈现在 24—48h呈现波动的趋势,特别是当胁迫24h时在血细胞中的表达量达到峰值;当胁迫48h后达到稳定,此时低盐度组的表达量仍然高于正常盐度和高盐度组的表达值,这与凡纳滨对虾的研究结果相似(Liet al,2010),上述结果说明,低盐驯化时,盐度降低对于脊尾白虾proPO基因的表达具有一定的促进作用,这有助于其酚氧化酶原激活系统更好地发挥作用,推测低盐驯化过程中盐度降低对于脊尾白虾的免疫调控机制会起到一定的促进作用,有助于其抗应激能力的提高,具体的影响方式与机理还有待进一步深入研究。
刘瑞玉,1955.中国北部的经济虾类.北京:科学出版社,48—49
王兴强,阎斌伦,马 甡等,2005.脊尾白虾生物学及养殖生态学研究进展.齐鲁渔业,22(8):21—24
白 霜,张立军,宋广周等,2008.酚氧化酶研究进展.杂粮作物,28(2):87—89
叶 星,郑清梅,白俊杰,2003.短沟对虾和斑节对虾酚氧化酶原基因的克隆和序列分析.海洋与湖沼,34(5):533—540
孙 杰,王宝杰,李晓华等,2010.中国明对虾酚氧化酶原基因cDNA的克隆与表达特征.水产学报,34(1):56—66
汪小峰,樊廷俊,2003.中国对虾酚氧化酶的部分生物化学特性的初步研究.海洋科学,27(4):71—75
Ashida M,Yamazaki H,1990.Biochemistry of the phenoloxidase system in insects:with special reference to its activation.Molting and Metam Orphosis.In:Ohnishi E,Ishizaki H eds.Springer Verlag,Berlin,Germany:239—265
Bindhu V,Radhakrishnan E V,Abinash P,2007.Effect of environmental parameters on immune response of the Indian spiny lobster,Panulirus homarus(Linnaeus,1758).Fish Shellfish Immunol,23(5):928—936
Nappi A J,Christensen B M,2005.Melanogenesis and associated cytotoxicre actions:applications to insect innate immunity.Insect Biochem Mol Biol,35(5):443—459
Cerenius L,Soderhall K,2004.The prophenoloxidase activating system in invertebrates.Immunol Rev,198(1):116—126
Chen P,Li J,Li Jet al,2010.Molecular cloning and characterization of prophenoloxidase in the swimming crabPortunus trituberculatus.Fish Shellfish Immunol,28(1):106—112
Daniel B,Kim S,David R,2006.The effect of low salinity on phenoloxidase activity in the Sydney rock oyster,Saccostrea glomerata.Aquaculture,251(2):159—166
Gai Y,Zhao J,Song Let al,2008.A prophenoloxidase from the Chinese mitten crabEriocheir sinensis:gene cloning,expression and activity analysis.Fish Shellfish Immunol,24(2):156—167
Ko C F,Chiou T T,Vaseeharan B,2007.Cloning and characterisation of a prophenoloxidase from the haemocytes of mud crabScylla serrata.Dev Comp Immunol,31(1):12—22
Li C C,Yeh S T,Chen J C,2010.Innate immunity of the white shrimp Litopenaeus vannamei weakened by the combination of aVibrio alginolyticusinjection and low-salinity stress.Fish Shellfish Immunol,28(1):121—127
Liu C H,Tseng D Y,Lai C Y,2006.Molecular cloning and characterisation of prophenoloxidase cDNA from haemocytes of the giant freshwater prawn,Macrobrachium rosenbergii,and its transcription in relation with the moultstage.Fish Shellfish Immunol,21(1):60—69
Piti A,Walaiporn C,Anchalee T,2009.Two prophenoloxidases are important for the survival of Vibrioharveyi challenged shrimpPenaeus monodon.Dev Comp Immunol,33(2):247—256
Soderhall K,Cerenins L,1998.Role of the prophenoloxidaseactinating system in invertebrate Immunity.Curr Opin Immunol,10(1):23—28
Vargas-Albores F,Baltazar P H,Clark G Pet al,1998.Influence of temperature and salinity on the yellowlegs shrimp,Penaeus californiensisHolmes,prophenoloxidase system.Aquac Res,29(8):549—553

