盐碱地中解磷菌的分离鉴定及其解磷能力研究
陆洪省,王亚舒,王厚伟,赵晓舒
(1.山东科技大学化学与环境工程学院,山东 青岛 266590;2.山东中医药大学药学院,济南 250355)
利用微生物活化土壤固化磷,是提高作物对磷吸收的重要途径[1]。随着对盐碱地开垦和作物种植,盐碱地土壤中有效磷的含量已经成为盐碱地利用重要限制性因素[2]。分离到的解磷菌溶磷能力普遍较低,筛选、分离出高效耐盐溶磷菌是发展盐碱地农业、解决盐碱地植物磷吸收的重要措施。
黄河三角洲盐碱地土壤以滨海盐土为主,土壤含盐量高,盐分主要以氯化物为主,土壤表层盐分在0.4%~0.5%,其中重度盐渍化土壤和盐碱光板地为23.63万hm2,约占区内土地面积的50%,盐渍化程度的加剧导致土壤中磷酸盐被土壤矿物吸附固定而难以被植物利用。磷是植物生长必需元素之一,我国约有74%的耕地土壤中缺乏有效磷,成为限制植物生长的主要因素之一[3-8]。土壤中大部分可溶性磷与土壤中金属离子结合形成难溶性磷酸盐,影响植物对磷吸收和利用。解磷菌(Phosphate-solubilizing micro-organisms,PSMs) 通过酸化、螯合和离子交换等过程将土壤中难溶磷转变为可溶磷,提高植物对磷的吸收利用,对土地改良和作物种植具有积极影响。解磷菌的种类主要有有微杆菌属(Microbacterium)、葡萄球菌属(Staphylococcus)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、黄色单胞菌属(Flavimo⁃nas)、纤维单胞菌属(Cellulomonas)等。本研究从黄河三角洲盐碱地土壤中分离、筛选适宜在盐碱地中利用的解磷微生物,对该菌株耐盐碱及解磷能力等进行研究,对我国盐碱地土壤的开发利用具有重要参考价值。
1 材料与方法
1.1 样品与培养基
试验土样取自黄河三角洲盐碱农耕地(东经118°10',北纬 37°12'),取样自表层 5cm 以下土壤。
分离液体培养基:C6H12O618g,KNO31.01 g,FeSO43.5mg,ZnSO40.16mg,CuSO40.08mg,H3BO30.5 mg,CaCl20.03 mg,MnSO40.4 mg,Ca3(PO4)25g,蒸馏水 1000mL,Tris-HCl调节 pH 8,配制固体培养基以及半固体培养基时分别加入15和5g琼脂。发酵培养基采用国际植物研究所磷酸盐生长培养基(NBRIP)[9]。有机磷固体培养基:1000mL牛肉膏蛋白胨培养基冷却到50℃以下,立刻加入60mL无菌生理盐水与蛋黄(现取的)按比例1∶1配制的蛋黄液[10]。
1.2 解磷菌的分离、筛选
称量5g土样加入盛有45mL无菌水的烧杯中,在超声波破碎仪中进行振荡处理,使细菌从土壤中溶出到无菌水中,静置20min,取2mL上层液加入盛有100mL已灭菌的分离培养基中,恒温振荡培养5d(150r·min-1,28℃),取5mL培养液转接到新鲜的分离培养基中,连续取样转接4次,培养条件同上,得到溶磷菌富集培养液。
取0.05mL溶磷菌富集培养液进行平板划线培养,所用培养基为有机磷固体培养基,28℃静置培养5d,从120个单菌落中挑取5个透明圈较大的菌落,并分别对其连续平板划线培养3次,确认为纯种菌并分别命名为SKDJP-1、SKDJP-2、SKD⁃JP-3、SKDJP-4和SKDJP-5,利用穿刺法分别保存到发酵半固体培养基(NBRIP)中,4℃冰箱保存待用。
高效解磷细菌的筛选采用有机磷固体培养基:将上述保存的5菌株分别在有机磷固体培养基上培养,28℃培养7d,观察并测定透明圈直径(D)、菌落直径(d),比较5菌株溶磷能力(D/d)。
1.3 生理生化性质测定
生理生化测定包括革兰氏染色、糖发酵试验、M.R试验、V.P试验、淀粉水解试验、明胶水解试验、H2O2酶测定等,操作方法见参考文献[11-12]。
1.4 不同pH培养条件下的溶磷能力测定
用NaOH调整发酵培养基(NBRIP)pH分别至7,8和9,分装150mL于250mL三角瓶中,灭菌,接种1.5mL菌液(109cfu·mL-1),每个处理做3个重复。恒温振荡培养(150 r·min-1,28℃),定期取培养液25mL,4000 r·min-1离心20 min,取2mL上清液采用K2S2O4消解,磷钼比色法测定培养液中磷含量[13-14]。
1.5 不同NaCl及CaCl2浓度条件下菌株溶磷能力测定
将NaCl加入到NBRIP培养基中,调整培养基pH 8,配制成NaCl浓度分别为0%、3%、6%和9%,平行做3个重复,恒温振荡培养(150 r·min-1,28℃),测定磷含量,测定方法同上。将CaCl2加入NBRIP培养基中,培养基pH 8,配制成CaCl2浓度分别为0%、0.5%、1.0%、2.0%和4.0%,平行做3个重复,培养条件及磷含量测定同上。
1.6 16S rDNA的扩增与测序
1.6.1 细菌DNA提取
采用UNIQ-10柱式细菌基因组抽提试剂盒对菌株进行DNA提取,提取步骤按照试剂盒说明书。
1.6.2 引物
采用细菌16S rDNA通用引物进行PCR扩增,引物序列:
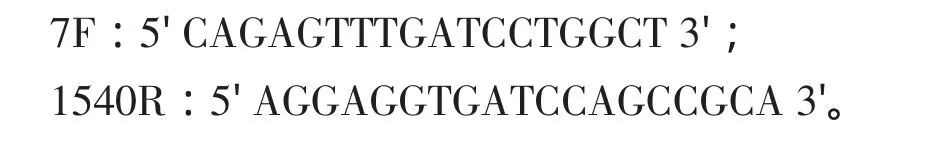
1.6.3 PCR反应条件
反 应 体 系(25μL): 2.5μL 5× Buffer(with Mg2+),0.5μL 模 板 DNA,各 0.5μL 7F(10μmol·L-1)和 1540R(10μmol·L-1),1μL dNTP(各2.5 mmol·L-1),超纯水定容至25μL。PCR反应条件:98℃预变性3 min;98℃变性25 S,55℃退火25S,72℃延伸1 min,30个循环,再72℃延伸10 min。PCR扩增产物测序由上海生工生物工程公司完成。
1.7 系统发育树的创建及分类学位置的确定
将分离菌株测得的16S rDNA序列在DDBJ(DNA Data Bank of Japan,http://www.ddbj.nig.ac.jp/)数据库中进行序列比较,选取相似度高。利用CustalX2.1和Mega5(Molecular Evolutionary Genetics Analysis)软件构建系统发育树,系统进化距离矩阵根据Kimura模型估算[15],创建方法为邻接法(Neighbor-Joining)[16-18]。
2 结果与分析
2.1 分离菌株解磷能力测定
本研究采用含难溶性磷酸盐的固体平板培养基测定分离菌株的解磷能力,利用菌落周围产生的透明圈大小(直径D)和菌落本身大小(直径d)比值来初步判断细菌的解磷能力。所筛选的5株解磷菌在7 d内的D/d值变化趋势如图1所示。由图1可知,菌株SKDJP-2、SKDJP-3和SKDJP-4的解磷能力非常接近,菌株SKDJP-1菌株能力远远高于其他4菌株。因此,以菌株SKDJP-1为代表菌株,研究其在不同培养条件下的解磷能力。
2.2 菌株SKDJP-1的生理生化性质测定
菌株SKDJP-1为革兰氏阴性,杆状,在分离培养基上培养,菌落呈乳白色,对此菌株生理生化测定,结果见表1。
由表1可知,该菌株能利用柠檬酸、麦芽糖为碳源,不能利用葡萄糖,接触酶以及氧化酶均为阳性反应,其生理生化性质与芽孢杆菌属类似,初步判断为芽孢杆菌(Bacillus)。

图1 5菌株在有机磷固体平板培养基上产生透明圈直径(D)与菌落直径(d)比值(D/d)与培养时间的关系Fig.1 Relationship between ratio(D/d)of dissolving phosphate zone diameter(D)to colony diameter(d)from 5 strains and inoculation time

表1 菌株SKDJP-1生理生化性质Table1 Bio-chemical characteristics of strain SKDJP-1
2.3 不同pH条件下菌株SKDJP-1溶磷能力
采用液体培养,测定培养液中可溶性磷的含量确定细菌的溶磷能力[19]。在不同pH(7,8和9)条件下,对菌株SKDJP-1进行培养,培养过程中有效磷含量随时间变化如图2所示。
从图2可知,在pH 7,8和9条件下,菌株在培养前192h,培养液中有效磷含量均呈现快速上升趋势,在pH为7和9的培养液中,有效磷含量在192 h时达最高值,分别为4.8和7.5mg·L-1。在pH 8的培养液中,有效磷含量在培养到264 h时达最大值9.1 mg·L-1,有效磷含量远远高于pH 7和9的培养液。因此,偏碱性环境更适合菌株SKDJP-1的解磷。
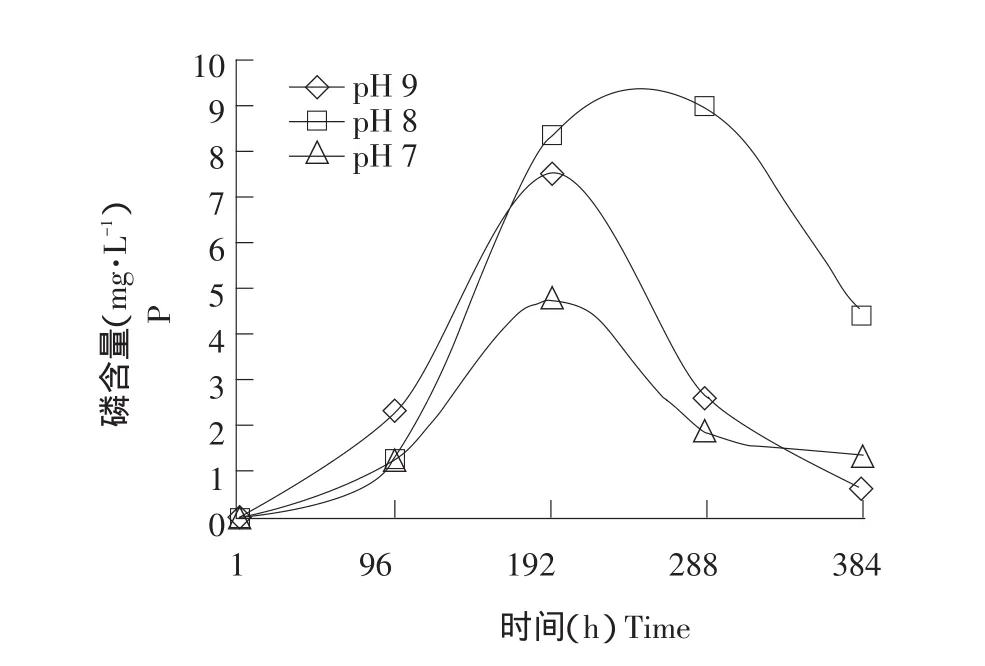
图2 不同pH值条件下磷含量随时间的变化曲线Fig.2 Changes of phosphorus contents with time under series of pH values in NBRIP medium
2.4 不同NaCl及CaCl2浓度下菌株SKDJP-1的溶磷能力
在pH为8的NBRIP培养基中,分别测定菌株SKDJP-1在不同NaCl浓度(0%、3%、6%和9%)和不同CaCl2(0%、0.5%、1.0%、2.0%和4.0%)条件下的解磷能力,结果如图3、图4所示。
从图3可知,NaCl浓度为3%条件下,菌株SKDJP-1的解磷能力最高,随着NaCl浓度继续升高,菌株的解磷能力下降,但NaCl浓度为6%时解磷能力稍低于3%,而NaCl浓度为9%条件下,菌株的解磷能力下降显著。因此,该菌株在NaCl浓度为3%~5%的范围内解磷能力最强。从图4可知,随着加入CaCl2量增高,培养液中磷浓度呈递减趋势,在未加入CaCl2的培养液中,磷浓度最高达49.3 mg·L-1,而在1%~4%CaCl2的培养液中,可溶性磷浓度无大变化,约在16.4 mg·L-1,这可能因为菌株SKDJP-1溶解的Ca3(PO4)2重新与Ca2+结合变为难溶物,从而降低培养液有效磷含量。
2.5 PCR扩增16S rDNA图谱
菌株SKDJP-1基因组经PCR扩增后,其扩增产物用1.0%琼脂糖凝胶电泳进行确认(见图5),从图5看出,在1.5 kb处有一特征条带。
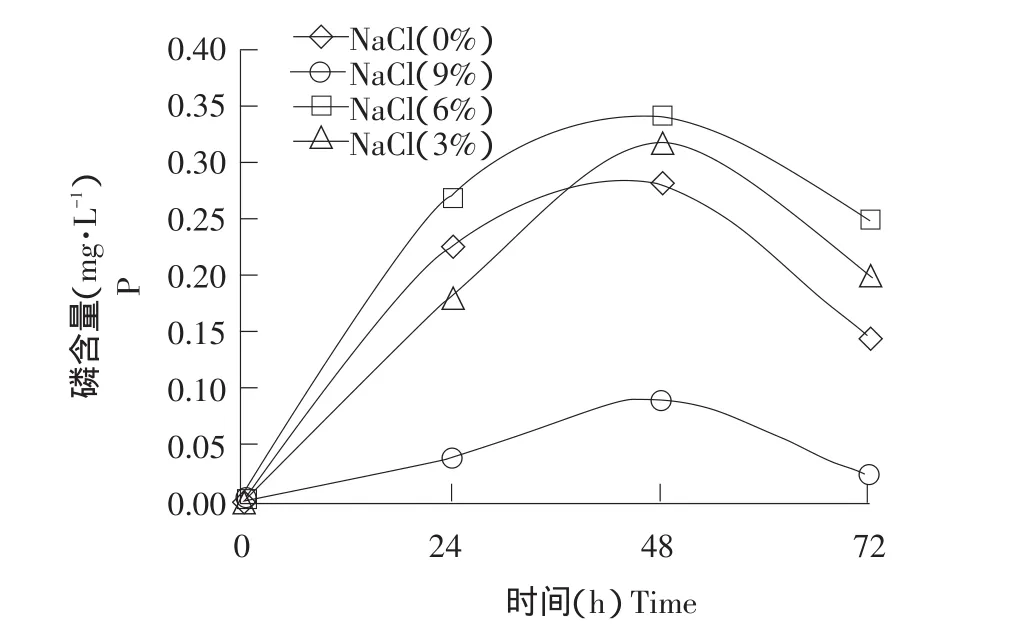
图3 不同NaCl浓度条件下磷含量随时间变化曲线Fig.3 Changes of phosphorus contents with time under series concentrations of NaCl in NBRIP medium

图4 不同CaCl2浓度条件下磷含量随时间变化曲线Fig.4 Changes of phosphorus contents with time under series concentrations of CaCl2in NBRIP medium

图5 菌株SKDJP-116S rDNA的PCR扩增序列Fig.5 PCR amplification of strain SKDJP-1
2.6 系统发育树
对菌株SKDJP-1的16S rDNA序列进行PCR扩增,将扩增序列提交到GenBank获得收录号AB826004。用CustalX2.1和Mega5软件对菌株SKDJP-1及其同源性较高菌株的16S rDNA序列进行系统发育树创建(见图6)。
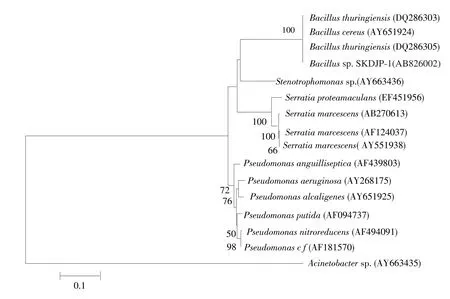
图6 菌株SKDJP-1基于16S rDNA序列NJ法系统发育树Fig.6 Neighbor-joining phylogenetic tree based on 16S rDNA sequence of strain SKDJP-1
由图6可知,菌株SKDJP-1与芽孢杆菌聚成一群,且与Bacillus thuringiensis(DQ286305)同源性高达98%。因此,菌株SKDJP-1应属于芽孢杆菌属,并命名Bacillus sp.SKDJP-1(AB826002)。
3 讨论
黄河三角洲盐碱化严重,其中有机磷是制约盐碱地作物生长的重要原因之一。目前对盐碱地改良研究大多集中在物理性改良方面,而利用生物改良盐碱地的研究相对较少,本研究在试验室条件下通过控制不同盐度(NaCl和CaCl2)、酸碱度等条件,对盐碱地中分离到的细菌进行解磷研究,对盐碱地不溶性磷酸盐利用,提高土壤的肥力以及盐碱地改良具有一定的理论和实践意义。
土壤中解磷菌能够通过分泌酸性物质溶解盐碱地中不溶性磷酸钙(Ca3(PO4)2,提高土壤中有效磷的含量。通常测定解磷菌解磷能力的方法有两种,一是将解磷菌在含有难溶性磷酸盐的固体培养基上,通过菌株在生长过程中产生的透明圈大小判断解磷能力大小,透明圈直径与菌株的产酶利用卵磷脂的能力呈正相关,透明圈越大,表明细菌的解磷能力越强;二是进行液体培养菌株,在培养过程中测定培养液中溶解性磷酸盐的含量变化,分析细菌的解磷能力。在本研究中上述两种方法都有应用,首先利用有机磷固体平板培养基对分离到的5株细菌透明圈直径(D)和菌落直径(d)进行测定,从中筛选出解磷能力(D/d)最大菌株SKDJP-1。其次利用发酵液体培养基(NBRIP)对解磷能力最强的菌株SKDJP-1的解磷能力进行测定,分析不同盐度(NaCl和CaCl2)和酸碱度条件下对菌株SKDJP-1解磷能力的影响,为菌株SKDJP-1的开发和实际应用奠定理论基础。
4 结论
a.从黄河三角洲盐碱地土壤中分离、筛选到一株高效解磷菌Bacillus sp.SKDJP-1(AB826002),该菌株革兰氏阴性,杆状,能以柠檬酸、麦芽糖为碳源生长,不能利用葡萄糖,适宜于偏碱性环境(pH 8)生长,其16S rDNA序列系统发育树表明,该菌株属于芽孢杆菌属。
b.利用有机磷固体培养基测定菌株SKDJP-1的解磷值(D/d)为4.3(培养7 d时);在pH为8的培养基中,该菌株最适生长的NaCl浓度为3%,最大解磷能力0.17 mg·L-1·d-1;菌株Bacillus sp.SKD⁃JP-1(AB826002)解磷能力随CaCl2浓度升高而降低,当CaCl2加入量超过1%后,溶磷能力显著下降。
c.本研究对分离到的菌株SKDJP-1的理化性质、解磷能力以及系统分类学位置等进行研究,基本可以判定该菌株属于芽孢杆菌属,对菌株更为具体的鉴定还需对其G+C含量、DNA-DNA杂交以及脂肪酸组成等进行分析;采用更接近土壤环境的条件(更精细pH范围)进行解磷能力分析,是后续研究的主要方向。
[1]刘长霞,谭天伟,翟洪杰.盐碱条件对真菌解磷能力的影响[J].微生物学通报,2003,30(5):69-72.
[2]段雪梅,冯胜,王小冬,等.一株分离自太湖有机聚集体上的有机磷降解细菌的鉴定及其降解特性研究[J].农业环境科学学报,2008,27(2):741-747.
[3]刘月娟,汪金舫.β-甘油磷酸钠的加入对土壤有机磷组分和速效磷含量的影响[J].土壤,2007,39(3):469-473.
[4]郭宗祥,左其东,李梅,等.江苏省太仓市耕地地力调查与质量评价—土壤pH、有机质、全氮、有效磷、速效钾和CEC的变化[J].土壤,2007,39(2):318-321.
[5]钟传青,黄为一.不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报,2005,42(2):286-294.
[6]苏友波,林春,张福锁,等.不同AM菌根菌分泌的磷酸酶对根际土壤有机磷的影响[J].土壤,2003,35(4):334-338.
[7]蔡天明,管莉菠,崔中利,等.高效聚磷菌株GM1的分离和聚磷特性研究[J].土壤学报,2005,42(4):635-641.
[8]蔡天明,管莉菠,崔中利,等.恶臭假单胞菌(Pseudomonas puti⁃da)GM6的聚磷特性研究[J].土壤学报,2006,43(1):117-123.
[9]Ayandra Kumar Johri,Sanjay Surange.Occurrence of salt,pH,and temperature-tolerant,phosphate-solubilizing bacteria in Al⁃kaline Soils[J].Current Microbiology,1999,39:89-93.
[10]张巍,冯玉杰,胡纯国,等.耐盐碱溶磷菌的分离鉴定及溶磷能力研究[J].土壤通报.2009,40(3):572-575.
[11]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001.
[12]布坎南R E,吉本斯N E,著,伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1984:622-651.
[13]Hong-Joo Son A,Geun-Tae Park.Solubilization of insoluble in⁃organic phosphates by a novel salt-and pH-tolerant Pantoea ag⁃glomerans R-42 isolated from soybean rhizosphere[J].Microbiol Biotechnol,2006,97:204-210.
[14]C Shekhar Nautiyal,Shipra B.Stress induced phosphate solubili⁃zation in bacteria isolated from alkaline soils[J].FEMS Microbiol Lett,2000,182:291-296.
[15]Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide se⁃quences[J].Journal of Molecular Evolution,1980(16):111-120.
[16]Person,W R,Lipman D.Improved tools for biological sequence comparison[J].Proceedings of the National Academy of Sciences.1988,85:2444-2448.
[17]Saitou,N,Nei M.The neighbor-joining method:A new method of reconstructing phylogenetic tress[J].Molecular biology and evolu⁃tion,1987(4):406-425.
[18]Felsenst ein J.Confidence limits on phylogenies:An approach us⁃ing the bootstrap[J].Evolution,1985,39:783-791.
[19]赵小蓉,林启美,孙焱鑫.细菌解磷能力的测定方法的研究[J].微生物学通报,2001,28(1):1-4.

