2型糖尿病合并冠心病患者对氧磷酶1基因多态性分析
邵峥谊 李静茹 王旭东
.临床研究.
2型糖尿病合并冠心病患者对氧磷酶1基因多态性分析
邵峥谊 李静茹 王旭东
目的 探讨对氧磷酶1(PON1)基因多态性与2型糖尿病合并冠心病的相关性。方法使用变性高效液相色谱分析方法检测了202例2型糖尿病合并冠心病患者、177例单纯2型糖尿病患者和206名健康对照者;共检测了PON1基因G-126C、L55M和Q192R 3个多态性的基因型,比较分析3组间各基因型和等位基因频率分布的差异。结果 2型糖尿病合并冠心病组的Q192R位点R等位基因频率明显高于对照组(67.1%比60.2%,P=0.024),其他位点在各组间差异无统计学意义。结论 PON1基因Q192R位点R等位基因与2型糖尿病合并冠心病发病相关。
对氧磷酶1; 基因; 多态性; 糖尿病,2型; 冠状动脉疾病
对氧磷酶1(paraoxonase 1,PON1)是一种高密度脂蛋白胆固醇(HDL-C)参与的脂质抗氧化作用相关酶,有利于防止动脉粥样硬化的形成,减少冠心病的发生;血脂升高与脂质过氧化是冠心病的危险因素之一,据报道PON1基因的一些多态性位点与冠心病具有相关性[1];而糖尿病也与血脂相关,同是冠心病的危险因素。本研究拟探讨PON1基因多态性是否与糖尿病和糖尿病合并冠心病发病具有相关性,并分析不同基因型与血脂水平的关系。
1 对象和方法
1.1 研究对象
选取2009—2012年在首都医科大学附属北京同仁医院就诊的2型糖尿病合并冠心病患者202例(DM-CAD组),单纯2型糖尿病患者177例(DM组),经病史、心电图和超声心动图检查排除了合并冠心病。采用随机数字表法进行抽样,所有研究对象无血缘关系,在知情同意后入选。2型糖尿病的诊断依据世界卫生组织糖尿病专家委员会提出的标准(1999年),冠心病诊断以心电图、运动负荷试验、心肌核素检查和冠状动脉造影等检查为依据。其中冠心病患者包括急性冠状动脉综合征患者74例,稳定型心绞痛患者64例,缺血性心肌病患者10例,无症状性心肌缺血患者54例。对照组选自同期在我院体检科经心电图和病史除外冠心病和糖尿病的体检者206例。
1.2 标本采集与准备
所有研究对象于清晨空腹抽取静脉血2.7 ml,加入0.3 ml枸橼酸钠抗凝,经离心(3 500 rpm× 5 min)后使用碱裂解法从沉淀物中提取DNA,溶于TE8溶液,并测定光密度值计算每份标本浓度后放-20℃保存,以备DNA检测。同时采血用自动生化分析仪(P800,Roche)应用酶法(试剂R1,日本协和医药株式会社)测定总胆固醇(TC)、三酰甘油(TG)、HDL-C和低密度脂蛋白胆固醇(LDL-C)浓度,试剂盒由日本协和公司提供。根据研究对象的体质量和身高,计算体质指数(body mass index,BMI)=体质量/身高2(kg/m2)。
1.3 基因多态性位点的检测与确定
根据NCBI/GenBank数据库中的PON1基因mRNA序列(VERSION EU289337.1/GI:162296325)设计可以覆盖调节区和所有外显子的引物与探针[2],使用引物设计软件(Designing allele discrimination assays using primer express Version 1.5)设计Taqman MGB荧光标记探针(表1),使用变性高效液相色谱分析方法(denaturing high performance liquid chromatography,DHPLC)(WAVE®系统高效液相色谱分析仪,美国Transgenomic,Inc.,Omaha,NE)对标本进行盲筛,检查基因变异位点。使用WAVE3.0软件(美国Transgenomic,Inc.,Omaha,NE)查找其理想的解链温度。首先检测了24个(包括8例2型糖尿病合并冠心病患者、8例单纯2型糖尿病患者和8名健康对照者)标本,共扫描检测基因的9个外显子区和调节区。对出现变异波形的标本进行DNA序列测定(表1),以确定其是否存在多态性位点,最后选择变异等位基因频率>5%的位点进行大规模的检测。
基因序列测定采用Taqman标准试剂盒(P/N4304437,ABI公司),按照实验指南操作。分别在反应体系中加入两种等位基因特异性探针。将终反应液为25μl的试管放在PCR扩增仪(GeneAmp®PCR System 9700 Thermal cycler)上进行PCR。反应条件如下:首先60℃,2 min激活试剂中的AmpErase UNG活性;95℃,10 min,激活AmpliTaq酶;然后进行92℃,15 min的变性反应,进行1 min的退火和片段延长,其不同的PCR片段退火温度见表2,共进行35个循环。反应结束后,将PCR产物放入4℃,10 min。将试管放在ABI 7700序列检测仪(ABI PRISM®7700 Sequence Detection System)上。由Macintosh计算机上分析软件(SDS software V1.7)进行自动分析。确定每个位点的3种基因型。在DHPLC仪中显示出不同波形的标本中,每种挑选5份标本进行DNA序列测定,以确定不同波形所对应的基因型,在ABI遗传分析仪3700(美国PE Biosystem,Foster City,CA)上进行。
最终选择确定了3个位点,包括调节区内-126 bp位点的G→C多态性,第3外显子的T→A多态性和第6外显子A→G多态性。
1.4 统计学方法
全部数据输入计算机,使用SPSS 8.0软件包进行分析。计量资料以±s表示,计数资料以率或百分构成比表示。组间计数资料比较采用χ2检验;计量资料比较采用多因素方差分析方法。P<0.05为差异有统计学意义。计算Q192R位点R等位基因的人群归因危险度(population-attributable risk,PAR),按照公式:PAR=(X-1)/X,X=(1-f)2+ 2f(1-f)r1+f2r2,f是总体中R等位基因频率(0.63),r1和r2分别是相对于QQ型的QR基因型危险比(1.43)和RR基因型危险比(1.52)。

表1 用于Taqman方法的引物和探针序列及解链温度
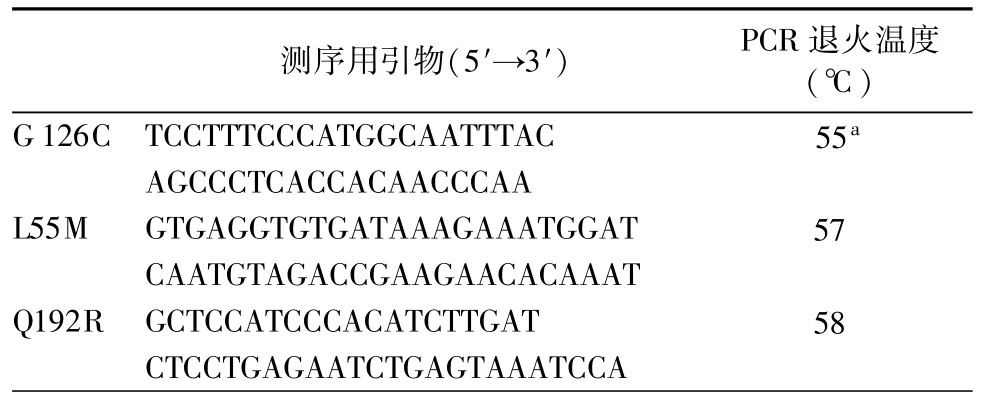
表2 序列测定用引物及退火温度
2 结果
2.1 3组间一般资料比较
DM-CAD组、DM组和对照组间比较,性别和年龄差异无统计学意义;TC、TG、LDL-C和HDL-C差异有统计学意义(均为P<0.05),其中两两比较结果显示DM-CAD组和DM组的BMI、TG和LDL-C水平均显著高于对照组(均为P<0.05),但前两组比较差异无统计学意义;DM-CAD组和DM组的HDL-C均低于对照组(均为P<0.05),但DM-CAD组与DM组比较差异无统计学意义(表3)。
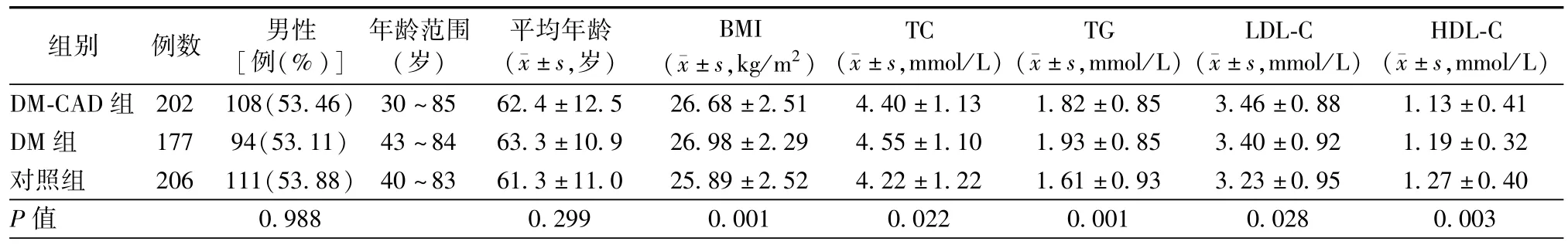
表3 3组间一般资料比较
2.2 基因型比较分析
经Handy-Weinberg吻合度检验,3个位点的基因型分布均符合哈迪-温伯格遗传平衡定律(Hardy-Weinbarg Equilibrium),表明对象来自于同一群体。
3组间3个位点的基因型比较差异无统计学意义(表4),其中DM-CAD组的Q192R位点RR基因型携带者多于对照组(P=0.066),在整体对象中此基因型频率分别为QQ型14.5%、RR型39.8%和QR型45.6%;对此位点进一步做等位基因频率分析,两两比较结果显示R等位基因频率DM-CAD组明显多于对照组(67.1%比60.2%,P=0.024)。R等位基因整体频率是63%,将此R等位基因作为一个危险因素计算其人群归因危险度是0.28。
2.3 血脂水平分析
将所有对象按照3个位点不同基因型分组后比较各组血脂水平,差异均无统计学意义(表5)。
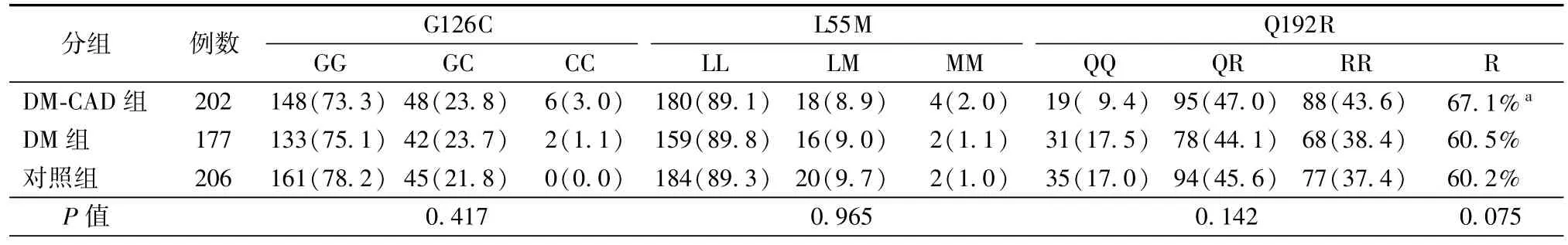
表4 3组间基因型频率比较[例(%)]
表5 3个位点不同基因型之间血脂水平比较(±s,mmol/L)
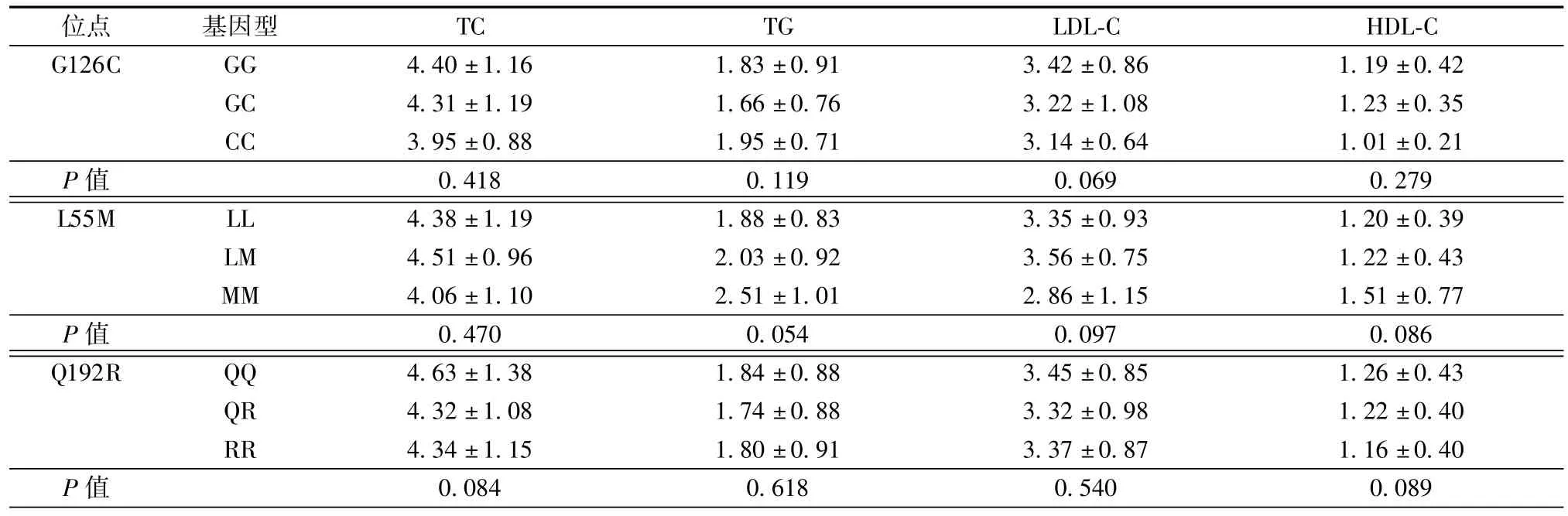
表5 3个位点不同基因型之间血脂水平比较(±s,mmol/L)
位点基因型TC TG LDL-C HDL-C G126C GG 4.40±1.16 1.83±0.91 3.42±0.86 1.19±0.42 GC 4.31±1.19 1.66±0.76 3.22±1.08 1.23±0.35 CC 3.95±0.88 1.95±0.71 3.14±0.64 1.01±0.21 P值0.418 0.119 0.069 0.279 L55M LL 4.38±1.19 1.88±0.83 3.35±0.93 1.20±0.39 LM 4.51±0.96 2.03±0.92 3.56±0.75 1.22±0.43 MM 4.06±1.10 2.51±1.01 2.86±1.15 1.51±0.77 P值0.470 0.054 0.097 0.086 Q192R QQ 4.63±1.38 1.84±0.88 3.45±0.85 1.26±0.43 QR 4.32±1.08 1.74±0.88 3.32±0.98 1.22±0.40 RR 4.34±1.15 1.80±0.91 3.37±0.87 1.16±0.40 P值0.084 0.618 0.540 0.089
3 讨论
PON1是一种由肝脏合成的具有354个氨基酸的酯酶,基因由9个外显子和8个内含子组成;其第3外显子中的(L55M)T-A密码子置换导致氨基酸链第55位的亮氨酸(Leu)转变为蛋氨酸(Met),第6外显子中(Q192R)A→G置换使第192位的谷氨酰胺(Q)转变为精氨酸(R)。本组中Q192R位点的R等位基因频率为0.63,与其他亚洲人报道相似[3],多于欧美研究报道的0.30[4],提示此多态性具有种族差异性。
外显子密码子的变异使氨基酸链发生变化,研究显示其中Q192R位点与HDL-C依赖的LDL-C抗氧化作用减弱相关[5],而无论是HDL-C还是LDL-C被氧化,在脂质堆积和动脉硬化形成过程中均具有十分重要的作用[6]。Q192R多态性与冠心病具有相关性[7]。近来还有研究证实,2型糖尿病患者的PON1活性明显低于对照者[8];本研究观察的3个位点与2型糖尿病无相关性,与2型糖尿病合并冠心病具有相关性的只有Q192R位点。其可能与冠心病发病直接相关,也可能与另外1个与冠心病相关的基因位点连锁而与冠心病间接相关。在整体中Q192R位点的G等位基因频率很高(63%),其群体归因危险度是28%,提示因此位点的存在使本研究样本中糖尿病合并冠心病患病率增加了28%。
多态性位点与血脂水平无相关性;限于条件,研究中未能测定观察对象的PON1水平和活性,所以不能阐述这些多态性与蛋白质的关系。本研究例数较少,其结果可作为今后大样本量研究的基础。
综上所述,PON1基因序列中的G126C、L55M和Q192R多态性与糖尿病不具有相关性,其中Q192R多态性与2型糖尿病合并冠心病相关。这一结果还有待于更多的样本分析进一步证实。
[1]Hassan MA,Al-Attas OS,Hussain T,et al.The Q192R polymorphism of the paraoxonase 1 gene is a risk factor for coronary artery disease in Saudisubjects[J].Mol Cell Biochem,2013,380:121-128.
[2]National Center for Biotechnology Information(GenBank EU289337.1).Bos taurus PON1(PON1)mRNA,complete cds[2007-12-16].http://www.ncbi.nlm.nih.gov/nuccore/ EU289337.1.
[3]Chen CC,Chen CC,Tu JD,et al.Associations between genetic polymorphisms of paraoxonase genes and coronary artery disease in a Taiwanese population[J].Clin Biochem,2013,46:1664-1667.
[4]Gluba A,Pietrucha T,Banach M,et al.The role of polymorphisms within paraoxonases(192 Gln/Arg in PON1 and 311Ser/Cys in PON2)in themodulation of cardiovascular risk:a pilot study[J].Angiology,2010,61:157-165.
[5]Aviram M,Hardak E,Vaya J,et al.Human serum paraoxonase (PON1)Q and R selectively decrease lipid peroxides in human coronary and carotid arteriosclerotic lesions:PON1 esterase and peroxidase-like activities[J].Circulation,2000,101:2510-2517.
[6]Ng CJ,Wadleigh DJ,Gangopadhyay A,etal.Paraoxonase-2 isa ubiquitously expressed protein with antioxidant properties and is capable of preventing cellmediated oxidative modification of low density lipoprotein[J].J Biol Chem,2001,276:44444-44449.
[7]Ahmad I,Narang R,Venkatraman A,et al.Two-and threelocus haplotypes of the paraoxonase(PON1)gene are associated with coronary artery disease in Asian Indians[J].Gene,2012,506:242-247.
[8]Gupta N,Binukumar BK,Singh S,et al.Serum paraoxonase-1 (PON1)activities(PONase/AREase)and polymorphisms in patients with type 2 diabetes mellitus in a North-West Indian population[J].Gene,2011,487:88-95.
Analysis of paraoxonase 1 gene polymorphisms in type 2 diabetic patients w ith coronary artery disease
Shao Zhengyi1,Li Jingru2,Wang Xudong3.
1 Department of Emergency,Beijing Tongren Hospital,Capital Medical University,Beijing 100176,China;2,Department of Stomatology,China Meitan General Hospital;3 Department of Comprehensive Internal Medicine,Beijing Tongren Hospital,Capital Medical University
Objective To study the association of paraoxonase 1(PON1)gene polymorphismswith pathogenesis of coronary artery disease in type 2 diabetic patients.M ethods Denaturing high performance liquid chromatographymethod was used to scan genomic DNA from 202 type 2 diabetic patientswith coronary artery disease,177 type2 diabetics and 206 control subjects in determining genotypes of G-126C,L55M and Q192R polymorphisms.The distribution of diverse genotypes and alleles among three groups was compared and studied.Results There were more carriers for R allele of Q192R polymorphism in type 2 diabetic patients with coronary artery disease than in control subjects(67.1%vs.60.2%,P=0.024).There was no significant different distribution of G-126C and L55M polymorphisms among three groups.Conclusions The allele R of the Q192R polymorphism is associated with an increased risk for development of coronary artery disease in type 2 diabetics.
Paraoxonase 1; Genes; Polymorphism; Diabetesmellitus,type 2; Coronary artery disease
Wang Xudong,Email:wangxd5812@sohu.com
2014-05-19)
(本文编辑:谭潇)
10.3969/j.issn.1007-5410.2014.06.008
100176首都医科大学附属北京同仁医院(亦庄)急诊科(邵峥谊),综合内科(王旭东);煤炭总医院口腔科(李静茹)
王旭东,电子信箱:wangxd5812@sohu.com

