一氧化氮合酶在绵羊卵母细胞体外成熟及胚胎发育中的表达
张冠华,杨燕燕,2,温世勇,彭灿泉,曹贵方*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特010018;2.内蒙古自治区农牧业科学院畜牧研究所,内蒙古呼和浩特010031)
一氧化氮(nitrogen monoxide,NO)作为一种具有自由基性质的多功能活性分子,在许多生理系统信号传递中起重要作用。生物体内的NO由一氧化氮合酶(nitric oxide synthase,NOS)催化产生,由于NO的半衰期非常短而且NOS是一氧化氮生成过程中的限速酶,因此某一组织中NOS的量能线性反应出NO的量。哺乳动物NOS的分类,被广泛接受的是Nahtna和Xie的分类方法[1],即神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)。nNOS和eNOS合称为组成型(或原生型或固有型)一氧化氮合酶(constitutive nitric oxide synthase,cNOS)。cNOS的调控机制与Ca2+浓度密切相关,Ca2+通过改变CaM的结构,改变还原酶区和加氧酶区的状态,实现对NOS活性的调控,当Ca2+浓度升高时,2个区域是结合的,电子传递可以顺利进行;而当Ca2+浓度降低时,两个区域是分开的,故电子传递无法完成[2]。而另一个NOS即iNOS中还原酶区和加氧酶区总是密合的,因此其活性与Ca2+/CaM无关。NO最初因为它对血管的作用而受到重视。近来大量研究表明,NO不仅在血管发生过程中起重要作用,而且和生殖功能的正常发挥有密切关系。NO通过与体内的第2信使鸟苷酸环化酶结合,使环单磷酸鸟苷(cGMP)产生增多,进而使环单磷酸腺苷(cAMP)与环单磷酸鸟苷的比例改变,发挥其对胚胎正常生长发育、分化的调节作用[3],故正常胚胎发育需要NO的调节,NO代谢水平可作为检测胚胎发育是否正常的一项重要指标[4]。研究发现,NO参与鼠的生发泡破裂和第一极体排出;eNOS和iNOS在猪卵母细胞发育过程中持续表达,所产生的NO可以促进卵母细胞的成熟以及促进停滞于第1次减数分裂期的卵母细胞继续分裂[5];鼠注射iNOS抑制剂氨基胍(aminoguanidine,AG)及敲除eNOS基因后,卵母细胞均不能正常发育[6-7];向妊娠大鼠一侧子宫角注射L-硝基-精氨酸甲脂(N-nitro-L-argininemethylester,L-NAME),胚胎发育严重受阻[8];鼠的胚胎中产生的NO可刺激局部血管舒张并且增加毛细血管的通透性,为能够成功植入创造必要条件[9]。以上研究说明,NO参与卵母细胞成熟及早期胚胎发育,适量浓度NO是正常胚胎发育所必需的,当失衡时则导致胚胎发育阻滞或胚胎的凋亡。
为了深入研究NO对绵羊早期胚胎发育的调节及作用机制,本试验运用体外成熟、体外受精、体外胚胎培养及实时荧光定量PCR技术,研究在绵羊卵母细胞及早期胚胎过程中nNOS、eNOS、iNOS mRNA相对表达情况,以揭示NOS在绵羊早期胚胎发育过程中的表达规律,为深入了解NO在生殖系统的生理功能奠定实验基础。
1 材料与方法
1.1 材料
绵羊卵巢于内蒙古呼和浩特市屠宰场随机收集获得。冷冻精液为内蒙古呼和浩特市改良站产品;M199为GIBCO公司产品;促卵泡素(FSH)、促黄体素(LH)为宁波三生药业公司产品;IVF液和胚胎培养液为Vltrolife公司产品;血清FBS由内蒙古农业大学兽医学院组织胚胎与发育生物学实验室配制;Percoll、雌二醇(E2)、碳酸氢钠(NaHCO3)、肝素(heparin)、谷氨酰胺(glutamine)、丙酮酸钠(sodium pyruvate)、HEPES、青霉素(ampicillin trihydrate)、庆大霉素(gentamine sulfate)、链霉素(streptomycin sulfate)、石蜡油(merinal oil)为Sigma公司产品;PrimeScript TMRT-PCR regent Kit为宝生物工程(大连)有限公司产品 (No.DRR047S);2× DyNA-mo Color Flash SYBR Green Master Mix 1mL为Thermo公司产品(Lot 00138041);RNAfast 200微量RNA提取试剂盒为上海飞捷Fastagen公司产品。
1.2 方法
1.2.1 卵母细胞的获得及体外成熟培养 于屠宰场随机收集屠宰绵羊卵巢,并于1h~2h之内用盛有生理盐水的保温杯运送到实验室。用卵巢保存液(0.890g NaCl+0.020g MgCl20.020g CaCl2+0.006 9g ampicillin trihydrate+1.90g streptomycin sulfate+100mL ddH2O)清洗2次~3次。采用刺剖法[10]采集卵母细胞,并于镜下观察收集卵母细胞周围有多层、胞质完整均匀的卵丘细胞的卵丘-卵母细胞复合体。采用常规标准体外成熟培养体系,将获得的卵母细胞用洗卵液和成熟液清洗2遍~3遍后,成熟液中培养18h~24h。成熟后的卵母细胞,体视显微镜下可清晰地观察到卵丘细胞排列疏松,并出现明显地扩散(图1B);去除卵丘细胞后可见第一极体排出(图2B)。收集结构完整的未成熟卵母细胞及成熟卵母细胞各5个备用。

图1 成熟卵母细胞观察Fig.1 Observation of mature oocytes

图2 成熟卵母细胞可见极体排出Fig.2 The visible polar bodies in mature oocytes
1.2.2 冻精解冻与激活 将冻精于液氮中取出后立刻放入40℃左右的水浴中解冻后,应用Percoll浓度梯度 (45%/90%)离心 法,1 800r/min离心6min,弃上层离心液,取适量絮状沉淀再于hSOF液(0.496g NaCl+0.043g KCl+0.008g MgCl2·6H2O+0.013g KH2PO4+0.048g sodium lactate+0.006g gentamine sulfate+0.004g streptomycin sulfate+0.042g NaHCO3+0.008g sodium pyruvate+0.026g CaCl2·2H2O+0.651g HEPES+0.800g BSA+0.005g phenol red+100mL ddH2O)中,以1 200r/min离心4min,进行2次,弃上清,取少量沉淀于显微镜下镜检离心后精子活力情况。成功获能的精子表现“swim up”运动状态,收集活力较好的精子备用。
1.2.3 体外受精与胚胎培养 去除成熟卵母细胞周围的卵丘细胞,用hSOF洗液及受精液清洗2次~3次,转入受精液滴中(20个/mL~30个/mL),再将激活的精子以1×106个/mL~5×106个/mL的浓度加入,受精24h后将受精卵移入胚胎培养液中连续培养,每48h换一次胚胎培养液。镜下观察并收集各发育阶段胚胎(图3)各5个备用。

图3 胚胎发育各个时期形态图Fig.3 Morphology of embryos at different stages
1.2.4 RNA的提取和反转录 采用RNAfast 200微量RNA提取试剂盒,按其说明进行总RNA的提取。反转录反应体系为20μL,反应分两步进行:①去除基因组DNA(2μL 5×gDNA eraser buffer+0.5μL gDNA eraser+0.5μL RNase free dH2O+7μL total RNA),反应程序为:42℃2min,4℃保存;② 反 转 录 (3.5 5×PrimeScript buffer 2 +1.5μL PrimeScript RT Enzyme MixⅠ+1.5μL RT Primer Mix +3.5μL RNase free dH2O +10μL的反应液),反应条件为:37℃15min,85℃5s,4℃保存。
1.2.5 实时荧光定量PCR 应用Primer 5.0软件进行引物设计。nNOS目的片段为145bp,上游引物5′-CCCTTCTCAGCAAATACGAAAG-3′,下游引物5′-GTTCACCTCTTCCAGCCTCTC-3′;eNOS目的片段为145bp,上游引物5′-CGGAACAGCACAAGAGTTACAA-3′,下 游 引 物 5′-CCGAACACACAGAACCTGAG-3′;iNOS目的片段为120bp,上游引物5′-GCAACGGAGAGAAACTGAAGAA-3′, 下 游 引 物 5′-CGTGAGCAAAAGCACAGAACT-3′;GAPDH目的片段229bp,上游引物5′-GGCGTGAACCACGAGAAGTATA-3′;下游引物5′-AAGCAGGGATGATGTTCTGG-3′。所有引物均由上海生工生物工程技术服务有限公司合成。
采用荧光染料法进行扩增检测,反应体系为10μL(5μL DyNAmo Color Flash SYBR Green Master Mix(2×)+0.5μL Up primer+0.5μL Down primer+2μL cDNA+2μL RNA free H2O)。扩增条件为:95℃7min;95℃5s,58℃30s,72℃8s,49个循环。反应过程中以水代替cDNA作为阴性对照,没有出现阳性信号,说明反应体系没有被污染。
1.2.6 PCR扩增产物特异性的确定 PCR产物经溶解曲线峰进行确定,并取5μL real-time PCR产物经20g/L琼脂糖凝胶电泳(100V,10min)确定扩增产物片段大小后,送交上海生工生物工程技术服务有限公司进行序列测定。
1.2.7 统计分析 试验通过实时荧光定量PCR相对定量的方法,分析3种NOS基因的相对表达变化,运用公式2-△Ct进行计算,-△Ct=Ct目的基因-Ct内参基因[11],结果用SPSS软件进行单因子方差分析(One-way ANOVA)统计数据,结合 GraphPad Prism 5软件整理结果,P<0.05为差异显著,具有统计学意义。
2 结果
2.1 PCR产物特异性的确定
2.1.1 实时荧光定量PCR对产物的确定 实时荧光定量PCR检测到nNOS、eNOS、iNOS mRNA在绵羊早期胚胎发育不同阶段中均有表达。扩增曲线中扩增效果良好;溶解曲线中nNOS(图4B)、eNOS(图4C)、iNOS(图4D)均在80、86和82℃出现单一产物峰处,均与引物设计后预期产物Tm值相同。

图4 扩增曲线及溶解曲线Fig.4 Amplification cure and melting curves
2.1.2 琼脂糖凝胶电泳对产物的确定 经20g/L琼脂糖凝胶电泳检测,结果为清晰无拖尾的条带,GAPDH、nNOS、eNOS、iNOS扩增片段大小均与预期扩增片段大小相吻合。产物经测序后与已发表的序列同源性为98%,表明PCR的产物为GAPDH(图5A)、nNOS(图5B)、eNOS(图5C)、iNOS(图5D)的目的基因产物。

图5 电泳检测 GAPDH(A)、nNOS(B)、eNOS(C)、iNOS(D)PCR产物Fig.5 Electrophoresis detection of GAPDH(A),nNOS(B),eNOS(C)and iNOS(D)PCR products
2.2 nNOS、eNOS、iNOS的相对表达量
2.2.1 nNOS、eNOS、iNOS在卵母细胞中的表达由图6可知,nNOS、eNOS、iNOS在绵羊未成熟卵母细胞及成熟卵母细胞中均有表达,并且nNOS的表达量均显著高于eNOS、iNOS的表达量(P<0.05),并且在成熟卵母细胞中的表达量显著高于未成熟卵母细胞中的表达量(P<0.05)。故绵羊卵母细胞成熟过程中的NO可能主要由nNOS基因介导产生。

图6 不同阶段卵母细胞nNOS、eNOS、iNOS mRNA相对表达Fig.6 The relative mRNA expressions of nNOS,eNOS and iNOS in different development stage of oocytes
2.2.2 nNOS、eNOS、iNOS在胚胎中的表达 由图7可知,在绵羊各不同阶段早期胚胎eNOS的表达量均显著低于nNOS、iNOS的表达量(P<0.05)。故绵羊早期胚胎发育过程中的NO可能主要由nNOS、iNOS介导产生。

图7 不同阶段早期胚胎nNOS、eNOS、iNOS mRNA相对表达Fig.7 The relative mRNA expressions of nNOS,eNOS and iNOS in different development stage of embryos
2.2.3 nNOS在胚胎中的表达 nNOS在2-细胞期较成熟卵母细胞期显著降低(P<0.05),4-细胞期表达水平继续降低但是差异不显著,到8-细胞期表达量显著升高(P<0.05),桑葚胚期表达量达到最高,囊胚期再次出现显著性降低(P<0.05);nNOS mRAN在胚胎发育过程中的表达总体呈现出先降低再升高再降低的趋势(图8)。
2.2.4 iNOS在胚胎中的表达 iNOS mRNA在2-细胞期开始大量表达,4-细胞期继续降低,到8-细胞期再次显著升高(P<0.05),并在桑葚胚期达到最高水平,囊胚期又出现显著性降低(P<0.05)(图9)。

图8 不同阶段早期胚胎nNOS mRNA相对表达Fig.8 The relative mRNA expressions of nNOS in different development stage of embryos
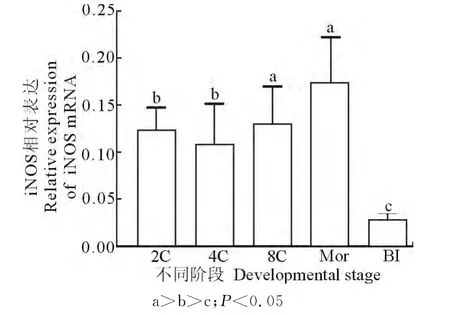
图9 不同阶段早期胚胎iNOS mRNA相对表达Fig.9 The relative mRNA expressions of iNOS in different development stage of embryos
通过数据统计分析可知,绵羊卵母细胞成熟过程中3种亚型基因的NOS mRNA表达量最高,并且在成熟卵母细胞中的表达显著高于未成熟卵母细胞(P<0.05)。早期胚胎发育过程中,nNOS和iNOS mRNA表达水平较高且相似,呈现出4-细胞期较2-细胞有降低趋势;8-细胞期的表达量显著升高(P<0.05)并在桑葚胚期表达量达到最高;囊胚期显著降低(P<0.05)的表达趋势。
3 讨论
随着对NO的不断研究发现,NO与生殖有密切的关系,其参与精子发生及精子获能、卵母细胞成熟、胚胎发育及胚胎植入,还有妊娠维持、分娩等多种生殖过程[12]。Gouge R 等[9]研究发现,小鼠妊娠第1天~第4天的胚胎均能产生NO,于培养液中添加NOS抑制剂,胚胎的发育出现迟缓;Chen H W等[13]研究中,在小鼠胚胎发育到2-细胞期添加NOS抑制剂L-NAME,便出现胚胎发育阻滞的现象;Barroso R P等[14]研究发现,高浓度的NO同样会阻止胚胎的发育,在小鼠胚胎发育到2-细胞期添加NO供体二亚乙基三胺(diethylenetriamine,DETA),4-细胞时便出现胚胎发育阻滞的现象;Tesfaye D等[15]研究NO与牛早期胚胎发育的过程中发现,LNAME抑制囊胚发育,当协同添加SNP时这种抑制作用消失。以上研究表明,NO在维持胚胎正常发育过程中,其浓度保持相对平衡的状态,生理浓度的NO是早期胚胎正常发育及附植必不可少的,NO不足或过量也会影响胚胎的发育,甚至引起凋亡,故生理浓度的NO可作为调控各阶段胚胎正常发育的重要指标。同时,NO的调节方式还存在着明显的物种差异,由于NO半衰期非常短并且极其不稳定,为此大多数对于NO的研究机理都是以研究NOS的调控为基础,已有研究发现,小鼠胚胎发育各阶段均能检测到NOS的3种亚型基因表达,并且均在桑葚胚期表达量达到最高,囊胚期降至最低[16];而牛早期胚胎发育各阶段NOS mRNA仅在4-细胞期均有表达,8-细胞期均不表达;在未成熟卵母细胞均有表达,成熟卵母细胞中只有eNOS、iNOS表达[15];而在水牛未成熟卵母细胞、成熟卵母细胞以及胚胎发育各阶段3种NOS亚型基因均表达[17]。对于NOS的3个亚型在绵羊早期胚胎发育各阶段是否表达,NO怎样参与调控绵羊早期胚胎发育过程还尚未见报道。
本研究应用实时荧光定量PCR技术,检测绵羊卵母细胞成熟及胚胎发育各阶段一氧化氮合酶的3个亚型的基因表达情况。结果显示,绵羊未成熟卵母细胞、成熟卵母细胞及早期胚胎发育各阶段nNOS、iNOS、eNOS mRNA 均有表达,故 NO 参与调控绵羊卵母细胞成熟和早期胚胎发育过程;nNOS在未成熟卵母细胞、成熟卵母细胞中的表达量均高于eNOS、iNOS的表达量(P<0.05),说明绵羊早期胚胎发育的基础阶段即卵母细胞成熟过程中,主要由nNOS基因介导产生的NO就已经开始发挥其生理作用;nNOS、iNOS mRNA表达水平在胚胎各时期均高于eNOS的表达水平(P<0.05),说明在绵羊早期胚胎发育各阶段产生的NO主要由nNOS、iNOS介导。胚胎发育过程中,2-细胞期nNOS基因表达水平显著降低(P<0.05),此时为母源型基因调控时期,可能是由于母源型mRNA降解造成表达水平出现降低;8-细胞期nNOS表达水平出现显著升高(P<0.05),此时正是母源型基因调控向合子型基因调控转化时期,同时也是胚胎致密化发生的开始时期,可能大量Ca2+内流支持胚胎发育,nNOS活性升高产生大量的NO;与此同时,iNOS mRNA水平也在此时期表达增加,而iNOS合成NO的作用机制与nNOS不同,其主要受iNOS基因转录水平和NO的反馈调节。故推测胚胎致密化开始需要相对较高浓度的NO维持胚胎分裂发育。桑葚胚期nNOS、iNOS表达量继续维持较高水平,此时期正是胚胎进入子宫,子宫内膜血管增生,而NO有促使毛细血管通透性的作用。另外,绵羊早期胚胎体外发育阻滞时期为8细胞~16细胞,更是母源型基因调控向合子型基因调控转化时期,而此时nNOS、iNOS均大量表达,说明NO参与绵羊胚胎早期分化,并为胚胎正常发育提供必要条件,这可能具有实质性的生理意义。到囊胚期,随着细胞数量快速大量增加,可能由于nNOS在桑葚胚期大量表达,为防止Ca2+大量沉积保护胚胎维持正常发育,故nNOS在囊胚期表达量显著降低(P<0.05);iNOS的表达量也出现显著降低,可能也是因为桑葚胚期NO含量过高引起负反馈调节造成。
总之,本试验证实了绵羊体外未成熟卵母细胞、成熟卵母细胞及胚胎发育过程中nNOS、eNOS、iNOS mRNA均持续表达,故NO可能参与调控绵羊卵母细胞成熟和早期胚胎过程,尤其在8-细胞期到桑葚胚期这一特定阶段可能具有实质性的生理意义;绵羊卵母细胞成熟过程中的NO可能主要由nNOS介导;而早期胚胎发育过程中的NO则可能主要由nNOS和iNOS共同介导调控。充分了解一氧化氮合酶3种亚型的基因表达情况,对进一步了解NO影响胚胎发育的具体作用机理具有一定生物学意义;同时,对进一步研究其在生殖系统中的作用奠定基础。
[1]Nathan C,Xie Q W.Nitric oxide synthases:roles,tolls,and controls[J].Cell,1994,78(6):915-918.
[2]赵慧卿.一氧化氮合酶的作用机制[J].生命的化学,1998,8(1):22-24.
[3]Zhang W,Wei Q W,Wang Z C,et al.Cell-specific expression and immunolocalization of nitric oxide synthase isoforms and the related nitric oxide/cyclic GMP signaling pathway in the o-varies of neonatal and immature rats[J].J Zhejiang Unive Sci B,2011,12(1):55-64.
[4]汪 涛,刘 宇,黄群山,等.一氧化氮对动物生殖机能的影响[J].动物医学进展,2006,27(2):27-30.
[5]陶 勇.一氧化氮与猪卵母细胞减数分裂成熟[D].北京:中国农业大学,2004.
[6]Jablonka Shariff A,Olson L M.Nitric oxide is essential for optimal meiotic maturation of murine cumulus-oocyte complexes in vitro[J].Mol reprod develop,2000,55(4):412-421.
[7]Huo L J,Liang C G,Yu L Z,et al.Inducible nitric oxide synthase-derived nitric oxide regulates germinal vesicle breakdown and first polar body emission in the mouse oocyte[J].Reproduction,2005,129(4):403-409.
[8]Biswas S,Kabir S,Pal A.The role of nitric oxide in the process of implantation in rats[J].J Reprod Fertil,1998,114(1):157-161.
[9]Gouge R,Marshburn P,Gordon B,et al.Nitric oxide as a regulator of embryonic development[J].Biol Reprod,1998,58(4):875-879.
[10]郭延华,唐利容,石国庆,等.绵羊不同直径卵泡卵母细胞体外成熟及胚胎发育能力的比较[J].畜牧与兽医,2011,43(1):3-9.
[11]Schmittgen T D,Zakrajsek B A.Effect of experimental treatment on housekeeping gene expression:validation by realtime,quantitative RT-PCR[J].J Biochem Biophys Meth,2000,46(1):69-81.
[12]朱 亮,章孝荣,刘 亚,等.一氧化氮与卵母细胞发育[J].动物医学进展,2010,31(2):107-110.
[13]Chen H W,Jiang W S,Tzeng C R.Nitric oxide as a regulator in preimplantation embryo development and apoptosis[J].Fertility and Sterility,2001,75(6):1163-1171.
[14]Barroso R P,Osuamkpe C,Nagamani M,et al.Nitric oxide inhibits development of embryos and implantation in mice[J].Mol Human Reprod,1998,4(5):503-507.
[15]Tesfaye D,Kadanga A,Rings F,et al.The effect of nitric oxide inhibition and temporal expression patterns of the mRNA and protein products of nitric oxide synthase genes during in vitro development of bovine pre-implantation embryos[J].Reprod Domes Anim,2006,41(6):501-509.
[16]张 璐.小鼠早期胚胎中nNOS,iNOS和eNOS mRNA的表达[D].湖南长沙:湖南农业大学,2005.
[17]Rameshbabu K,Sharma R,Singh K,et al.Presence of nitric oxide synthase immunoreactivity and mRNA in buffalo(Bubalus bubalis)oocytes and embryos[J].Reprod Domes Anim,2012,47(2):e22-e25.

