不同林龄沙地樟子松人工林细根垂直分布特征1)
王 凯 宋立宁 吕林有 祝 畅
(辽宁工程技术大学,阜新,123000) (中国科学院沈阳应用生态研究所) (辽宁省风沙地改良利用研究所) (辽宁工程技术大学)
樟子松(Pinus sylvestris var. mongolica)具有较强的耐寒和耐旱能力,成为“三北”防护林工程和防沙治沙工程的主要树种[1],对减轻我国“三北”地区风沙侵蚀发挥了重要作用[2]。但自20 世纪90年代以来,在许多樟子松引种栽培的地方,特别是辽宁章古台地区,出现了大面积樟子松(30年左右)枯枝死亡、生长衰退现象[3],对“三北”地区防护林建设及荒漠化治理造成巨大损失。
细根指直径≤2 mm 的根,是林木吸收水分和养分的主要通道[4],其垂直分布特征反映了林木对土壤水分和养分的利用状况,直接影响到林木地上部分生长及生态效益发挥[5]。细根生物量常用来评价细根吸收水分和养分的能力[6],细根生物量及其生理生态活动的维持依赖于投入到细根的光合产物[7],而细根将光合产物主要用于增加单位体积长度,扩大与土壤的接触面积,从而吸收更多的水分和养分[8]。林木细根长度和面积与土壤水分和养分吸收密切相关[9],细根根长密度(单位土壤体积的根长)和根面积指数(单位土壤面积的细根面积)决定了细根吸收水分和养分的能力[10],在反映细根生理生态功能方面比生物量更科学[11-12]。樟子松细根研究主要集中在细根寿命和生产力,营养元素含量和分布及适应性[13-15]等方面,缺少对不同林龄樟子松细根的比较研究。本研究以不同林龄樟子松细根为对象,分析其根长密度和根面积指数的垂直分布特征,探讨其与土壤含水量的关系,试图为樟子松人工林衰退现象从细根分布方面作出科学解释。
1 研究地区概况
研究区位于辽宁省风沙地改良利用研究所章古台试验基地,中心地理坐标为122°32'E,42°42'N。该区位于科尔沁沙地东南部,海拔高度345.1 m,年平均气温6.82 ℃,极端最低气温-33.4 ℃,极端最高气温43.2 ℃;年均降水量450 mm,年均蒸发量为1 590 mm,降水主要集中在6—8月份。土壤以风沙土为主,植被属内蒙古植物区系,以抗旱性较强的沙生植物为主。
2 研究方法
于2012年8月在章古台试验站,选择地形要素(坡度、坡向、坡形)基本一致的10、22、32、42年生樟子松人工林样地(表1),不同林分密度为现有林分的常见经营密度。在每个样地内分别设置3 个20 m×20 m 的样方,样方内进行每木检尺,选择标准木5 株,按照1/4 样圆法[16]确定采样地点采集根样和土样,即在以1/2 株距为半径的圆周上均匀选取3 个点,再以1/4 株距为半径的圆周上均匀选取2 个点,用土钻(Φ=7 cm)在0 ~100 cm 土层中分层取样,每10 cm 为1 层,共10 层。连土带根装入塑封袋,编号后带回实验室。
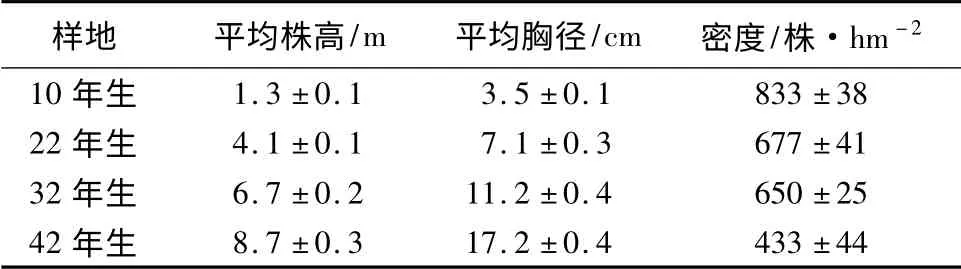
表1 不同林龄樟子松样地概况
根据根系外形、颜色、弹性等区别死根和活根,用镊子将活根夹入装有蒸馏水的小塑料盆中,用清水冲洗干净、晾干。对于直径小于2 mm 的细根用游标卡尺(精度为0.02 mm)测量出直径(R)和长度(L),根面积=π·R·L,计算出每层细根的根长密度(即单位土壤体积的根长)和根面积指数(根面积/地表面积);同时用铝盒法测量相应土层的含水量(图1)。
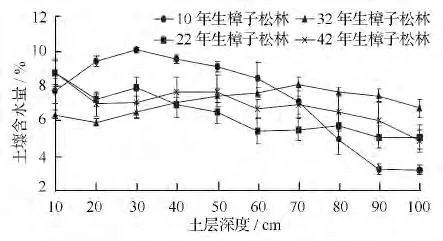
图1 不同林龄樟子松林土壤含水量
对于不同年龄樟子松林细根垂直分布特征运用根系垂直分布模型Y =1 -βd[17]进行计算。式中:Y为从表层到一定深度土层的根系量(根长密度或根面积指数)累积百分比,d 表示土层深度(cm),β 为根系消弱系数。同时根据Y =1 -βd计算R50(即含50%总根长密度或根面积指数的土层深度)[10]。运用LSD 检验方法比较不同林龄及不同土层樟子松细根根长密度或根面积指数的差异性,并对细根根长密度和根面积指数与土壤含水量的关系采用Spearman 方法进行相关分析,所有数据均采用SPSS16.0 进行分析。
3 结果与分析
3.1 不同林龄樟子松细根根长密度
不同林龄樟子松细根根长密度在不同土层分布具有明显差异(表2)。10年生樟子松林细根根长密度从表层到30 cm 土层逐渐增加,往下又逐渐降低,20 ~30 cm 土层显著高于其它土层(P <0.05);22年生樟子松林细根根长密度在表层最大,往下逐渐降低;32年生樟子松林表层细根根长密度显著高于100 cm 土层(P <0.05),其它土层间差异不显著(P >0.05);42年生樟子松林细根根长密度在0 ~20 cm 土层显著高于70 ~100 cm 土层(P <0.05)。
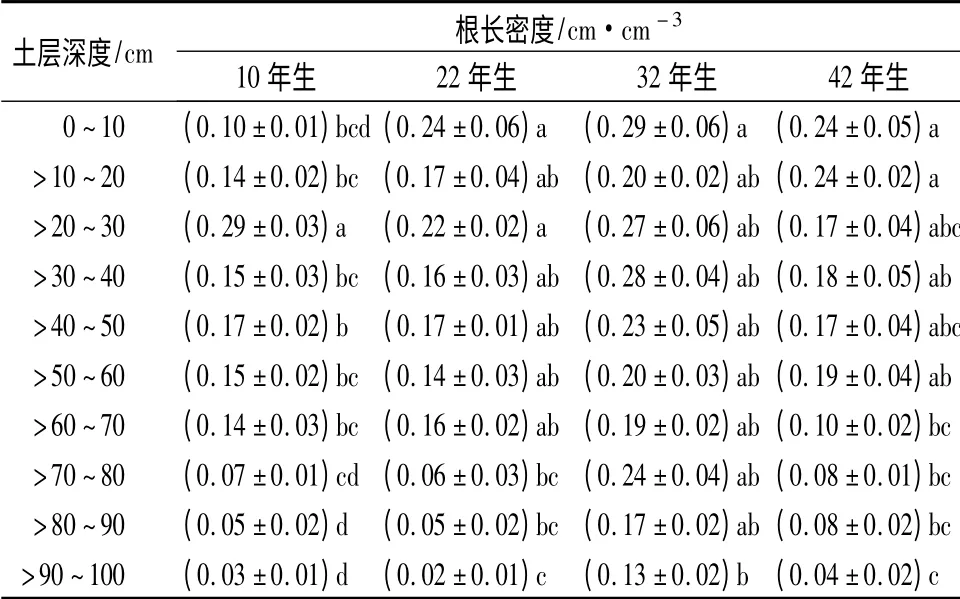
表2 不同林龄樟子松细根根长密度垂直分布特征
3.2 不同林龄樟子松细根根面积指数
不同林龄樟子松细根根面积指数在不同土层分布具有明显差异(表3)。10年生樟子松林细根根面积指数在>10 ~30 cm 土层显著高于其它土层(P<0.05);22年生樟子松林细根根面积指数从表层到70 cm 土层无显著差异(P >0.05),从>70 ~80 cm 土层显著下降(P <0.05);32年生樟子松林表层细根根面积指数显著高于>90 ~100 cm 土层(P <0.05),其它土层间差异不显著(P >0.05);42年生樟子松林细根根面积指数在0 ~20 cm 土层显著高于>90 ~100 cm 土层(P <0.05)。
3.3 不同林龄樟子松细根垂直分布特征
樟子松林50%细根长度分布在0 ~37.0 cm 范围内(表4),其中32年生樟子松林分布最深,β =0.981;樟子松林50%细根面积分布在0 ~37.6 cm范围内(表4),32年生樟子松林分布最深,β =0.982。在0 ~100 cm 土层,32年生樟子松林细根总根长密度和根面积指数均显著高于其它龄林(P <0.05),而其它年龄樟子松林间差异均不显著(P >0.05)。
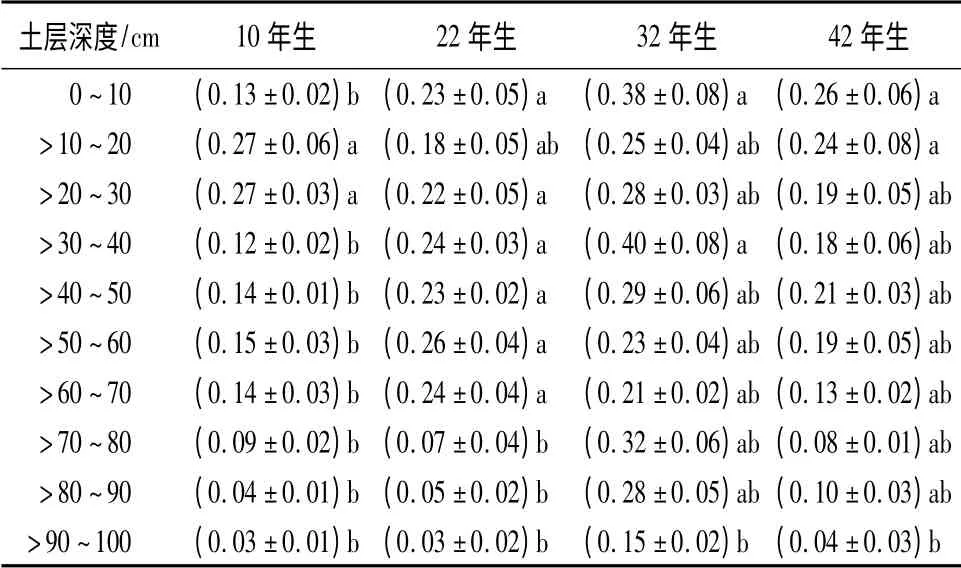
表3 不同林龄樟子松林细根根面积指数垂直分布特征

表4 樟子松林细根分布深度特征
3.4 不同林龄樟子松细根垂直分布与土壤含水量的关系
10、22、42年生樟子松林细根根长密度与土壤含水量呈极显著线性相关(P <0.01),斜率随林龄逐渐增大,而32年生樟子松林与土壤含水量无显著关系(P >0.05,表5);10、42年生樟子松林细根根面积指数与土壤含水量呈显著正相关(P <0.05),而22、32年生樟子松林与土壤含水量不相关(P >0.05,表5),除32年生樟子松林外,斜率随林龄逐渐增加。
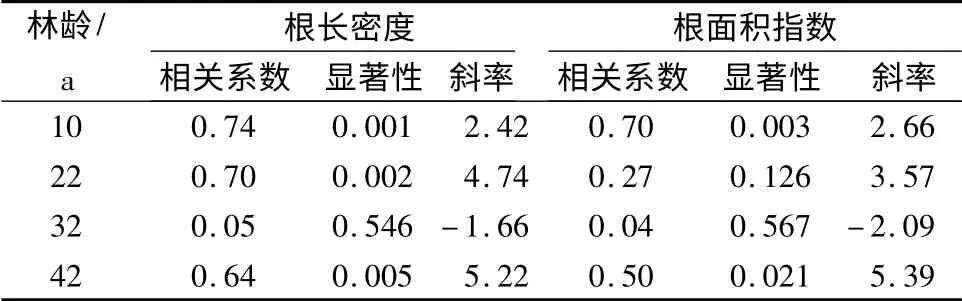
表5 樟子松林细根垂直分布与土壤含水量的相关关系
4 讨论
根系分布深度是林木对生长环境的响应[4],Gale 等[17]通过研究不同演替阶段树种根系分布特征,提出了根系垂直分布模型Y =1 -βd,β 值越大,说明根系在深层土壤中分布比例越大,β 值越小,说明根系主要集中分布于接近土壤表层[11]。本研究发现章古台地区沙地樟子松人工林细根根长密度和根面积指数的β值变化范围分别为0.974 ~0.981 和0.974 ~0.982,高于全球植物群落根系分布平均水平(β =0.966),与沙漠植物相当(β =0.975)[10,18]。以往研究发现樟子松80%的根系生物量分布在>20 ~40 cm 土层[19],而本研究发现沙地樟子松林50%的细根长度和面积分布在0 ~37.6 cm 范围内。由于林木对水分和养分吸收主要取决于细根面积和长度[11],因此,用细根面积和长度比生物量更能反应细根垂直分布的功能特征及生态意义[12]。
随着林分年龄逐渐增加,林木地上部分生物量呈现出先增加后减少的S 型生长曲线,地下部分由于光合产物分配也会作出响应[20]。本研究发现沙地樟子松人工林细根总根长和面积随着年龄增加逐渐升高,到32 a 达到最大,然后逐渐降低;这与杉木人工林[21]和马尾松人工林[22]细根随林龄分布趋势相似。细根长度和面积随林龄变化可能与樟子松林地土壤状况有关,已往研究发现樟子松人工林的土壤养分、微生物和酶活性随着林龄增大而增加,到30 a 达到最大,之后逐步下降,土壤状况恶化[23];这与樟子松林细根长度和面积的变化趋势一致。本研究还发现10年生樟子松林在表层细根根长密度和根面积指数明显小于其它年龄樟子松,这可能主要由于10年生樟子松林分没有郁闭,土壤表层温度较高,根菌难以存活[19],致使表层细根分布较少。22、32、42年生樟子松林林分已经郁闭,从表层到底层细根根长密度和根面积指数呈现逐渐下降趋势。其中32年生樟子松林下降最为缓慢,在>90 ~100 cm土层才显著降低(P <0.05);并且在>70 ~100 cm土层细根的长度和面积占总根长和面积的比例分别为25%和27%,高于其它林龄樟子松(9% ~14%)(表2、表3),这说明32年生樟子松林为了获得更多水分比其它林龄樟子松在深层土壤中分布的细根更多。
土壤水分是限制林木细根分布的关键因子[24],土壤含水量升高会促使细根大量生长,同时细根吸水及蒸发又导致含水量下降[25];细根生长和分布与土壤水分联系紧密,但这种关系有时为正相关,有时为负相关[26]。本研究发现,10、22、42年生樟子松林细根长度与土壤含水量呈极显著正相关(P <0.01),10年生和42年生樟子松细根面积与土壤含水量呈显著正相关(P <0.05),而32年生樟子松林细根长度或面积均与土壤含水量不相关(P >0.05)。这表明根面积和长度增加虽然提高了樟子松细根的吸水性,但同时也加剧了个体内和个体间地下部分对水分的竞争,从而加速消耗土壤水分;32年生樟子松林以增加细根面积和长度为代价获取水分导致生境中本已短缺的水资源更加匮乏,致使以后樟子松林细根长度和面积显著下降,林分发生衰退。研究还发现,樟子松林随着林龄增加,细根长度或面积与土壤含水量线性关系的斜率逐渐增大(32年生除外)(表5),这表明沙地樟子松在增加等量的细根长度和面积时,随着林龄增大,水分需求逐渐增多。一旦水分难以维持细根生长需求,细根长度和面积就会下降,获取的资源相应减少,林木生长衰退,林分发生退化。
5 结论
32年生樟子松林细根总根长密度和根面积指数均显著高于其它林龄樟子松(P <0.05),在>70 ~100 cm 土层,其细根的长度和面积占总根长和面积的比例分别为25%和27%,其它林龄樟子松所占比例在9% ~14%之间,说明32年生樟子松林在深层土壤中分布的细根更多。
10、22、42年生樟子松林细根长度与土壤含水量呈极显著正相关(P <0.01),10、42年生樟子松细根面积与土壤含水量呈显著正相关(P <0.05),而32年生樟子松林细根长度或面积与土壤含水量均无显著相关关系(P >0.05)。
32年生樟子松林细根根长密度更高,面积更大,分布更深,过度消耗了水资源,这可能是樟子松林分发生衰退的原因之一。
[1] 康宏樟,朱教君,许美玲. 沙地樟子松人工林营林技术研究进展[J].生态学杂志,2005,24(7):799 -806.
[2] Zhu J J,Fan Z P,Zeng D H,et al. Comparison of stand structure and growth between plantation and natural forests of Pinus sylvestris var. mongolica on sandy land[J]. Journal of Forestry Research,2003,14(2):103 -111.
[3] 朱教君,曾德慧,康宏樟,等. 沙地樟子松人工林衰退机制[M].北京:中国林业出版社,2005.
[4] Copley J. Ecology goes underground[J]. Nature,2000,406:452-454.
[5] Laclau J P,Arnaud M,Bouillet J P,et al. Spatial distribution of Eucalyptus roots in a deep sandy soil in Congo:relationships with the ability of the stand to take up water and nutrients[J]. Tree Physiology,2001,21(2/3):129 -136.
[6] Eissenstat D M,Yanai R D. The ecology of root lifespan[J]. Advances in Ecological Research,1997,27:1 -60.
[7] 梅莉,王政权,韩有志,等. 水曲柳根系生物量、比根长和根长密度的分布格局[J].应用生态学报,2006,17(1):1 -4.
[8] 燕辉,刘广全,李红生.青杨人工林根系生物量、表面积和根长密度变化[J].应用生态学报,2010,21(11):2763 -2768.
[9] Jackson R B,Mooney H A,Schulze E D. A global budget for fine root biomass,surface area,and nutrient contents[J]. Proceedings of the National Academy of Sciences of the USA,1997,94(14):7362 -7366.
[10] 张国盛,吴国玺,王林和,等.毛乌素沙地臭柏(Sabina vulgaris)和油蒿(Artemisia ordosica)群落的细根分布特征[J]. 生态学报,2009,29(1):18 -27.
[11] 何维明.不同生境中沙地柏根面积分布特征[J].林业科学,2000,36(5):17 -21.
[12] Robinson D,Hodge A,Fitter A. Constraints on the form and function of root systems[M]//Kroon HD,eds. Root Ecology.Heidelk-berg:Springer-Verlag,2003:1 -26.
[13] 邱俊,谷加存,姜红英,等. 樟子松人工林细根寿命估计及影响因子研究[J].植物生态学报,2010,34(9):1066 -1074.
[14] 刁淑清,沈海龙,丛健.樟子松林木养分元素含量与分布[J].东北林业大学学报,2009,37(1):17 -19.
[15] 柴源,徐程扬,袁士保,等.大兴沙地中11 个树种基于根系形态的适应性[J].东北林业大学学报,2012,40(4):20 -24.
[16] 李鹏,李占斌,赵忠.根系调查取样点数确定方法的研究[J].水土保持研究,2003,10(1):146 -149.
[17] Gale M R,Grigal D F. Vertical root distributions of northern tree species in relation to successional status[J]. Canadian Journal of Forest Research,1987,17(8):829 -834.
[18] 张喜英. 作物根系与土壤水分利用[M]. 北京:气象出版社,1999:7 -24.
[19] Zhu J J,Li F Q,Xu M L,et al. The role of ectomycorrhizal fungi in alleviating pine decline in semiarid sandy soil of northern China:an experimental approach[J]. Annals of Forest Science,2008,65(3):303 -314.
[20] Yuan Z Y,Chen H Y H. Fine root biomass,production,turnover rates,and nutrient contents in boreal forest ecosystems in relation to species,climate fertility,and stand age:literature review and meta-analyses[J]. Critical Reviews in Plant Sciences,2010,29(4):204 -221.
[21] 程瑞梅,王瑞丽,肖文发,等. 三峡库区马尾松根系生物量的空间分布[J].生态学报,2012,32(3):823 -832.
[22] 陈光水,杨玉盛,高人,等. 杉木林年龄序列地下碳分配变化[J].植物生态学报,2008,32(6):1285 -1293.
[23] 杨涛,徐慧,李慧,等.樟子松人工林土壤养分、微生物及酶活性的研究[J].水土保持学报,2005,19(3):50 -53.
[24] 王迪海,赵忠,李剑.土壤水分对黄土高原主要造林树种细根表面积季节动态的影响[J].植物生态学报,2010,34(7):819 -826.
[25] 张志山,李新荣,张景光,等. 用Minirhizotrons 观测柠条根系生长动态[J].植物生态学报,2006,30(3):457 -464.
[26] 成向荣,黄明斌,邵明安.神木水蚀风蚀交错带主要人工植物细根垂直分布研究[J]. 西北植物学报,2007,27(2):321 -327.
