含氟甾体液晶研究
沈悦海 李继响 马亚云 闻建勋*
(1.昆明理工大学,昆明 650500;2.上海天问化学有限公司,上海 200232)
甾类化合物是最早发现的一类液晶[1]。19世纪以来,甾类化合物的化学结构与液晶性质间的关系一直受到关注,研究者们已合成了多种甾类液晶[2]。目前甾类液晶的主要用途是作为液晶配方中的添加剂,以在非手性的向列相液晶中引入手性[3]。近年来发现含有甾体结构片段的异二核液晶 (steryl-containing hetero-dimer liquid crystals)具有复杂的相变性质,常呈现多种新相态如蓝相(blue phase)和TGB相(twist grain boundary phases)等,是目前较活跃的研究领域[4]。
Yang等人于1992年发现,胆甾相液晶在0电场下出现多稳定相态织构现象后,反射式胆甾相液晶显示(Ch-LCD)已经发展成为一种新型的显示模式[5]。它具有0电场记忆特性,能耗很小。因为不需要偏振片及背光源,具有高的反射能力及宽视角,因此能够实现类似纸张一样的阅读效果,特别适用于电子书籍阅读器、商业广告等领域。
一般来说,甾类液晶可划分为3个结构单元,即3β-取代基、17β-侧链和甾核。甾核中的4个环均为刚性的反式稠合,3β-取代基和17β-侧链位于甾核所处的平面内,使整个分子呈较规则的带状。甾类液晶的立体构型符合棒状分子液晶化合物的特征,即包含1个刚性核和1个或2个柔性侧链,其中刚性核可以是甾核本身,如胆甾烯基己酸酯,但有时3β-取代基也是刚性核的组成部分,如胆甾烯基己酸酯(Cr 99.5 N*101.5 I。Cr,晶相;N*,手性向列相;I,各向同性液体)

但有时3-取代基也是刚性核的组成部分,如胆甾烯基苯甲酸酯
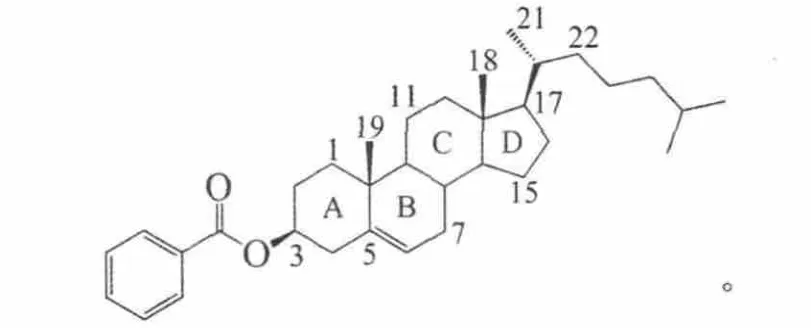
在相变性质方面,甾类液晶有其独特之处,分子间侧向作用力通常较弱,而末端作用力较强,因此多呈现手性向列相(旧称胆甾相),只有当分子中存在较长端链时才出现近晶相。这可能由于甾类液晶结构上的特殊性引起。首先,甾核基本上是饱和的碳氢体系,可极化性弱,削弱了分子间相互作用;其次,甾核上的18-和19-角甲基与分子平面垂直,使分子间不易形成紧密堆积;另外,与1,4-环己基和连二环己基等对称的液晶核不同,甾核的D环一带形状并不规则,虽然21-甲基的存在限制了17-侧链的自由旋转,使其能保持在甾核所处平面内,但也在一定程度上增加了整个分子的宽度,影响了分子间的侧向作用力。
甾类液晶的制备一般以天然的甾体化合物为原料,如胆甾醇

其中胆甾醇最为常用。胆甾醇本身并非液晶化合物,但经酯化等修饰后即具有良好的液晶性,因此目前对胆甾醇衍生物的认识已比较深入。另一方面,天然甾体化合物来源较为有限,且甾体的结构改造比较困难,制约了对其他结构类型的甾类液晶的研究。尽管在上世纪60和70年代因液晶逐渐实用化而掀起的研究热潮中,甾类液晶的研究也曾有一个小高峰,涌现了一些开拓性的工作,如Pohlmann等对17-侧链构效关系的研究[6]。但总的来说,在甾核和17-侧链的构效关系方面仍有待深入的研究。
笔者等在甾类液晶方面的工作主要基于如下考虑:
1)甾类液晶3β-取代基的构效关系。近年来含氟液晶的研究非常活跃,笔者在这一领域也进行了大量的工作,基于这些工作,可将氟代芳基和全氟烷基等含氟官能团引入甾类液晶的3β-取代基中,以考察对构效关系的影响。
2)甾类液晶17-侧链的构效关系。猪去氧胆酸是易得的天然甾体之一,能较为便捷地转化为具有平面构型的3β-羟基-5-胆烯酸,通过不同的方法改造其17-侧链,可考察不同基团对其构效关系的影响。
如下为目标化合物的总体设计方案,以及一些具有代表性的化合物系列(Me为甲基):

1 化合物的合成路线
目标化合物的制备通法:

甾醇羧酸酯类化合物可由相应的甾醇和羧酸经酯化反应得到。胆甾烯基碳酸酯和胺基甲酸酯可由胆甾烯基氯甲酸酯和相应的苯酚或苯胺反应得到。
试剂与条件:a.二环己基碳二亚胺(DCC),二甲基氨基吡啶,四氢呋喃(THF,羧酸酯制备);b.三乙胺,二氯甲烷(碳酸酯和氨基甲酸酯制备)。
目标化合物制备所需关键中间体的合成方法:以多氟溴苯为原料,可经格氏试剂的不同反应,得到多氟苯甲酸、多氟肉桂酸和多氟苯酚等中间体:
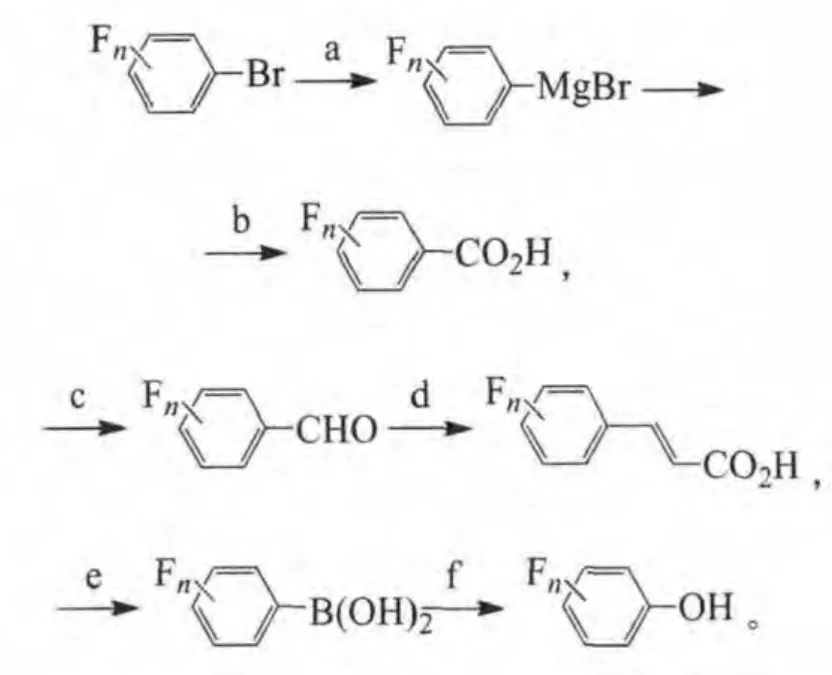
试剂与条件:a.镁,THF;b.二氧化碳,0℃;c.N, N-二甲基甲酰胺(DMF),0℃;d.丙二酸,哌啶,吡啶,25~115℃;e.硼酸三甲酯,-78℃;稀盐酸;f.过氧化氢,乙醚。
含全氟烷基的苯甲酸、苯酚和苯胺等中间体则由相应的芳基碘化合物与全氟碘代烷反应得到(Rf为全氟烷基):
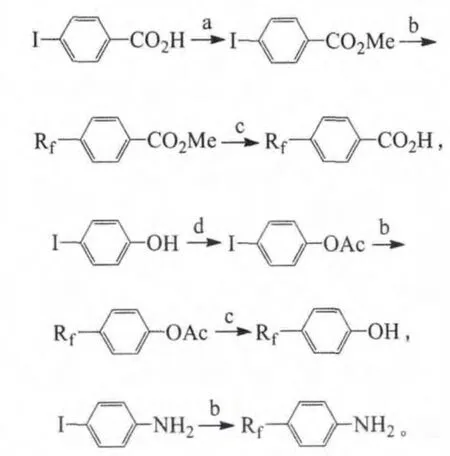
试剂与条件:a.硫酸,甲醇;b.RfI,铜粉,DMF,120℃;c.氢氧化钾,甲醇;d.乙酰氯,三乙胺,二氯甲烷。
17-侧链全氟烷基化的甾醇的合成系由猪去氧胆酸出发,经4步反应转化为3β-羟基-5-胆烯酸,再经脱羧和全氟烷基加成等步骤得到(Ts为对甲苯磺酰基):

试剂与条件:a.硫酸,甲醇;b.对甲基苯甲酰氯,吡啶;c.乙酸钾,DMF,水,110℃;d.氢氧化钾,甲醇;e.乙酸酐,吡啶;f.四乙酸铅,乙酸铜,苯,吡啶,回流;氢氧化钾,甲醇;g.RfI,联二亚硫酸钠,碳酸氢钠,二氯甲烷,水,40℃;氢化锂铝,THF。
而17-侧链烷基化的甾醇则通过3β-羟基-5-胆烯酸17-侧链的还原和铜催化的格氏反应获得:


试剂与条件:a.二氢吡喃(DHP),对甲基苯磺酸,二氯甲烷;b.氢化锂铝,THF;c.对甲基苯磺酰氯,三乙胺,二氯甲烷;d.RMgBr,Li2CuCl4,THF;稀盐酸。
另外,3β-羟基-5-胆烯酸的同系列直链烷基酯可通过酸催化酯化和羧酸盐的烷基化反应得到:

试剂与条件:ROH,硫酸;或RBr,碳酸钾,18-冠醚-6,DMF。
2 化合物的相变研究
通过偏光显微观察和差示扫描量热法(DSC),较系统地研究了甾类化合物结构对其液晶性能的影响[7-14]。
2.1 酰基片段含氟代芳基的甾类液晶
2.1.1 甾醇多氟苯甲酸酯
甾醇多氟苯甲酸酯(化合物A)

的相变温度列如表1。这些化合物均呈手性向列相(N*)。
对于胆甾烯基酯化合物(A1),对比A1-35与A1-345可看出,3β-苯甲酰氧基中对位氟代对化合物相变性质的影响。与A1-35相比,A1-345的熔点较高,但清亮点升高更多,液晶相温区变宽。这可能是由于对位氟处在分子的轴向上,增大了分子的长宽比。另一方面,由化合物A1-34和A1-345则可看出间位氟代的影响。与胆甾烯基4-氟苯甲酸酯(Cr 152~154 N*227 I)相比,A1-34的熔点基本不变,清亮点有所下降;A1-345的清亮点进一步下降,熔点则有所上升。这是由于间位氟处于侧向,其引入使分子的宽度增加,长宽比减小,导致液晶性下降。

表1 甾醇多氟苯甲酸酯(A)的相变性质Tab 1 Phase transition properties of sterol fluorine benzoate
进一步的分析可看出,化合物A1中对位和间位氟代影响的相对强弱。化合物A1-34同时含有对位和间位氟,其液晶性好于非氟母体胆甾烯基苯甲酸酯(Cr 145.8 N*180.7 I),说明对位氟对液晶相的稳定作用比间位氟对液晶相的抑制作用强得多。
对其他棒状分子液晶体系的研究表明,当多氟苯环通过炔基、酰氧基、酯基和丙烯酯基与分子刚性核的其他部分连接时,氟取代位置的变化对液晶相态及其热稳定性有较大影响。一般而言,对位取代能改善液晶相的热稳定性,而邻、间位取代均在不同程度上对液晶性不利,这与笔者在甾醇多氟苯甲酸酯系列中观察到的现象一致。不同之处在于,甾醇多氟苯甲酸酯只呈现手性向列相,而在其他棒状分子液晶体系中,氟代位置的不同有时会使相态发生改变。
胆甾烷基和7-去氢胆甾烯基多氟苯甲酸酯(A2和A3)也具有相似的规律。对于胆甾烷基酯,由于饱和碳架的可极化性较低,与其胆甾烯基类似物相比,熔点和清亮点均下降,液晶相温区变窄。其中,胆甾烷基3,5-二氟苯甲酸酯A2-35转变为单变液晶。而对于7-去氢胆甾烯基酯,尽管化合物本身受热不稳定,但7-双键的引入增大了分子的可极化性,使液晶性有所提高。
17-侧链上末端基团的变化对化合物的液晶性有很大的影响。与A1相比,A4的熔点明显升高,而N*-I相变点变化不大,使部分化合物(A4-35,A4-345)成为单变液晶。这可能由于24-酯基体积较大,在侧链自由旋转时需要更大的空间,减小了分子间作用力而引起。有趣的是,氟代位置的不同对A4液晶性的影响较A1显著得多。A4-4的液晶相温区宽度与胆甾烯基4-氟苯甲酸酯(Cr 152~154N*227 I)相仿,但对于A4-34,1个间位氟的引入使液晶相温区急剧收窄。
化合物A5与A4相比,熔点升高,清亮点降低,液晶性进一步下降,这同样由于B环中双键的饱和减弱了分子间作用力而致。
2.1.2 甾醇氟代肉桂酸酯
甾醇氟代肉桂酸酯(化合物B)。

也呈手性向列相,其相变温度列如表2。
与多氟苯甲酸酯(A)相比,本系列化合物的液晶性较好,熔点降低、清亮点提高,使液晶相温区大幅扩展。分子中刚性核较长应是这一现象的原因。
本系列中B环饱和度对液晶性的影响随着侧链末端基团的改变而呈现不同的趋势。对于胆甾醇衍生物B1、B2和B3,B环饱和度的增加使化合物的熔点上升、清亮点降低、液晶相温区变窄;但在胆酸衍生物B4和B5中,B环的饱和使熔点和清亮点同时下降,液晶相温区宽度基本不变。
此外,与化合物A相比,本系列中氟代位置变化对液晶性的影响较不明显。在此,由于反式双键的引入增长了分子的刚性核,使氟原子的位置变化对分子长宽比的影响相对减弱。

表2 甾醇多氟肉桂酸酯(B)的相变性质Tab 2 Phase transition properties of sterol fluorine cinnamic acid ester
2.1.3 甾醇氟代4-烷氧基苯甲酸酯
对于棒状分子液晶,在分子中引入侧向氟原子一般会降低清亮点温度,甾醇氟代4-烷氧基苯甲酸酯(化合物C)

系列亦不例外,见表3。
式中:SN为额定容量,kVA;Di为铁心内径,m;lt为铁心长度,m;nN为额定转速,r/min;C为利用系数,kVA·m3·r/min;K为常数,K=1.35×10-6;A为定子电负荷,A/cm;Bδ为气隙磁密,T。

表3 甾醇氟代4-烷氧基苯甲酸酯(C)的相变性质Tab 3 Phase transition properties of sterol fluorine 4-alkoxy benzoate
同侧二氟取代的化合物C1与非氟母体胆甾烯基4-烷氧基苯甲酸酯

(见表4)相比,清亮点均有所下降,其中短碳链的化合物因熔点降幅更大,液晶相温区得以扩展,但长碳链的化合物则相反。此外,C1中的侧向氟代也抑制了近晶相的出现。上述现象可能由于侧向氟取代使分子的长宽比减小,分子间的距离增大,分子间侧向作用力减弱而导致。

表4 胆甾烯基4-烷氧基苯甲酸酯的相变性质Tab 4 Phase transition propertiesofcholestery 4-alkoxy benzoate
有趣的是,苯环上的单氟取代呈现非常不同的影响。与胆甾烯基4-烷氧基苯甲酸酯相比,间位氟代的化合物C3清亮点降低、熔点升高,仍出现近晶相;而邻位氟代的化合物C4则相变温度相差不大,但近晶相消失。
此系列中,胆甾烷基酯C2与胆甾烯基酯C1相比,B环双键的饱和降低了液晶性,熔点上升、清亮点下降,导致液晶相温区变窄。
对于胆酸衍生物,化合物C5和C6的对比也显示B环双键的饱和使液晶相温区变窄。这与肉桂酸酯类似物B4和B5中的现象有所区别。
值得注意的是,胆酸衍生物C5和C6的清亮点与胆甾醇衍生物C1和C2相仿,但熔点低20~40℃,使液晶相温区比后者更宽。这一现象显示了胆酸衍生物的特殊性,其侧链中的酯基在本系列中比烷基更有利于化合物的液晶性。
2.1.4 胆甾醇氟代苯基碳酸酯
胆甾醇氟代苯基碳酸酯系列(化合物D)

均呈单变的手性向列相,见表5。

表5 胆甾烯基多氟苯基碳酸酯(D)的相变性质Tab 5 Phase transition properties of cholestery fluorine phenyl carbonate
与胆甾烯基多氟苯甲酸酯(A1)相比,化合物D的液晶性明显下降。这可能由于刚性的酯基被柔性的碳酸酯基代替,导致刚性核缩短而致。
在此系列中,氟取代对各化合物的N*—I相变温度的影响由高到低依次为:
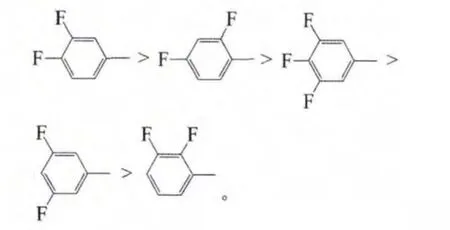
可以看出,在该系列中轴向上的对位氟能稳定液晶相,提高N*—I相变温度,而侧向上的间位和邻位氟则均对液晶性不利,其中邻位氟使液晶性下降更加明显。
2.2 酰基片段含全氟烷基的甾类液晶
2.2.1 甾醇4-全氟烷基苯甲酸酯
甾醇4-全氟烷基苯甲酸酯(化合物E)系列均为互变液晶,见表6,且主要呈近晶相。

在胆甾烯基酯E1中,氟碳链较短的化合物E1-4除近晶A相外,还有一个温区很窄的手性向列相;而氟碳链较长的化合物E1-6手性向列相消失,呈近晶A相和更加有序的近晶B相。化合物E1-8在DSC测定中,在熔点之上有2个热焓较大的吸热峰,表明有2个近晶相,但在偏光显微观测中难以观察到清楚的织构,尚无法确认其具体归属。

表6 胆甾烯基4-全氟烷基苯甲酸酯(E)的相变性质Tab 6 Phase transition propertiesofcholestery 4-perfluoroalkyl benzoate
与胆甾烯基苯甲酸酯相比,化合物E1不仅液晶相温区扩展,相态也发生改变。这可能由于氟碳链的亲氟憎油特性,使分子间作用力的对比发生了变化,侧向吸引力增强,有利于形成更加有序的相态。E系列中唯一的胆甾烷基酯E2-6呈近晶B相和手性向列相。与E1-6对照显示了甾核中5-双键的影响。E2-6的液晶相温区较E1-6窄得多,且出现了1个温区很窄的胆甾相,表明5-双键的饱和减弱了分子间作用力;但同时SB相温区变宽,可能因氟碳链对分子间作用力的贡献相对增加引起。
2.2.2 胆甾烯基4-全氟烷基苯基碳酸酯和氨基甲酸酯
与含有氟碳链的苯甲酸酯系列(化合物E)相似,在胆甾烯基4-全氟烷基碳酸酯(化合物F)系列

氟碳链对液晶相的稳定作用相当明显,见表7。

表7 胆甾烯基4-全氟烷基苯基碳酸酯(F)的相变性质Tab 7 Phase transition propertiesofcholestery4-perfluoroalkyl phenylcarbonate
含三氟甲基的碳酸酯F1-1呈单变的手性向列相,而氟碳链长度超过4个碳原子的化合物均为互变液晶,且氟碳链越长,液晶相温区越宽。另一方面,氟碳链的增长也有利于形成更加有序的液晶相。化合物F1-4具有互变的近晶A相和手性向列相,而氟碳链更长的F1-6和F1-8呈互变的近晶A相和单变的近晶B相。这些现象也是由于氟碳链的特殊性质引起。
本系列中的氨基甲酸酯(化合物F2)的相变性质与其碳酸酯类似物有所区别,仅呈互变的近晶A相。这可能由于N—H键对分子间作用力贡献引起。
2.3 含改造17-侧链的甾类液晶
2.3.1 侧链全氟烷基化氟代苯甲酸酯
17-侧链全氟烷基化的氟代苯甲酸酯系列(化合物G)

均为互变手性向列相液晶,见表8。

表8 23-全氟烷基甾醇多氟苯甲酸酯(G)的相变性质Tab 8 Phase transition properties of 23-perfluoroalkyl sterol fluorine benzoate
与相应的胆甾烯基酯类似物(化合物A)相比,化合物G的熔点较低,清亮点较高,胆甾相温区变宽,这说明侧链上引入氟碳链有利于形成液晶相。与其他含有全氟烷基的化合物相似,氟碳链的增长使清亮点上升,液晶相温区扩展。
在此系列中,3β-酰氧基中对位氟的引入能提高液晶性,而侧向氟的引入则相反,这一现象与前述各系列呈现的规律相同。
2.3.2 侧链全氟烷基化2,3-二氟代-4-烷氧基苯甲酸酯
侧链全氟烷基化的2,3-二氟-4-烷氧基苯甲酸酯系列(化合物H)
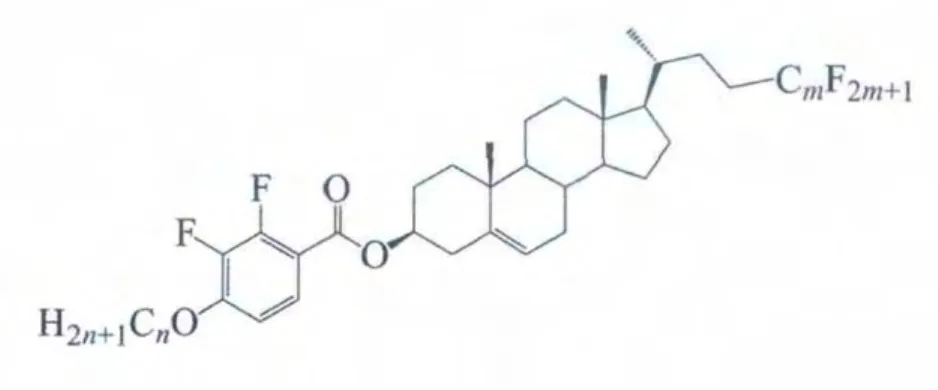
的相变性质与其他甾类液晶系列相比非常特殊,手性向列相消失,且样品在熔解后仍粘度很大,在偏光显微观测中难以观察到清楚的织构,无法确认液晶相的具体归属。目前认为,该系列化合物呈近晶相,且温区非常宽(清亮点超过分解温度),但其具体性质尚待进一步研究,见表9。

表9 23-全氟烷基甾醇2,3-二氟-4-烷氧基苯甲酸酯(H)的相变性质Tab 9 Phase transition properties of 23-perfluoroalkyl sterol 2,3-difluoro-4-alkoxy benzoate
对比化合物H与G的相变性质,可以看出当侧链带有全氟烷基时,3β-酰氧基中引入烷基链有利于形成近晶相。这可能由于2端的烷基链和氟碳链使分子具有较强的双亲性,有利于形成层状排列。
2.3.3 侧链全氟烷基化直链烷酸酯
与化合物G和H相比,直链烷酸酯系列J

因分子中刚性核较短,液晶相的热稳定性大为降低。见表10。

表10 23-全氟烷基甾醇直链烷酸酯(J)的相变性质Tab 10 Phase transition properties of 23-perfluoroalkyl sterol straight-chain alkyl ester
与胆甾烯基直链烷酸酯相似,化合物J也呈胆甾相和近晶相,但清亮点较高,液晶性更强。此外,J系列化合物更易形成近晶相,当烷基链较短时,化合物呈胆甾相,而长碳链的化合物则胆甾相消失,呈互变近晶A相,表明全氟烷基的引入明显影响了化合物的相变性质。
2.3.4 侧链全氟烷基化甾醇
值得一提的是,侧链全氟烷基化的甾醇(化合物K)
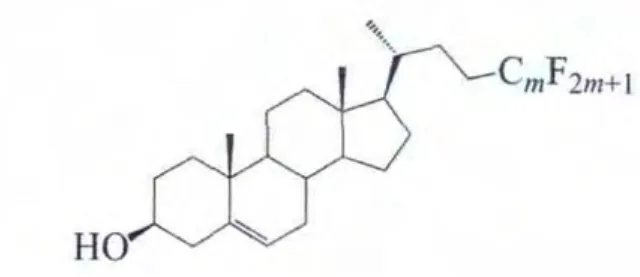
本身也可能具有液晶性(表11)。

表11 23-全氟烷基甾醇(K)的相变性质Tab 11 Phase transition properties of 23-perfluoroalkyl sterol
氟碳链较长的化合物K6呈单变手性向列相相,表明全氟烷基的引入能促使分子形成更加有序的排列。
2.3.5 侧链烃基化甾醇取代苯甲酸酯(化合物L)
侧链烃基化甾醇取代苯甲酸酯系列化合物L1
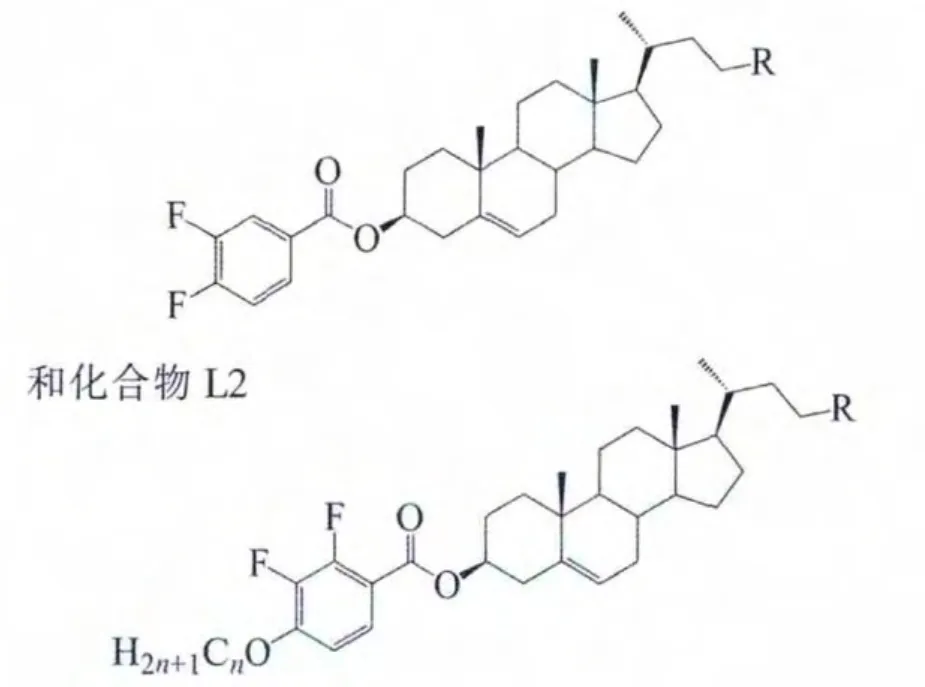
系列均呈互变手性向列相,见表12。

表12 侧链烃基化取代苯甲酸酯(L)的相变性质Tab 12 Phase transition propertiesofbenzoatewith alkyl replaced in side-chain
其中,侧链直链烷基化的化合物(L1-1、L1-2、L2-1)与胆甾烯基类似物相比,熔点和清亮点降低,而液晶相温区则变宽。另一方面,与前述侧链全氟烷基化的化合物相比,侧链直链烷基化的化合物的熔点和清亮点均较低,且不易形成近晶相,显示了氟碳链和碳氢链对相变性质的不同影响。
L系列中,侧链上带有苯基的化合物(L1-3、L2-2)与胆甾烯基类似物比较,熔点上升、清亮点下降、胆甾相温区变窄,表明侧链上的苯基对化合物的液晶性不利。原因可能是侧链的碳碳键自由旋转时,碳链末端的苯环需要比烷基更大的空间,使分子间不易形成有序排列,导致液晶性下降。
2.3.6 胆酸侧链直链烷基酯
与其甲基酯类似物A4-34对比,胆酸侧链直链烷基酯(化合物M)

的液晶性减弱,见表13。

表13 3-3,4-二氟苯甲酰氧基-5-胆烯酸直链烷基酯(M)的相变性质Tab 13 Phase transition properties of 3-3,4-difluoro benzoxy-5-cholic acid straight-chain alkyl ester
但碳氢链长度的增加对清亮点和熔点有不同的影响,清亮点逐渐下降,无明显的奇偶效应,而熔点则先下降,而后上升,显示化合物的晶体结构可能有改变。与侧链为直链烷基的化合物L1-1和L1-2相比,本系列中的侧链酯基明显削弱了化合物的液晶性。
3 典型中间体和目标化合物的合成
3.1 3,4-二氟苯甲酸
在一干燥100 mL三颈瓶上装置恒压滴液漏斗,氮气保护下加入镁屑385 mg(16.0 mmol)、无水THF15mL和1粒碘,滴液漏斗中加入3,4-二氟溴苯3.00 g(1.76 mL,15.5 mmol)和无水THF 15 mL。搅拌下将大约1/3的3,4-二氟溴苯溶液加入瓶中,待反应引发后,于20min内滴入剩余溶液。室温搅拌2 h,镁屑消失,生成浅棕黄色格氏试剂溶液。将所得溶液以冰盐浴冷却至约-15℃,通入经浓硫酸干燥的二氧化碳气体,控制气体流量使反应液温度低于0℃。30 min后,加入稀盐酸,乙酸乙酯萃取,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得到白色晶体5.935 g,产率85%。
1H NMR(CDCl3,TMS)δ:11.86(s,1H),7.89(m,2H),7.24(m,1H);19F NMR(CDCl3,TFA)δ:52.0(m,1F),59.6(m,1F)。
3.2 4-全氟己基苯甲酸甲酯
对-碘苯甲酸甲酯1.00 g(3.82 mmol)溶于10.0 mL无水DMF中,氮气保护下加入活性铜粉0.97 g(15.3 mmol)和全氟碘己烷0.87 mL(1.79 g,4.02 mmol),加热至125℃反应10 h。反应液冷却后过滤,滤液加入乙酸乙酯,以水洗涤2次,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体1.59 g,产率92%。
3.3 4-全氟己基苯甲酸
对-全氟己基苯甲酸甲酯1.43 g(3.15 mmol)、氢氧化钾0.70 g(12.5mmol)、甲醇20mL和THF 10 mL混合,室温搅拌1 d后倾入稀盐酸中,乙酸乙酯提取3次,有机层合并,以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂得淡黄色固体。乙醇重结晶得白色片状晶体1.02 g,产率74%。
MS(m/z):440(M+)。
3.4 胆甾烯基4-全氟己基苯甲酸酯
胆甾醇70 mg(0.181mmol)、对-全氟己基苯甲酸78 mg(0.177 mmol)、DCC 50 mg(0.242 mmol)和二甲基氨基吡啶2mg共溶于4.0mL邻氯三氟甲基苯中,加热至120~130℃搅拌2 d。反应液加入乙酸乙酯,过滤,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体84mg,产率59%。
1H NMR(CDCl3,TMS)δ:8.19(d,2H,J=8.1 Hz),7.68(d,2H,J=8.1 Hz),5.55(d,1H,J=4.5 Hz),4.94(m,1H);19F NMR (CDCl3,TFA)δ:3.5(m,3F),34.0(m,2F),44.5(m,4F),48.5(m,4F);C40H49F13O2元素分析(EA):计算值,C 59.40%,H 6.11%,F 30.54%;实际值,C 59.47%,H 6.21%,F 30.40%。
3.5 3β-羟基-5-胆烯酸
猪去氧胆酸甲酯35.0 g(85.7mmol)和对甲基苯甲酰氯(TsCl)75.0 g(396 mmol)溶于130 mL吡啶中,室温搅拌2 d。反应液倾入冰冷的稀盐酸中,搅拌3min后抽滤,冰水洗涤后干燥。所得浅棕色3α,6α-二对甲苯磺酰氧基猪去氧胆酸甲酯粗品和碳酸钾80 g与500 mL DMF-H2O(体积比10:1)混合,加热至110℃反应5 h。反应液冷却后倾入冰冷的水中,抽滤,冰水洗涤后干燥。所得白色3β-乙酰氧基-5-胆烯酸甲酯粗品与氢氧化钾20.0 g溶于300 mL甲醇中,室温搅拌1 d。反应液倾入冰冷的稀盐酸中,滤出固体,冰水洗涤后干燥。所得固体以乙酸乙酯重结晶2次得到淡黄色3β-羟基-5-胆烯酸纯品18.0 g。3步总产率56.1%。
MS(m/z):374(M+);IR(KBr)(σ/cm-1):3 352、2 938、1 697。
3.6 3β-乙酰氧基-5-胆烯酸
3 β-羟基-5-胆烯酸10.0 g(26.7 mmol)溶于15 mL吡啶中,加入乙酸酐15mL,室温搅拌1 d。反应液倾入冰冷的稀盐酸中,抽滤,冰水洗涤后干燥得淡黄色固体10.9 g,产率98.0%。
3.7 24-降-5,22-胆二烯-3β-醇乙酸酯
在500mL三颈瓶上接蒸馏装置,瓶中加入3β-乙酰氧基-5-胆烯酸9.96 g(23.9 mmol)、二水合乙酸铜(II)1.2 g(6.0 mmol)、吡啶25 mL和苯400 mL,加热蒸出部分溶剂至馏出液澄清。稍冷后将蒸馏装置改为回流冷凝管,氮气保护下加热回流,分2次加入四乙酸铅22.0 g(49.7 mmol),之间间隔12 h,反应24 h后中止。反应液稍冷,以一粗短硅胶柱过滤,乙酸乙酯洗涤。滤液以稀盐酸和饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得产物5.70 g,回收原料2.87 g,转化率71.2%,产率90.4%。
IR(KBr)(σ/cm-1):1 733;1H NMR(CDCl3,TMS)δ:5.67(m,1H),5.37(d,1H,J=4.94 Hz),4.86(m,2H),4.60(m,1H);C25H38O2EA:计算值,C 81.03%,H 1 0.34%;实际值,C 80.96%,H 10.62%;旋光度[α:-69.0(ρ=1.025 g/mL,CHCl3)。
3.8 24-降-5,22-胆二烯-3β-醇
24-降-5,22-胆二烯-3β-醇乙酸酯5.70 g(15.4 mmol)溶于150mL甲醇中,加入氢氧化钾3.50 g(62.5 mmol),室温搅拌1 d后倾入水和乙酸乙酯中。有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得24-降-5,22-胆二烯-3β-醇4.94 g,产率98%。乙醇重结晶得到鳞片状白色晶体。
1H NMR(CDCl3,TMS)δ:5.67(octa,1H,J1=17.01 Hz,J2=10.00 Hz,J3=8.29 Hz),5.35 (d,1H,J=5.29 Hz),4.87(m,2H),3.53(m,1H)。
3.9 17β-(1-甲基-2-碘-3-全氟己基)丙基-5-雄甾烯-3β-醇
24-降-5,22-胆二烯-3β-醇1.046 g(3.18mmol)溶于10mL氯仿中,加入水50mL,氮气保护下加热至40℃。取质量分数88%的连二硫酸钠5.20 g(26.3 mmol)和碳酸氢钠2.60 g(30.9 mmol)混合均匀,与0.75 mL全氟碘己烷(1.547 g,3.35 mmol)一起分3次加入,之间间隔8 h,共反应24 h。冷却,补加氯仿和水,分出有机层,以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体1.242 g,产率50.4%。
MS(m/z):774(M+);19F NMR(CDCl3,TFA)δ:3.8(m,3F),36.2(m,2F),44.9(s,2F),45.9(m,2F),46.6(m,2F),49.3(m,2F)。
3.10 17β-(1-甲基-3-全氟己基)丙基-5-雄甾烯-3β-醇
17β-(1-甲基-2-碘-3-全氟己基)丙基-5-雄甾烯-3β-醇1.242 g(1.60mmol)溶于20mL无水THF中,常温下滴入氢化锂铝200 mg(5.27 mmol)与10 mL无水TH的混合物中,反应5 h后缓慢加入稀盐酸中止反应。乙酸乙酯提取2次,有机层合并,以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体0.963 g,产率93%。
MS(m/z):649(M++1);IR(KBr)(σ/cm-1):3 378,2 940,1 467,1 237,1 193;1H NMR(CDCl3,TMS)(δ/ ppm):5.35(d,1H,J=4.55 Hz),3.73(m,1H),3.54(m,1H);19F NMR(CDCl3,TFA)δ:3.86(m,3F),37.64(m,2F),45.08(s,2F),46.02(s,2F),46.51(m,2F),49.29(m,2F)。
3.11 3β-(2-四氢吡喃氧基)-5-胆烯-24-醇
3 β-羟基-5-胆烯酸7.00 g(18.7 mmol)溶于50 mL二氯甲烷中,冰浴冷却下加入DHP 5.5 mL和对甲基苯磺酸TsOH 200mg。反应结束后,反应液以质量分数5%的NaHCO3溶液和饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂。所得白色固体溶于80mL无水THF中,常温下滴入氢化锂铝2.00 g(52.7 mmol)与无水THF 60 mL的混合物中,反应5 h后缓慢加入饱和氯化铵溶液中止反应。乙酸乙酯提取2次,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体 7.73 g,2步产率92.0%。
MS(m/z):342,327,255,213,147,85;1HNMR(CDCl3,TMS)δ:5.46(d,1H,J=6.3 Hz),4.72(m,1H),4.04(t,2H,J=6.3 Hz),3.50(m,1H);IR(KBr)(σ/cm-1):3 397, 2 939,1 467。
3.12 3β-(2-四氢吡喃氧基)-5-胆烯-24-醇对甲苯磺酸酯
3 β-(2-四氢吡喃氧基)-5-胆烯-24-醇2.00 g(4.50mmol)溶于10mL二氯甲烷中,加入对甲基苯环酰氯TsCl 1.20 g(6.29mmol)和三乙胺1.00 mL(0.726 g,7.17mmol),室温搅拌1 d。反应液以水和饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体2.57 g,产率95%。
MS(m/z):496,481,374,255,213,145;IR(KBr)(σ/cm-1):2 941,1 598,1 467,1 361,1 177。
3.13 24-戊基-5-胆烯-3β-醇
正溴戊烷0.37mL(451mg,2.98mmol)溶于5.0 mL无水THF中,滴入镁屑80 mg(3.29 mmol)与无水THF 5.0mL的混合物中,室温反应2 h。所得格氏试剂溶液以冰盐浴冷至约-10℃,加入2.0mL的Li2CuCl4-THF溶液(0.1 mol/L),搅拌15 min后滴入3β-(2-四氢吡喃基)-5-胆烯-24-醇对甲苯磺酸酯300mg(0.501mmol)的无水THF溶液5.0mL。保温反应2 h,升至室温反应3 h。加入稀盐酸中止反应,乙酸乙酯萃取,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体163mg,产率79%。
MS(m/z):415(M++1);1H NMR(CDCl3,TMS)(δ/ ppm):5.36(d,1H,J=4.5 Hz),3.54(m,1H)。
3.14 3β-羟基-5-胆烯酸甲酯
3 β-羟基-5-胆烯酸2.254 g(6.02 mmol)与甲醇80mL和浓硫酸5.0mL混合,室温搅拌1 d。反应液倾入水中,乙酸乙酯提取2次,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得产物2.292 g,产率98%。
MS(m/z):388(M+);IR(KBr)(σ/cm-1):3 364.7,2 936.2,1 739.6。
3.15 3β-羟基-5-胆烯酸辛酯
3 β-羟基-5-胆烯酸400mg(1.07 mmol)溶于3.0mL的DMF中,加入正溴辛烷0.45mL(500 mg,2.59mmol)、碳酸钾400mg(2.89mmol)和18-冠醚-6 5mg,室温搅拌2 d。反应液倾入水中,乙酸乙酯提取,有机层以饱和食盐水洗涤,无水硫酸钠干燥后蒸除溶剂,柱层析得白色固体473mg,产率91%。MS(m/z):486(M+)。
4 结束语
本研究以易于到手的甾体——猪去氧胆酸为原料。研究的胆甾相与常见文献报道的胆甾相液晶不相同,人工合成的胆甾相液晶分子,手性碳原子是处在末端基短链上,液晶核中一般没有手性碳原子。而甾体的4个手性碳原子中有3个在甾体核上。甾体液晶的结构单元分为3部分,即3取代基,17末端侧链与刚性甾体核。
合成路线方面:
1)从猪去氧胆酸为原料转化为3β-羟基-5-胆烯酸,再脱羧后与碘代氟烃反应,生成甾醇的17-侧链氟烷基衍生物;
2)17-侧链烷基化甾醇的合成。
结构与液晶相的关系:
1)甾醇多氟苯甲酸酯(化合物A)B环饱和的化合物液晶性差,可能是因为分子间引力比较小,B为Δ5,7的化合物液晶性最好,但是对热不稳定。一般来说Δ5最好;
2)甾醇的氟代肉桂酸酯(化合物B)结构与液晶性的关系,与化合物A相同;
3)甾醇氟代4-烷氧基苯甲酸酯(C)中的C1-3、C1-4、C1-5、C1-8这4个化合物中,B环为Δ5液晶性最好,是负性液晶,B环饱和时,液晶性略差,但是由于2个氟取代的缘故,化学稳定;羧基的2位有氟取代基的化合物,不出现近晶相,但是在3位氟取代的场合不仅胆甾相不稳定,而且出现近晶相;2,3-二氟取代的化合物,是稳定的负性液晶,有应用价值;
4)化合物E与F苯甲酸的苯环上没有氟原子取代,非常容易出现近晶相。说明2位的氟原子取代基对抑制近晶相十分有效;
5)17-位的取代基异丁基比甲氧基羰基有利于产生稳定液晶相。
[1]Friedrich Reinitzer.Beiträge zur Kenntnis des Cholesterins [J].Monatschefte für Chemie,1888,9:421-441.
[2]Thies Thiemann,Volkmar Vill.Homologous series of liquid crystalline steroidal lipids[J].Journal of Physical and Chemical Reference Data,1997,26:291-333.
[3]D Pauluth,A E FWaechtler.Synthesis and applications of chiral liquid crystals[M].//A N Collins,G N Sheldrake,J Crosby.Chirality in Industry II:Developments in the Commercial Manufacture and Applications of Optically Active Compounds.New York:John Wiley&Sons,1997: 263-286.
[4]Channabasaveshwar V Yelamaggad,Govindaswamy Shanker, Uma S Hiremath,et al.Cholesterol-based nonsymmetric liquid crystal dimers:An overview[J].Journal of Materials Chemistry,2008,18:2927-2949.
[5]Yang D K,Chien LC,Doane JW.Cholesteric liquid crystal /polymer dispersion for base-free light shutters[J].Appl Phys Lett,1992,60:3102-3104.
[6]Wolfgang Elser,Juergen L W Pohlmann,Phillip R Boyd.17β-Alkyl substituted androst-5-en-3β-ols[J].Molecular Crystals and Liquid Crystals,1971,13:255-270.
[7]Yuehai Shen,Ximin Chen,Jianxun Wen.Liquid crystalline derivatives of 3β-hydroxy-5-cholenic acid[J].Molecular Crystals and Liquid Crystals,2011,537:76-84.
[8]Ximin Chen,Yuehai Shen,Jianxun Wen.Synthesis and mesomorphic properties of tolane-based fluorinated liquid crystals with an acrylate linkage[J].Molecular Crystals and Liquid Crystals,2010,528:138-146.
[9]Yuehai Shen,Jianxun Wen.A new route for synthesizing cholesterol analogs with fluorocarbon side chains and theirliquid-crystalline aliphatic esters[J].Journal of Fluorine Chemistry,2002,113:13-15.
[10]Kan Wang,Yuehai Shen,Yonggang Yang,et al.Synthesis and mesomorphic properties of steroidal liquid crystals containing perfluoroalkoxycarbonylphenyl units[J].Liquid Crystals,2001,28:1579-1580.
[11]Jianxun Wen,Hao Chen,Yuehai Shen.The first series of ferroelectric steroidal fluorinated liquid crystals[J].Liquid Crystals,1999,26:1833-1834.
[12]YuehaiShen,JianxunWen.Sterylpolyfluorobenzoate liquid crystals[J].Liquid Crystals,1999,26:1421-1422.
[13]王侃,沈悦海,韩腾,等.一类含不饱和端链的新型含氟甾类液晶的合成与相变研究[J].液晶与显示,2002,16(4): 279-286.
[14]刘克刚,李衡峰,沈悦海,等.新型含氟甾体类液晶的合成与相变研究[J].液晶与显示,2002,16(3):181-187.

