115例心率减速能力对急性心肌梗死患者短期预后的预测价值
王 凌,吴志忍,林 荣
(福建医科大学附属泉州市第一医院心内科,福建泉州362000)
急性心肌梗死(acute myocardial infarction,AMI)常伴随恶性心律失常、严重心力衰竭甚至心脏性猝死的发生,是冠心病患者死亡的重要原因,故早期对AMI 患者进行危险分层和采取相应的干预措施,对改善患者的预后具有重要的价值。相关研究表明,心肌梗死后迷走神经张力降低参与了心功能恶化、致命性室性心律失常、心脏性死亡和猝死的发生[1]。心率减速能力是评价迷走神经张力的一种无创心电技术,包括了心率减速力(deceleration capacity of heart rate,DC)[1]测定和近年来新出现的连续心率减速力(heart rate deceleration runs,DRs),他们通过Holter记录,从不同侧面反映心率减速能力[2]。本文通过研究AMI患者心率减速能力对预后的影响,旨在对AMI患者进行危险分层,并对高危患者的早期干预和治疗提供临床参考依据,减少主要不良心血管事件(major adverse cardiovascular events,MACE)发生,改善其预后。
1 资料与方法
1.1 一般资料 选择2012年8月至2013年1月本院心内科住院确诊为AMI且发病7 d以内的患者115例(AMI组),其中,男72例,女43例,年龄44~83岁,平均(62.4±10.6)岁。选择一般资料与AMI组相匹配且经冠状动脉造影已排除冠心病的来院健康体检者50例作为对照组,其中,男30例,女20例,年龄41~82岁,平均(60.8±12.5)岁。排除标准:(1)基础心率非窦性节律(如心房颤动、起搏器植入者等);(2)病态窦房结综合征或不同程度的房室传导阻滞者;(3)合并心源性休克;(4)合并其他影响自主神经功能的疾病,如甲状腺功能亢进症、严重贫血或严重肝肾功能损害等;(5)接受胆碱能受体阻滞剂治疗等。AMI组与对照组在年龄、男性比例、吸烟、高血压、糖尿病、血脂异常等一般资料方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 DC检测 所有患者均于发病7~14 d内完成24 h动态心电图检查,应用迪姆软件公司的DMS300-4A动态心电记录分析系统计算出DC值。DC分析标准[1]:确定心率段数值为20个周期,选择比前1个心动周期延长者的减速点作为中心点,进行不同心率段的有序排列,经过位相整序处理后,分别计算每一段对应周期的平均值代入公式DC=[X(0)+X(1)-X(-1)-X(-2)]×1/4。DC值大于或等于4.5 ms为低风险值;DC值2.6~4.5 ms为中风险值;DC值小于或等于2.5 ms为高风险值。
1.2.2 DRs检测 离线采用迪姆软件公司的DMS300-4A动态心电记录仪对24 h动态心电图记录进行回放。DRs分析标准[2]:(1)测量连续心搏的RR值:完成24 h动态心电图记录后,测量并标注连续心搏的RR间期值;(2)确定DC持续的周期值:分别以心动周期的前后序号及RR间期(ms)为横、纵坐标,制成不同DR周期值的顺序图,通过软件计算出持续周期不同的DRs的各自数值;(3)计算持续周期不同的DC的绝对值及相对值:先计算从DR1~DR10持续周期不同的DC各绝对值,再除以该时间段内窦性心律间期的总数值,则得到持续周期不同的DC的相对值。根据现有的检测标准,低风险组定义为DR2、DR4、DR8的相对值在边界值以上(正常);中度风险组定义为DR4正常,而DR2或DR8的相对值低于边界值;高风险组定义为DR4的相对值低于边界值。
1.2.3 AMI亚组分组 通过DC与DRs提示的风险分层将入选的患者归为3类,即低风险组、中风险组、高风险组,同患者的DC和DRs提示风险级别不同,则以较高风险定位该患者的风险级别(如患者DC提示为高风险,而DRs提示为中风险,则将该患者定位为高危患者)。低风险组提示患者迷走神经使心率减速的能力强,中风险组提示迷走神经调控心率减速的能力减弱,高风险组提示患者迷走神经对心率调节功能差。
1.2.4 冠状动脉造影(CAG) 采用Philips公司生产的Allra Xper FD数字减影心血管造影机,所有受试者住院期间行经桡动脉选择性CAG,多角度投照多体位(至少4个体位),冠状动脉狭窄大于或等于50%可诊断为冠状动脉粥样硬化性心脏病。
1.2.5 心脏彩超 采用荷兰Philips公司IE33心脏彩色组织多普勒超声诊断仪,配备M4S探头,探头频率2.5~3.5 MHz,仪器具备常规超声心动图及心肌组织多普勒显像功能。所有患者住院期间常规进行超声心动图检查,采用Simpson单平面法计算左室射血分数(left ventricular ejection fraction,LVEF)。
1.2.6 治疗方法 所有AMI组患者均接受规范的抗心肌缺血治疗及控制冠心病危险因素,所有患者住院期间及出院后根据病情需要给予经皮冠状动脉介入(PCI)、他汀类调脂药物、钙离子拮抗剂、β-受体阻滞剂、硝酸酯类、血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体拮抗剂(ACEI或ARB)等药物,控制高血压、糖尿病等危险因素,如合并心功能不全则加用利尿剂和醛固酮受体拮抗剂螺内酯。
1.2.7 随访及临床结果记录 所有患者出院后每2个月通过电话和门诊进行随访,共随访6~10个月,平均(8.9±1.8)个月,观察患者发生MACE事件的情况。一级终点:心源性或全因性死亡。二级终点:严重心力衰竭(NYHA心功能分级大于或等于Ⅲ级,LVEF≤35%)、恶性心律失常(室性心动过速、室颤)、复发严重心绞痛。
1.3 统计学处理 采用SPSS17.0统计软件进行分析,计量资料用±s表示,组间比较采用t检验,计数资料应用χ2检验。回归分析采用非参数检验的Logistic回归分析,以有无发生MACE为因变量,以年龄、性别、有无吸烟史,有无合并高血压、糖尿病、血脂异常,有无应用β-受体阻滞剂、ACEI/ARB、钙离子拮抗剂、他汀类药物,有无PCI以及不同风险的心率减速能力作为协变量,筛选哪些危险因素能预测MACE发生。以P<0.05为差异有统计学意义。
2 结 果
2.1 AMI组与对照组心率减速能力风险比较 AMI组心率减速能力中风险和高风险的患者明显多于对照组(P<0.05),说明AMI组迷走神经的功能存在不同程度减弱。见表1。
2.2 AMI组发生MACE的危险因素分析 随访期间17例发生MACE,其中心脏性死亡3例,恶性心律失常2例,严重心力衰竭6例,复发严重心绞痛6例。以有无发生MACE为因变量,以年龄、性别、有无吸烟史,有无合并高血压、糖尿病、血脂异常,有无应用β-受体阻滞剂、ACEI/ARB、钙离子拮抗剂、他汀类药物、利尿剂、有无PCI以及不同风险级别的心率减速能力作为协变量,分别经单因素分析和多因素Logistic 回归分析提示LVEF、心率减速能力高风险、年龄和有无PCI 是AMI患者短期随访期发生MACE 的独立预测因子,相关系数(r)分别为0.33、0.30、0.23、0.18,优势比相对危险度(OR)分别为4.83、4.28、2.22、1.58,LVEF相关性最强(r=0.33),相对危险度最高(OR=4.83),而心率减速能力高风险略次之(r=0.30,OR=4.28),当LVEF和年龄进入回归方程,决定系数r2=0.528,当增加心率减速能力高风险进入回归方程后,决定系数显著增加至0.635,提示心率减速能力高风险能明显增加Logistic 回归的拟合效果。见表2、3。

表1 AMI组与对照组DC风险比较
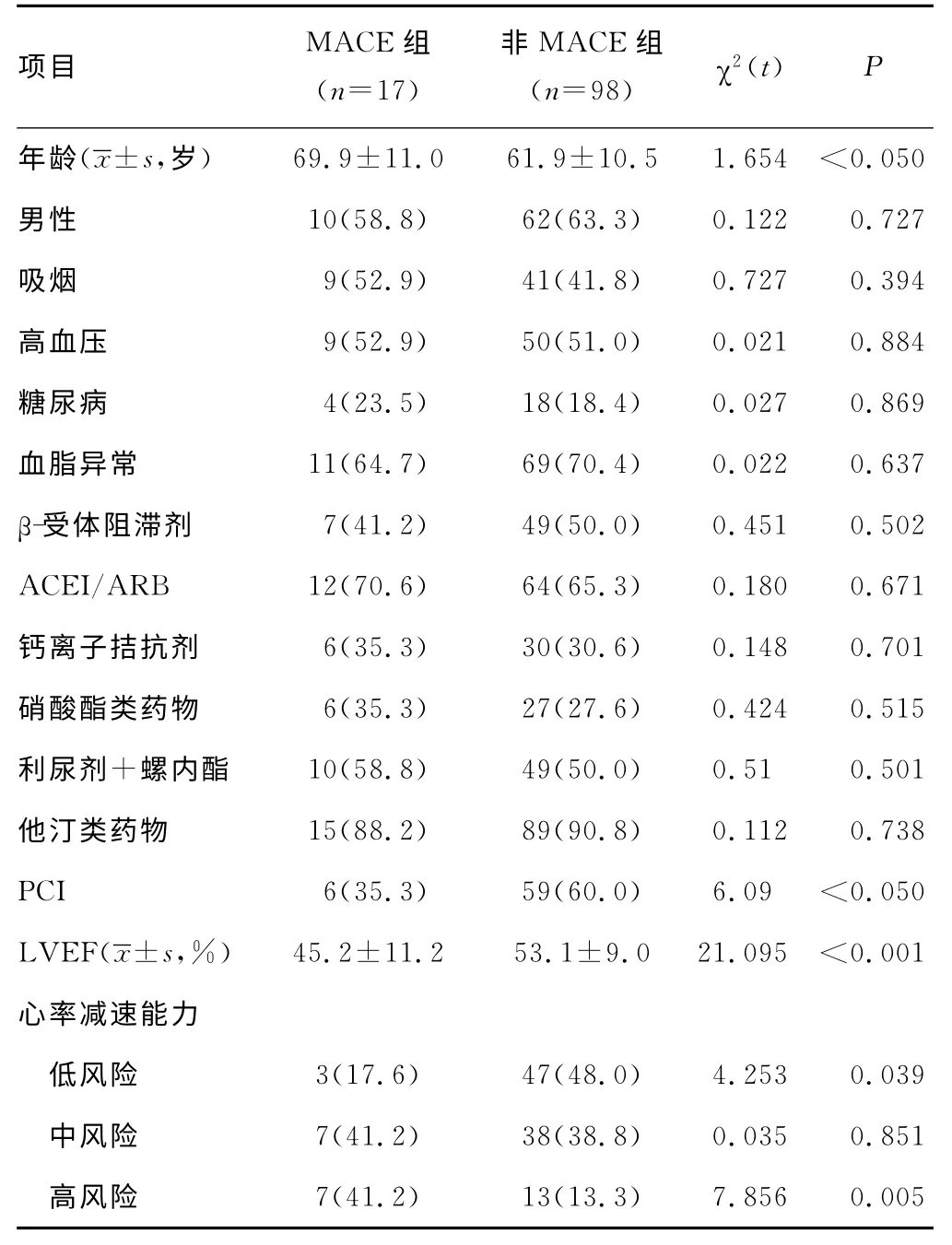
表2 AMI患者随访期间发生MACE的相关因素分析[n(%)]
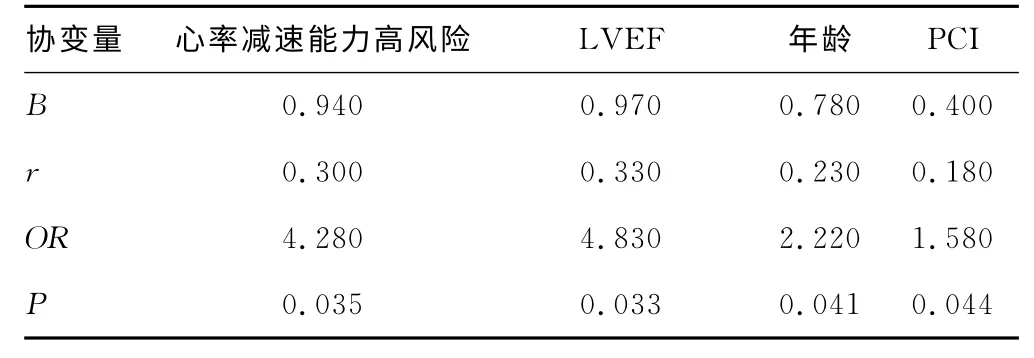
表3 Logistic 回归分析
3 讨 论
人体窦性心律快慢调节的最后公路是心脏自主神经,其又分为交感神经和迷走神经。迷走神经对心脏具有负性频率、负性传导的调节作用。当迷走神经兴奋性显著降低,可导致心率加快,出现各种快速型心律失常、心肌缺血加重甚至心脏性死亡及猝死[1]。过去认为致命性室性心律及心脏性猝死发生等MACE 发生与交感神经兴奋性增高相关,但其本质很大程度上是迷走神经对心脏保护作用下降的结果[3-4]。现有资料表明,在AMI 以及其继发心力衰竭患者出现恶性心律失常和猝死的危险明显增加,但同时发现该类患者心脏迷走神经活动进一步降低,两者之间有明确的关联性[4]。如何有效检测迷走神经功能来预测AMI 患者恶性心律失常等MACE一直是医学科研人员和电生理专家们研究的热点,国内外已有不少学者进行了大规模的临床试验及研究,并提出了利用心率变异分析(heart rate variability,HRV)、窦性心率震荡(heart rate turbulence,HRT)等自主神经功能检测对AMI 患者猝死的危险进行分层,但由于其对猝死的预测缺乏较高的稳定性、特异性,故临床参考价值较低[5]。2006年德国Schmidt 教授首次提出检测DC 方法,通过观察24h 心率整体变化趋势和规律定量评估迷走神经的张力大小,从而筛选预警猝死高危患者[1]。此后Lewek 等[6]通过对ST段抬高型心肌梗死患者的DC和HRV进行相关性分析,发现DC 更能体现自主神经对心率的调节作用。Bauer 等[7]则 证 实DC检测较LVEF及HRV更具 针 对性,其对心肌梗死后猝死具有强有力的预警作用,其评价效果优于LVEF 及HRV。国内同期相关临床研究都共同肯定了DC 对猝死的预警价值[8-9]。在对DC的应用及经验积累上,2012年DRs 应运而生,它通过动态心电图记录多个心动周期中RR间期逐跳延长(心率连续减速)的现象,是对DC的补充[2]。DC 和DRs 分别从不同侧面定量评价迷走神经张力,其特异性强,真阴性率高,假阳性率低[8]。同期的研究表明,AMI患者其病变心肌存在不同程度的缺血、坏死和纤维化,损害了广泛存在于心肌中的自主神经感受器,从而导致自主神经功能不同程度受损,使其对窦性心率的负性调节作用降低,故心率减速能力降低[6]。国内胡亚红等[10]和常超等[11]通过对AMI患者及非AMI 患者进行DC 检测,结果提示急性心梗患者DC显著低于对照组,证实AMI 后迷走神经减速能力不同程度减弱,本研究结果与其一致。
近年国外Guzik等[12]针对DC和DRs的大样本研究表明,AMI 后心率减速能力的降低都与不良的预后相关,可用于预测AMI 患者心脏性死亡、猝死的发生。研究将AMI 患者心率减速能力(DC 和DRs)按高、中、低风险分成3 个不同亚组,心率减速能力低风险的患者迷走神经功能正常,中风险提示迷走神经功能减弱,高风险则表明患者迷走神经功能显著减弱,随访结果发现各亚组真正的病死率与其风险分层十分吻合。本研究对入选的AMI 患者采取了类似的分组方式,观察影响该患者发生MACE 事件的相关因素,结果发现MACE组心率减速能力高风险率较非MACE组显著升高,而低风险率显著降低,表明MACE 组患者的迷走神经功能受损显著,迷走神经对心脏的保护作用削弱,交感过度激活,导致心梗患者发生心功能恶化、恶性心律失常及心脏性死亡等不良心血管事件风险增加。进一步通过Logistic 回归分析显示,LVEF值、心率减速能力高风险、年龄和是否接受PCI 治疗是本组AMI 患者发生MACE 事件的独立危险因素。尽管LVEF预测价值最大(r=0.33),相对危险度最高(OR=4.83),但心率减速能力高风险的相关性和相对危险度接近于LVEF(r=0.30,OR=4.28),而年龄(r=0.23,OR=2.22)和是否接受PCI 治疗(r=0.20,OR=1.58)预测价值远不足前两者;此外,LVEF、心率减速能力高风险、年龄和是否接受PCI 治疗这4个指标各自与MACE 发生的相关性均较低,分别为0.33、0.30、0.23、0.20,这几个指标对于AMI 患者短期随访出现MACE事件的预测价值相对较低,当LVEF 和年龄进入回归方程,决定系数r2=0.528,当增加心率减速能力高风险进入回归方程后,决定系数r2显著增加至0.635,提示这几个指标的联合应用能提高AMI 患者短期随访中发生MACE事件的预测价值。
现有的研究表明,AMI 患者存在不同程度的心肌细胞缺血与坏死,一方面导致心功能损害,另一方面引起心肌电活动异常与自主神经失衡,迷走神经张力减低,交感过度激活,而严重的心力衰竭则进一步增加恶性心律失常的风险,两者互相影响。此外,高龄和早期的血运重建是影响冠心病患者预后的重要因素[13],故联合应用心率减速能力检测及LVEF,结合患者年龄以及是否接受PCI 治疗重建血运,可提高AMI 高危患者的筛查,有利于对高危患者进行早期干预和治疗,对减少患者MACE 的发生具有重要意义。
[1] 郭继鸿.心率减速力检测[J].临床心电学杂志,2009,18(1):59-68.
[2] 郭继鸿.猝死预警新技术:连续心率减速力测定[J].临床心电学杂志,2012,21(3):227-233.
[3] 钟杭美.动态心电图新进展[J].江苏实用心电学杂志,2012,21(5):321-327.
[4] 李枫.自主神经与冠心病心室颤动的相关性[J].实用心电学杂志,2010,19(11):64-98.
[5] Cygankiewicz I.Heart rate turbulence[J].Progress in Cardiovascular Diseases,2013,56(2):160-171.
[6] Lewek J,Wranicz JK,Guzik P,et al.Clinical and electro-cardiographic covariates of deceleration capacity in patients with ST-segment elevation myocardial infarction[J].Cardiol J,2009,16(6):528-534.
[7] Bauer A,Kantelhardt JW,Barthel P,et al.Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction:cohort study[J].Lancet,2006,367(9523):1674-1681.
[8] 黄佐贵,杜国伟,殷波.心率减速力对急性心肌梗死的预警研究[J].中华实用诊断与治疗杂志,2011,25(1):40-42.
[9] 刘志红,张红宇,王红宇.室性心动过速患者心率减速力与心率变异性的分析[J].中国医药科学,2012,2(7):22-23.
[10] 胡亚红,李学斌,刘肆仁,等.急性心梗患者心率减速力与心率变异性[J].临床心电学杂志,2011,20(1):30-32.
[11] 常超,刘桂芝.不稳定型心绞痛患者连续心率减速力与心率减速力的关系分析[J].中国全科医学,2013,16(32):3121-3123.
[12] Guzik P,Piskorski J,Bartthel P,et al.Heart rate deceleration runs for postinfarction risk prediction[J].J Electrocardiol,2012,45(1):70-76.
[13] 罗太阳,刘小慧,康俊萍,等.老年冠心病患者血运重建后影响预后的因素[J].中国介入心脏病学杂志,2010,18(2):80-83.

