醋酸棉酚对地塞米松作用后SD大鼠股骨头组织形态学与基因表达的影响*
林 颢,刘 军,魏 波,曾 荣,王培永,向 昊,郭伟雄,祝兆波
(广东医学院附属医院骨科,广东湛江524001)
股骨头缺血性坏死是糖皮质激素应用过程中潜在的常见的严重并发症之一[1-2]。文献及临床经验证实糖皮质激素引起的骨坏死是在病理上表现为骨小梁结构变细,软骨下骨微骨折,同时伴有骨髓腔内脂肪细胞分布增多,脂肪变大,脂质沉积等情况[3-4]。
11β-羟基类 固 醇 脱 氢 酶1((11β-hydroxysteroid dehydrogenase 1,11β-HSD1)是骨组织中介导糖皮质激素(GC)活性的关键酶,在成骨细胞与破骨细胞均有表达[5],其氧化与还原效应在骨组织中扮演着GC受体前调节机制的重要角色,是组织对GC应用的反应的关键环节[6]。糖皮质激素所引起的骨代谢异常与体内尤其是骨组织内11β-HSD1的活动紧密相关。成骨细胞不同的分化阶段,细胞数量及功能状态与骨稳态相关,受到局部糖皮质激素的调控。目前11β-HSD1与骨代谢异常之间关系机制尚待深入研究。
醋酸棉酚(gossypol acetate,GAA)是一种多元酚类化合物,文献证实其可以通过糖基化其活性基团从而抑制11β-HSD1的功能[3]。本实验采用GAA作用后观察不同实验组股骨头形态学改变、骨组织中11β-HSD1、过氧化物酶体增殖物激活受体γ(PPARγ)/Run相关转录因子2(Runx2)、CCAAT区/增强子结合蛋白α(C/EBPα)表达特点,初步探讨11β-HSD1抑制剂对激素应用所致的骨质异常的作用。
1 材料与方法
1.1 实验材料 11β-HSD1抗体、PPARγ抗体、Runx2抗体、C/EBPα抗体(北京博奥森生物技术有限公司),SP试剂盒(北京中杉生物有限公司),RNA检测试剂(大连宝生物公司),引物11β-HSD1、PPARγ、Runx2、C/EBPα的序列(上海生工生物有限公司),GAA(北京中棉有限公司)。
1.2 方法
1.2.1 模型制作及实验分组 SD大鼠50只(约200 g,健康2月龄,雌雄不限),分为对照组,地塞米松(Dex)12周组,Dex+GAA 12周组,Dex 20周组,Dex+GAA 20周组,每组10只。对照组腹腔注射生理盐水2 mL;其他组腹腔内注射Dex 10 mg/kg,每周2次,共注射12周或20周;Dex+GAA 12周组,Dex+GAA 20周组,同时予GAA 5 mg·kg-1·d-1灌胃;所有大鼠肌注青霉素,20万U/只,每周1次,预防感染。
1.2.2 标本处理 药物处理完成,取各组大鼠双侧股骨头,一侧置-80℃冰箱中冻存作实时定量RT-PCR检测,另一侧多聚甲醛中固定后,10%乙二胺四乙酸(EDTA)溶液中脱钙3周,梯度乙醇脱水,石蜡包埋,作4μm厚连续切片,苏木素-伊红(HE)染色,光学显微镜下观察评估。
1.2.3 骨组织切片免疫组织化学法(SP法) 切片脱蜡、水化后,室温下3%H2O2阻断内源性过氧化物酶;高压下煮沸抗原修 复,加BSA封 闭 液;滴 加11β-HSD1、C/EBPα、Runx2、PPARγ一抗孵育4℃过夜;加生物素化山羊抗小鼠Ig G,DAB显色,苏木素复染,梯度乙醇脱水,透明,中性树胶封片。
所有切片均采用双盲法作镜下评估。HE染色按每个标本随机选取4张切片,由3名医师双盲下进行评定。4×10倍镜下观察计算股骨头内孔隙数目,骨小梁轮廓与分布。每张切片随机选取5个100倍视野,用Imageplus6.0软件分析计算100倍镜下骨小梁面积比值与骨髓腔内脂肪细胞面积比值。免疫组织化学切片先选取染色阳性细胞(成骨细胞或脂肪细胞),阳性细胞染色为细胞质内出现棕黄色颗粒样染色。每张切片随机选取5个200倍视野,计算阳性细胞所占其总观测细胞的百分率,得到面积比取平均值。
1.2.4 q RT-PCR法检测股骨头组织的11β-HSD1、PPARγ、Runx2、C/EBPα的表达
1.2.4.1 股骨头组织RNA的抽提 冻存股骨头组织,去除软骨组织,置入研钵中加入液氮冷冻后,迅速研磨至呈粉末状。加入RNAiso Plus 1 mL裂解作用5 min后4℃离心。加0.2 mL氯仿,充分摇匀后室温下静置5 min,4℃下12 000 r/min离心15 min,取上清液加入等量异丙醇后室温下静置10 min,4℃下12 000 r/min离心10 min析出沉淀,向沉淀中加入1 mL 75%乙醇清洗沉淀,4℃下12 000 r/min离心5 min,弃上清液保留沉淀,室温下干燥10 min,溶解于20μL DEPC水中,取2μL稀释成100μL后于紫外分光光度计下测定mRNA的含量与光密度值(OD)的比值。其余RNA存入-80℃拟行逆转录处理。
1.2.4.2 RNA逆转录,q RT-PCR方法检测基因表达 取每组细胞RNA样本,根据上述mRNA的含量计算1μg mRNA所需的适量RNA体积,加入:5×g DNA Eraser Buffer 2μL,g DNA Eraser 1μL,适量DEPC水构成10μL体系,室温下放置5 min,将上述反应液10μL加入:5×Pri me Script Buffer 4 μL,Pri me Script®Enzy me 1μL,RT Pri mer Mix 1μL,DEPC水4μL直至20μL,反应条件为:37℃15 min,85℃5 s,4℃下保存。取各组逆转录产物2μL,加入SYBR®Premix Ex Taq 10μL,上游引物(10μM)1μL,下游引物(10μM)1μL,双蒸水8μL形成20μL反应体系,置于PCR平板中,分置2个复孔行相关反应。反应条件按试剂盒说明操作,置于Light Cycler®480荧光定量PCR系统中测定。
1.3 统计学处理 采用SPSS11.0软件进行统计学分析,实验数据用±s表示,组间比较采用单因素方差分析或Dunnet分析,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 应用Dex后股骨头形态学改变分析 应用Dex后股骨头松质骨小梁显著减少,骨髓腔隙增加,改变随应用时间延长加重;应用GAA后骨小梁面积所占比值减少明显(图1 A),组间比较差异有统计学意义(P<0.01),至20周面积比值减少更加明显(P<0.01);骨髓腔隙内脂肪细胞占面积比值则随Dex应用增加,较对照组均存在显著性改变,应用GAA后面积比例进一步增加(P<0.01),见表1。
表1 各组形态学改变分析(±s)
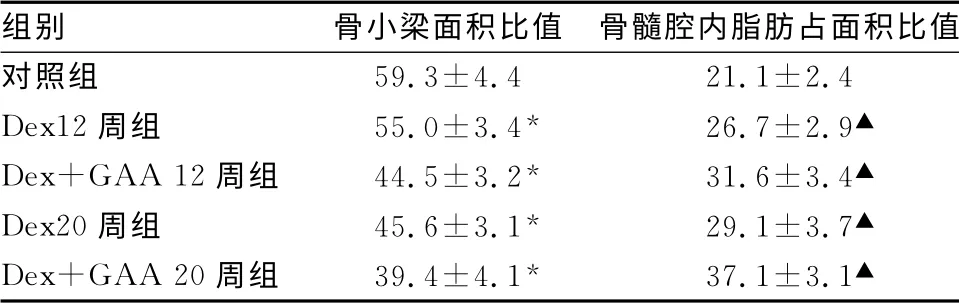
表1 各组形态学改变分析(±s)
*:P<0.01,▲:P<0.01,与对照组比较。
组别 骨小梁面积比值 骨髓腔内脂肪占面积比值对照组59.3±4.4 21.1±2.4 Dex12周组 55.0±3.4* 26.7±2.9▲Dex+GAA 12周组 44.5±3.2* 31.6±3.4▲Dex20周组 45.6±3.1* 29.1±3.7▲Dex+GAA 20周组 39.4±4.1* 37.1±3.1▲
2.2 免疫组织化学方法检测及半定量结果分析 11β-HSD1主要表达在成骨细胞与脂肪细胞的胞浆内(图1B)。脂肪细胞阳性染色细胞主要位于骨髓腔内,为中小型细胞型脂肪细胞;染色阳性成骨细胞主要位于骨小梁边缘,呈扁平或柱状。阳性成骨细胞及脂肪细胞数处理组较对照组随时间延长增多。使用GAA阳性细胞数量随时间上升(表2)。
C/EBPα阳性染色位于细胞质及细胞核内,成骨与脂肪细胞中均可见阳性表达且随时间延长增加,阳性细胞比例数升高(图1C)。PPARγ主要表达于骨髓脂肪细胞的细胞质及细胞核,以细胞质表达为主。随Dex作用时间延长,染色阳性脂肪细胞比例明显增加;GAA处理12、20周PPARγ表达增加,染色阳性细胞百分数升高,差异有统计学意义(P<0.05)。见图1D和表2。Runx2主要表达于成骨细胞核及胞浆中,以胞浆表达为主。小梁边缘染色阳性成骨细胞较对照组数量减少,GAA处理12、20周后Runx2表达阳性细胞明显下降,均P<0.05(图1E,图2、3)。

表2 各组基因表达分析(相对比较法)
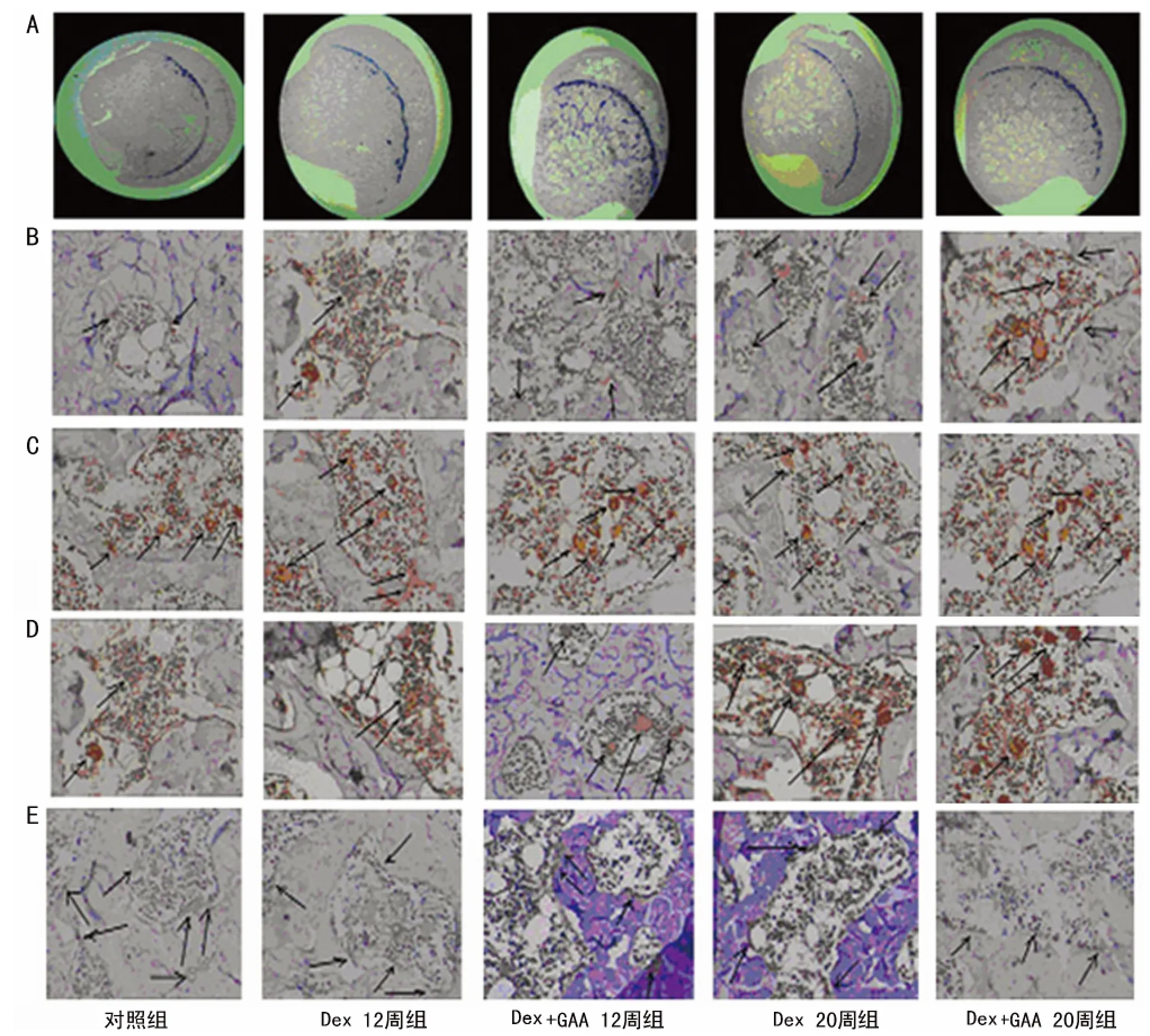
图1 各组大鼠股骨头切片HE、11β-HSD1、C/EBPα、PPARγ、Runx2免疫组织化学染色

图2 各组不同Dex作用时间Runx2表达阳性细胞比较

图3 各组不同Dex作用时间PPARγ染色阳性细胞比较
2.3 RT-PCR相对定量方法测定组织中11β-HSD1、PPARγ、Runx2、C/EBPαmRNA的表达 与对照组比较,其余各处理组对股骨头组织中11β-HSD1、C/EBPα、PPARγmRNA增加,Runx2减少(P<0.05)。GAA处理12、20周与相应Dex处理组比较,Runx2 mRNA表达明显降低,C/EBPα、PPARγmRNA则上升更明显(P<0.05)。
3 讨 论
糖皮质激素诱发股骨头坏死的机制目前尚未完全阐明,存在多种学说[7]。骨组织局部激素活性水平调节异常可能是引起病变的关键因素之一。11β-HSD1是内源性糖皮质激素的关键调节酶,可以催化有生物活性的皮质醇与无活性11-脱氢皮质酮(以下简称为皮质酮)的相互转化[8];外源性激素作用时,诱发局部11β-HSD1表达与活性改变,对股骨头形态学与基因表达变化有何影响,尚未明确[9]。本文研究结果表明较长时间应用Dex,SD大鼠股骨头骨髓腔内脂肪细胞所占面积比例增高,脂肪体积增大,骨小梁稀疏,小梁占面积比明显下降,提示长期应用糖皮质激素后该区骨与脂肪组织分布发生了改变,局部骨量下降。文献报道应用糖皮质激素后骨髓脂肪细胞体积增大,细胞外脂质积聚等表现,最终发展成为骨坏死改变[3,5,10]。目前缺乏充足的证据来阐明其中机制。
本文中局部11β-HSD1表达增加,提示基于11β-HSD1激素水平的调节存在。免疫组织化学染色表明中小型脂肪细胞、成骨细胞中11β-HSD1的表达增加,同时PPARγ、C/EBPα表达增加,Runx2减少。Runx2控制成骨细胞各类特异性基因的表达(如骨保护素、骨钙素等);PPARγ具有促脂肪分化的能力[11];C/EBPα主要分布在脂肪代谢旺盛的分化好的细胞中[8]。股骨头组织中11β-HSD1表达存在相对差异,提示其功能与激素诱发的病理学改变存在着一定的关联。Jorgensen等[12]发现11β-HSD1-/-小鼠有部分骨髓腔内脂肪组织的缺失,认为11β-HSD1对激素的增敏反应影响了骨髓脂肪细胞的形成。而To mlinson等发现11β-HSD1通过激活内源性皮质酮促进前脂肪细胞向脂肪细胞的分化。Sano等[13]也证实了对小鼠使用11β-HSD1抑制剂后,可以减少局部脂肪蓄积及脂肪细胞胰 岛 素 的 敏 感 性。本 研 究 也 证 实11β-HSD1、C/EBPα、PPARγ等主要表达于骨髓组织中等大小脂肪细胞,其中激素组骨髓腔脂肪细胞11β-HSD1阳性指数升高的同时可见C/EBPα、PPARγ等表达增高现象,表明Dex作用下,骨组织11β-HSD1的表达改变可能通过影响C/EBPα、PPARγ表达而影响了骨髓组织中中小型脂肪细胞的分化过程,而在激素诱发的骨组织病理变化中起到重要的影响作用。
对于成骨细胞而言,11β-HSD1对其的作用与其不同的分化阶段有关。在成骨细胞分化早期,由于需要糖皮质激素的量开始明显增多,这时内源性糖皮质激素的作用是有益于成骨的;至分化晚期后,内源性糖皮质激素则是有害于成骨细胞,使其功能下降[14]。本实验观察到用超生理剂量的Dex干预后,成骨细胞11β-HSD1的表达缓慢上升,同时Runx2的表达量下降,C/EBPα表达量微增。在长期的Dex作用下,Dex与GR结合后,可以与增加的C/EBPα协同调控,共同促进成骨细胞11β-HSD1表达[15],增加了激素的激活,使局部活性糖皮质激素水平增加,形成正反馈作用,加重了成骨代谢紊乱。
GAA对11β-HSD1的活性基团进行糖基化后起到抑制其活性的作用[3]。本实验发现,随11β-HSD1活性的抑制,股骨头组织成骨功能受到抑制,成脂性基因表达明显增强,表现为免疫组织化学分析中Runx2阳性指数进一步下降,PPARγ、C/EBPα阳性指数则进一步上升。此基因表达的改变在骨髓脂肪组织中尤为显著。这从另一个方面说明前述观察到的脂肪成分所占面积增加的病理改变一致。提示在一定程度上骨质减少与成分比例的变化与激素作用后诱导的基因表达改变相关。然而,应用GAA后,骨质局部脂肪组织占优势的病理改变理论上应该得到抑制,但本文却没有观察到这一结果,可能存在以下原因,人工合成的激素Dex不经过11β-HSD1脱氢激活,但诱导其在组织内的表达,也有可能是Dex直接与细胞内受体结合起作用,而不经过11β-HSD1调节这一环节;再者,受到药理学剂量Dex作用后而引起的脂肪组织的积聚或分化增强,还存在其他调节通路,单纯骨组织局部的调节激活不能完全阻断局部脂肪组织增殖性改变。由于体内影响因素众多,相关机制研究有待于进一步展开,以阐明主导该病理改变的主要机制。
[1]Huscher D,Thiele K,Gromnica-Ihle E,et al.Dose-relatedpatterns of glucocorticoid-induced side effects[J].Ann Rheum Dis,2009,68(7):1119-1124.
[2]Buttgereit F,Burmester GR,Lipworth BJ.Inflammation,glucocorti coids and risk of cardiovascular disease[J].NatClin Pract Rheumatol,2009,5(1):18-19.
[3]Kerachian MA,Harvey EJ,Cournoyer D,et al.A rat model of early stage osteonecrosis induced by glucocorticoids[J].J Orthop Surg Res,2011,21(12):60-62.
[4]Shi B,Li G,Wang P.Effect of antler extract on cortico-steroid-induced avascular necrosis of the femoral head inrats[J].J Ethnopharmacol,2010,127(1):124-129.
[5]Cooper MS,Walker EA,Bland R,et al.Expression andfunctional consequences of 11beta-hydroxysteroid dehydrogenase activity in human bone[J].Bone,2000,27(3):375-381.
[6]Cooper MS,Rabbitt EH,Goddard PE,et al.Osteoblastic11beta-hydroxysteroid dehydrogenase type 1 activity in-creases with age and glucocorticoid exposure[J].J BoneMiner Res,2002,17(6):979-986.
[7]焦庆丰,尚希福.激素性股骨头坏死发病机制的研究进展[J].临床骨科杂志,2010,13(3):329-331.
[8]Nicole D,Paul MS.11β-Hydroxysteroid dehydrogenaseand the pre-receptor regulaion of corticosteroid hormoneaction[J].J Endocrinol,2005,186(2):251-271.
[9]Dun H,Hai XC,Ge RS,et al.The biological roles of extracellular and intracytoplasmic glucocorticoids in skeletalcells[J].J Stero Biochem,2008,11(6):164-170.
[10]吴洪娟,郭文君,王亦进,等.激素诱发兔股骨头坏死的组织学及超微结构观察[J].解剖科学进展,2003,9(1):23-24.
[11]吴亮,吴晓烨,王环,等.2型糖尿病大鼠脑内11β-HSD1和GR的表达与认知功能的关系及棉酚的干预作用[J].中国病理生理杂志,2009,25(7):1336-1341.
[12]Jorgensen NR,Henriksen Z,Sorensen OH,et al.Dexam-ethasone,bmp-2,and 1,25-dihydroxyvitamin D enhance amore differentiated osteoblast phenotype:validation of anin vitro model for human bone marrow-derived primaryosteoblasts[J].Steroids,2004,69(4):219-226.
[13]Sano S,Nakagawa Y,Yamaguchi R.Carbenoxolone altersthe morphology of adipose tissues and downregulatesgenes involved in adipogenesis,glucose transport and lipidmetabolism in high-fatdiet-fed mice[J].Horm MetabRes,2012,44(1):15-20.
[14]Eijken M,Koedam M,van Driel M,et al.The essential role ofglucocorticoids for proper human osteoblast differentia-tion and matrix mineralization[J].Mol Cell Endocrinol,2006,248(1/2):87-93.
[15]Wyrwoll CS,Holmes MC,Seckl JR.11β-hydroxysteroiddehydrogenases and the brain:from zero to hero,a decadeof progress[J].Front Neuroendocrinol,2011,32(3):265-286.

