坎地沙坦抑制内毒素诱导的VSMCs炎症因子释放的作用研究
于新辉,闫 超,孟 哲
(1.苏州大学医学院附属太仓人民医院胸外科,江苏太仓215400;2.郑州大学第一附属医院心内科,郑州450003)
低度的持续性炎性反应对动脉粥样硬化的发展具有显著的促进作用[1-2]。病理状态下,血管平滑肌细胞(VSMCs)通过过度增殖及释放包括白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)在内的多种细胞因子、趋化因子、黏附分子,促进动脉粥样斑块的形成和发展,诱发斑块失稳[3]。Toll 受体4 是最早发现的Toll 样受体家族(TLRs)成员,它广泛分布于包括巨噬细胞、内皮细胞及VSMCs 在内的多种具有心血管活性的细胞表面[4-5]。TLR4 在与其特异性配体LPS结合后,通过上调NF-κB(p65)等转录因子的表达,显著增加IL-1β、TNF-α、单核细胞趋化因子-1(MCP-1)等多种炎性因子的释放,从而诱发炎症级联反应[6-7]。已有研究表明:在动脉粥样硬化、原发性高血压和2 型糖尿病等慢性炎性反应相关性疾病的靶器官(主要为心脏、血管、肾脏)内,TLR4 m RNA和蛋白的表达均有明显升高[8]。坎地沙坦属于血管紧张素Ⅱ1 型受体(AT1 受体)拮抗剂类药物,被广泛应用于原发性高血压[9]、糖尿病肾病[10]和慢性心力衰竭的临床治疗[11]。坎地沙坦已被证明能够有效地抑制LPS 诱发的脑部及脾脏炎性反应[12-13],逆转高脂饮食诱导的动脉粥样硬化病变[14]。本研究着眼于坎地沙坦对LPS 诱导VSMCs 炎症因子释放的影响及这种作用与TLR 4 介导的信号通路间的关系,以寻求坎地沙坦改善动脉粥样斑块病变的分子机制,为其用于冠心病的治疗提供一定的依据。

表1 实时定量PCR引物序列
1 材料与方法
1.1 实验动物 雄性SD大鼠,体质量150~180 g,购于西安交通大学医学院实验动物中心。
1.2 药品及试剂 坎地沙坦(Wako 公司,日本),DMEM高糖培养液(Gibco 公司,美国),胎牛血清及实时定量PCR试剂盒(TransGen 公司,北京),四甲基偶氮唑蓝(MTT)、DPI、PDTC和LPS(Sigma公 司,美 国),TNF-α 和IL-1βELISA试 剂 盒(BioSource International公 司,美 国),兔 抗 大 鼠 TLR4、Myd88、NF-κB(p65)、TLR4抗 体 和β-actin(Santa Cruz 公 司,美国),DCFH-DA活性氧测定试剂(碧云天生物,北京)。
1.3 方法
1.3.1 VSMCs 原代培养30%水合氯醛腹腔麻醉大鼠,快速分离胸主动脉,仔细剥离血管内膜及外膜,剪碎至1~2 mm3大小组织块,使用贴壁法培养。将细胞置于含200 m L/L胎牛血清的高糖DMEM培养基中,其中含有100U/m L的青霉素和100μg/m L 的链霉素,然后放入37℃、50mL/L CO2 细胞培养箱中。使用相差显微镜和α-actin 对VSMCs 进行形态学和免疫组织化学鉴定。取第3~6 代细胞,用于后续实验。
1.3.2 实验分组 将VSMCs 分为5 组:A组(对照组)、B组(LPS 干预组)、C组(LPS+10-7mo l/L坎地 沙坦)、D组(LPS+10-6mol/L坎 地 沙 坦)和E组(LPS+10-5mo l/L坎 地 沙坦)。以上B~E 组中LPS 的浓度均为500 ng/m L。
1.3.3 MTT比色法测定不同浓度坎地沙坦对VSMCs 活性的影响 将5 ×104个/孔VSMCs 接种于96 孔板,按照上述细胞培养条件培养24 h,改用20 mL/L低血清培养基培养12 h后,给予坎地沙坦10-8、10-7、10-6、10-5和10-4mol/L孵 育24 h。吸去培养液,每孔加入MTT(5 g/L)20μL,37 ℃孵育4 h,弃去上清液,每孔加入二甲基亚砜100μL,微微振荡数次后,在全自动酶标仪上于570 nm处测定各组吸光度值。
1.3.4 实 时 定 量PCR检 测 各 组VSMCs TLR4和Myd88 mRNA的表达以5 ×105个/孔的密度将细胞接种于6 孔板中,坎地沙坦(10-7、10-6、10-5mol/L)预处理1 h 后,加入LPS(500 ng/m L)孵育6 h,按照说明书使用Trizol 提取各组细胞总RNA。10 g/L 的琼脂糖凝胶电泳鉴定RNA完整性,分光光度计在260 nm处检测RNA的纯度。按照逆转录试剂盒(TransGen 公司,北京)操作步骤,将各组m RNA反转录为cDNA。使用Primer7.0 软件设计荧光定量PCR引物,由南京金丝瑞公司合成,序列如表1 所示。PCR扩增条件:95 ℃预变性5 min,95 ℃15 s,55℃退火15 s,72℃延伸30 s,共计40 个循环。使用Bio-Rad IQ5 荧光PCR仪自带分析软件对实时定量PCR结果进行分析。
1.3.5 DCFH-DA氧化法测定细胞内ROS 生成 取生长状态良好的VSMCs,以2 ×104个/孔的密度种植于96 孔板中,生长24 h 后,给予坎地沙坦(10-7、10-6、10-5mol/L)预处理1 h。弃去细胞上清液,加入25μmol/L的DCFH-DA溶液,37℃孵育1 h。仔细漂洗干净后,再给予含有500 ng/mL LPS 高糖DMEM培养基刺激2 h。酶标仪在485 nm激发波长和528 nm发射波长条件下,测定各组吸光度值。
1.3.6 Western blot 检测各组VSMCs TLR4、Myd88 和NFκB(p65)蛋白的表达 以5 ×105个/孔的密度将细胞接种于6孔板中,10-7、10-6、10-5mol/L坎 地 沙 坦 孵 育1h后,加 入LPS(500 ng/mL)刺激9 h。每孔使用150μL RIPA裂解液提取蛋白。核蛋白使用核蛋白提取试剂盒(Pierce NE-PER kit)进行提取。BCA蛋白定量试剂盒测定各组样品蛋白浓度。加入蛋白上样缓冲液并煮沸后,制作10%SDS-PAGE凝胶进行电泳,半干转膜仪转膜。一抗浓度为:TLR4(1∶200)、Myd88(1∶500)、NF-κB(p65)(1∶200)和β-actin(1∶2000)。以βactin 作为内参照。化学发光法检测,采集图像,利用Quantity one 软件进行图像分析。
1.3.7 ELISA测定上清液中IL-1β和TNF-α的表达 将各组VSMCs 以5 ×104个/孔的密度接种于96 孔板中,不同浓度坎地沙坦预处理1 h,再给予500 ng/m L 的LPS 刺激24 h。使用TLR4 抗体(5μg/m L)、DPI(20μmol/L)、PDTC(80μmol/L)或联合坎地沙坦(10-5mol/L)预处理细胞1 h,再给予500 ng/mL 的LPS 刺激24 h。收集各孔内细胞上清液,依据操作说明,使用ELISA试剂盒测定IL-1β和TNF-α的分泌。使用自动酶联免疫吸附仪在450 nm处读取数值,绘制IL-1β和TNF-α的标准曲线,并据此计算各实验组结果。
1.4 统计学处理 使用SPSS17.0 软件进行统计学分析,计量资料用±s表示,组间比较使用单因素方差分析,多重均数比较使用SNK检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 不同浓度坎地沙坦对VSMCs 活性的影响 为了明确不同浓度坎地沙坦有无细胞毒性作用,使用MTT对不同浓度坎地沙坦干预的VSMCs 活性进行测定。结果显示:在10-8~10-4mol/L 范围内,坎地沙坦对细胞活性均无明显影响。因此,以下实验选用10-7~10-5mol/L 这一中间浓度进行干预。
2.2 不同浓度坎地沙坦对VSMCs IL-1β和TNF-αmRNA和蛋白表达的影响 见图1,如图1A、1B所示,500 ng/m L LPS刺激24 h 后,LPS 组细胞上清液中IL-1β和TNF-α分泌明显增多,分别为675.15、401.26 pg/mL(P<0.01)。给予不同浓度坎地沙坦(10-7、10-6、10-5mol/L)预 处 理1 h后,IL-1β和TNF-α分泌显著下降,并呈现剂量依赖性(P<0.05)。在m RNA水平,坎地沙坦也可以有效抑制LPS诱导的IL-1β 和TNF-αmRNA表达升高(P<0.05),见图1C、1D。
2.3 不同浓度坎地沙坦对TLR4、Myd88 mRNA和蛋白表达的影响500 ng/m L LPS 刺激4h 后,TLR4 和Myd88 蛋白表达明显增加(P<0.01)。使用10-7、10-6、10-5mol/L坎地沙坦预处理1 h 后,再给予相同浓度LPS 刺激24h,与LPS 组比较,TLR4 和Myd88 蛋白表达显著减少,并呈现剂量依赖性(P<0.05),见图2A、2B。坎地沙坦也能够显著抑制LPS 诱导的TLR4 和Myd88 mRNA表达的升高,并具有浓度依赖性(P<0.05),见图2C、2D。
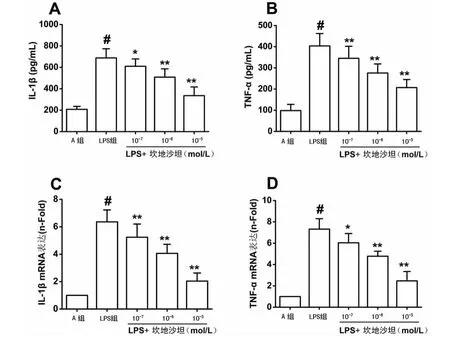
图1 不同浓度坎地沙坦对LPS 诱导的VSMCs IL-1β和TNF-αm RNA和蛋白表达的影响
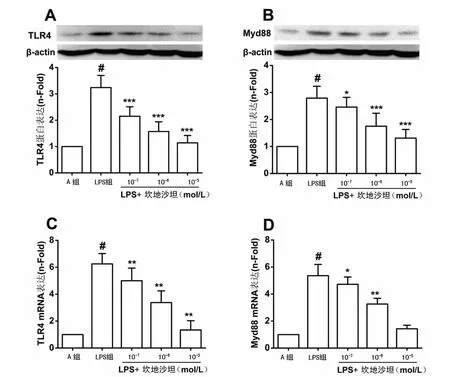
图2 不同浓度坎地沙坦对VSMCs TLR4、Myd88 mRNA和蛋白表达的影响
2.4 不同浓度坎地沙坦对iROS 生成的影响 如图3 所示,与对照组相比,LPS(500 ng/m L)显著增加iROS 的生成(P<0.01),使用10-7、10-6、10-5mol/L 坎地沙坦预处理1 h,能够有效抑制LPS 诱导的VSMCs 内iROS 的生成,并具有浓度依赖性(P<0.05)。提示坎地沙坦能够有效地抑制LPS 诱导的VSMCs iROS 生成。见图3。
2.5 不同浓度坎地沙坦对NF-κB(p65)核转位的影响NFκB 为核转录因子,细胞核内的NF-κB(p65)含量可以间接反映NF-κB 的活化。500ng/mL LPS 刺激24h 后,细胞核内NFκB(p65)的蛋白表达明显上升(P<0.01),而细胞质内NF-κB(p65)的含量则显著降低(P<0.01)。使用坎地沙坦(10-7、10-6、10-5mol/L)预处理1 h 后,再给予相同浓度LPS 刺激9 h,较LPS 组,NF-κB(p65)核转位水平明显下降,并呈现剂量依赖性(图4)。结果表明坎地沙坦能够有效抑制LPS诱导的VSMCs NF-κB 活 化。
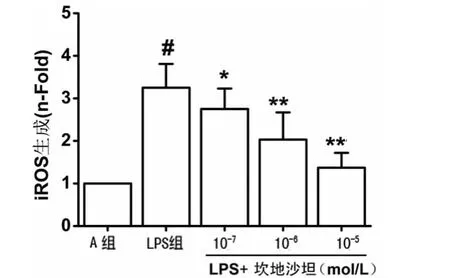
图3 不同浓度坎地沙坦对iROS 生成的影响

图4 不同浓度坎地沙坦对LPS-诱导的VSMCs NF-κB(p65)核转位的影响

图5 坎地沙坦通过TLR4/Myd88-iROS-NF-κB 信号通路抑制LPS 诱导的VSMCs IL-1β和TNF-α分泌
2.6 TLR4/Myd88-iROS-NF-κB信号通路在坎地沙坦抑制LPS 诱导的VSMCs IL-1β和TNF-α分泌中的作用 TLR4 抗体、NADPH氧化酶抑制剂DPI、NF-κB抑制剂PDTC均可以部分抑制LPS(500 ng/m L)诱导的VSMCs IL-1β和TNF-α蛋白表达(P<0.01),联用坎地沙坦(10-5mol/L)可以显著加强这种抑制作用(P<0.01),见图5。结果提示,坎地沙坦可能通过TLR4/Myd88-iROS-NF-κB信号通路起到对LPS诱导的VSMCs 炎性反应的抑制作用。
3 讨 论
低度的持续性炎性反应已被证实能够促进动脉粥样斑块发展和失稳[1-2]。TLR4 与LPS 等配体结合后,通过诱发相关炎症通路激活,上调多种炎症因子、趋化因子和黏附分子的表达,触发炎症级联反应[8]。此外,TLR4还具有显著的天然免疫和获得性免疫调节功能[5]。TLR4 能够通过Myd88 依赖性传导通路诱发NF-κB 核转位,增加IL-1β、IL-6 及TNF-α等炎症因子的分泌;也可通过非Myd88 依赖性传导通路诱发干扰素调节因子3(IRF3)核转位,继而增加干扰素的分泌。以上两种途径均能够显著促进斑块的形成和失稳[15]。在人类及动物模型的粥样斑块内,TLR4的表达均有明显升高[16]。同时给予TLR4 基因敲除和非敲除ApoE-/-小鼠12 周高脂饮食后发现,TLR4 基因敲除ApoE-/-小鼠动脉粥样斑块面积明显减小,同时稳定性增强[15]。据此可知,TLR4 及其下游通路的激活是动脉粥样硬化疾病进展的一个重要促进因素。此外,炎性反应常伴有iROS 生成增加,iROS 不仅造成细胞亚结构的损伤和信号通路的传导异常,同时也可以作为第二信使,参与信号传导。本实验发现:给予VSMCs LPS刺激后,TLR4及Myd88 mRNA和蛋白表达均明显增加;伴随i ROS合成增加和NF-κB(p65)核转位水平升高,下游IL-1β和TNF-α的分泌亦显著增加。使用TLR4 特异性抗体、NADPH氧化酶抑制剂DPI 和NF-κB抑制剂PDTC预 处理VSMCs,能够显著抑 制LPS 诱导的VSMCs IL-1β和TNF-α的分泌。上述结果提示:TLR4/Myd88-iROS-NF-κB 信号通路的激活参与了LPS 诱导的VSMCs 炎症因子分泌过程。
坎地沙坦是临床常用的ARB 类降血压药物。最近,坎地沙坦已被证实可通过下调氧化应激、改善内皮功能等机制,抑制高糖诱导的血管和肾小球细胞炎性反应[9,11]。此外,坎地沙坦亦可通过降低TLR4信号通路激活、下调天然免疫,减轻LPS 引起的小鼠脾脏和肾上腺炎性反应[13,17]。临床研究也表明,轻中度的慢性心功能不全和高血压患者服用坎地沙坦干预后,血浆中C反应蛋白、IL-6 及MCP-1 等炎症因子水平明显下降[18]。在本实验中,坎地沙坦可以剂量依赖性地降低VSMCs TLR4 m RNA和蛋白表达;抑制iROS 的生成和NFκB 激活;进而减少炎症因子的释放,起到有效的抗炎作用。此外,坎地沙坦和TLR4特异性抗体、NAPDH抑制剂DPI 和NF-κB 抑制剂PDTC联用,显示出更显著的炎症因子表达抑制作用。据此可知,坎地沙坦能够有效抑制LPS诱导的VSMCs IL-1β和TNF-α 分泌,这可能与坎地沙坦对TLR4/Myd88-iROS-NF-κB 信号通路的抑制作用有关。上述研究结果为坎地沙坦应用于动脉粥样硬化的治疗提供了一定的实验依据。
[1] Siegel D,Devaraj S,Mitra A,et al.Inflammation,atherosclerosis,and psoriasis[J].Clin Rev Allergy Immunol,2013,44(2):194-204.
[2] Manduteanu I,Simionescu M.Inflammation in atherosclerosis:a cause or a result of vascular disorders[J].J Cell Mol Med,2012,16(9):1978-1990.
[3] Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s[J].Nature,1993,11(2):801-809.
[4] Bruce A.TLRs and innate immunity[J].Blood,2009,113(7):1399-1407.
[5] Himanshu K,Taro K,Shizuo A.Toll-like receptors and innate immunity[J].BBRC,2009,338(4):621-625.
[6] Hang S,Maia V.Kokoeva,et al.TLR4 links innate immunity and fatty acid-induced insulin resistance[J].J Clin Invest,2006,116(11):3015-3025.
[7] Jeongmin S,Matthew J,Duncan,et al.A Novel TLR4-Mediated Signaling Pathway Leading to IL-6 Responses in Human Bladder Epithelial Cells[J].Plos One,2007,3(4):541-552.
[8] O′Neill LA.Therapeutic targeting of Toll-like receptors for inflammatory and infectious diseases[J].Curr Opin Pharmacol,2003,3(4):396-403.
[9] Heeneman S,Sluimer JC,Daemen MJ.Angiotensin converting enzyme and vascular remodeling[J].Circ Res,2007,101(3):441-454.
[10] Tsutamoto T,Wada A,Maeda K,et al.Angiotensin Ⅱtype 1 receptor antagonist decreases plasma levels of tumor necrosis factor alpha,interleukin-6 and soluble adhesion molecules in patients with chronic heart failure[J].J Am Coll Cardiol,2000,35(3):714-721.
[11] Donaire JA,Ruilope LM.Angiotensin receptor blockade in diabetic renal disease focus on candesartan[J].Diabetes Res Clin Pract,2007,76(1):22-30.
[12] Benicky J,Sanchez-Lemus E,Pavel J,et al.Anti-Inflammatory effects of angiotensin receptor blockers in the brain and the periphery[J].Cell Mol Neurobiol,2009,29(6/7):781-792.
[13] Sanchez-Lemus E,Murakami Y,Larrayoa-Roldan IM,et al.Angiotensin ⅡAT1 receptor blockade decreases lipopolysaccharide-induced inflammation in the rat adrenal gland[J].Endocrinology,2008,149(10):5177-5188.
[14] Johnstone MT,Perez AS,Nasser I,et al.Angiotensin receptor blockade with candesartan attenuates atherosclerosis,plaque disruption,and macrophage accumulation within the plaque in a rabbit model[J].Circulation,2004,110(14):2060-2065.
[15] Mullick AE,Tobias PS,Curtiss LK.Toll-like receptors and atherosclerosis:key contributors in disease and health[J].Immunol Res,2006,34(3):193-209.
[16] Li H,Sun B.Toll-like receptor 4 in atherosclerosis[J].J Cell Mol Med,2007,11(1):88-95.
[17] S ánchez-Lemus E,Benicky J,Pavel J,et al.AngiotensinⅡAT1 blockade reduces the lipopolysaccharide-induced innate immune response in rat spleen[J].Am J Physiol Regul Integr Comp Physiol,2009,296(5):1376-1384.
[18] Dohi Y,Ohashi M,Sugiyama M,et al.Candesartan reduces oxidative stress and inflammation in patients with essential hypertension[J].Hypertens Res,2003,26(9):691-697.

