HBx-d431突变体多肽抗体的制备及鉴定
祝玲玲朱平安★金娴钟小婷吴翔
·论著·
HBx-d431突变体多肽抗体的制备及鉴定
祝玲玲1朱平安1★金娴1钟小婷1吴翔2
目的利用人工合成多肽制备针对乙肝病毒X基因突变体HBx-d431的特异性多克隆抗体,为进一步研制HBx-d431免疫检测试剂盒打基础。方法采用生物信息学和多肽合成法制备HBx-d431特异性多肽(HBx-d431P)、高效液相色谱法(HPLC)和电喷雾离子化质谱(ESI-MS)鉴定合成多肽的纯度和分子量。用化学方法将多肽与匙孔血蓝蛋白(KLH)偶联成多肽抗原HBx-d431P-KLH,并经完全弗氏佐剂(CFA)和不完全弗氏佐剂(IFA)乳化,免疫新西兰雄性大白兔。用ELISA鉴定抗血清效价、亲和层析法纯化抗体、Dot blot评价抗体特异性。结果经HPLC和ESI-MS分析,合成的多肽满足HBx-d431特异性抗体制备的要求。ELISA和Dot blot试验结果显示,兔抗血清的效价达6.4×104,纯化后的HBx-d431抗体特异性高。结论本研究制备了抗HBx-d431特异性抗体,为进一步研制HBxd431免疫检测试剂盒奠定了基础。
乙肝病毒;HBx-d431突变体;多肽;抗体
原发性肝癌(hepatocellular carcinoma,HCC)是人类常见的恶性肿瘤之一,其死亡率占恶性肿瘤的第三位。由于肝癌早期无症状,一经发现多居中晚期,缺乏有效的治疗手段,使其平均生存仅半年左右。肝癌在早期诊断和治疗上仍有许多问题尚待解决[1]。目前研究表明,原发性肝癌与乙肝病毒及丙肝病毒感染密切相关,80%左右的肝细胞癌因持续的乙肝病毒感染所致[2,3],而乙肝病毒X基因(hepatitis B virus X gene,HBx)及其HBx蛋白在肝细胞癌发生中起重要的作用[4,5]。在前期研究中,我们发现了乙肝后肝癌组织中存在HBxd431突变体,该突变体能加速肝细胞恶性转化、促进肿瘤的形成[6]。为了提高肝癌治疗效果,早期发现、早期诊断、早期治疗因乙肝病毒感染所致肝癌,我们设计并合成了HBx-d431特异性多肽,进而免疫新西兰大白兔,制备了HBx-d431多克隆抗体,为后期研制HBx-d431免疫检测试剂盒奠定了基础。
1 材料与方法
1.1材料
免疫用新西兰大白兔[雄性健壮,月龄4.0~5个月,体重(2.5±0.3)kg],由中国科学院上海实验动物中心提供。完全弗氏佐剂(Complete Freund’s adjuvant,CFA)和不完全弗氏佐剂(Incomplete Freund’s adjuvant,IFA)购自Sigma公司。HRP-标记羊抗兔IgG抗体购自Santa Cruz公司。RT-6000酶标分析仪为深圳市雷杜生命科学股份有限公司产品。
1.2多肽的设计与合成
根据HBx-d431基因编码的氨基酸序列,使用由LynnonBiosoft公司开发的分子生物学应用软件(DNAMAN6.0.40),分析HBx-d431蛋白的二级结构、疏水性、亲水性、抗原性,选取亲水性与抗原性较好的部位,设计一段16个氨基酸的HBx-d431多肽(HBx-d431P),其氨基酸序列为MIFVLGGCRHKLVCIF。将设计好的多肽交由上海生工生物工程技术服务有限公司合成。合成的多肽经由美国Agilent公司出品(Agilent 1100 Series LC/MSD Trap)的高效液相色谱(HPLC)及电喷雾离子化质谱(ESI-MS)仪进行纯化与分子量鉴定。将纯化后的多肽分为二部分:一部分与KLH偶联制成免疫原,另一部分保持裸肽状态,用于抗体特异性测定。合成肽经冻干后,分装保存。
1.3多肽的偶联
采用化学方法制备免疫原。称取HBx-d431P 500 μg,溶解于0.1 mol/L,pH 7.4的PBS缓冲液中,再加入已溶解的KLH蛋白,在混匀器上充分混合,然后慢慢滴加0.3%戊二醛,室温(25℃)下反应2 h,最后加入1 mol/L,pH 7.0的甘氨酸溶液,在室温下进行终止反应,经纯化后获得纯品多肽抗原即HBx-d431-KLH,并将此样品分装保存于_80℃中,直至应用。
1.4抗体的制备
方法参照文献[7]进行。免疫动物之前,预采取10只新西兰大白兔的血清,以预取血清为一抗,HBx-d431P为抗原,采用Dot blot法检测兔血清中是否有HBx-d431P交叉抗体,以结果完全阴性的兔子作为免疫用兔。将上述纯化的多肽抗原液HBx-d431P-KLH 200 μl(约200 μg)与等体积CFA混合,待充分乳化后,采用背部多点注射法免疫新西兰大白兔。两周后取多肽抗原液加等体积IFA,采用上述方法进行加强免疫,免疫抗原量约150 μg,以后每两周免疫一次,每次免疫抗原量约100 μg,全程共免疫5次,在末次免疫5~7天后,通过兔耳缘静脉取血进行效价检测,待效价达理想值后,采用颈动脉放血,收集兔血清。
1.5抗体效价的鉴定
方法按下列步骤进行:(1)包被:将人工合成裸肽HBx-d431P稀释成2 μg/ml,包被96孔聚丙乙烯反应板,包被量为100 μl/孔,4℃过夜。(2)封闭:每孔加200 μl 2%BSA的PBS缓冲液,37℃封闭2 h。(3)加抗血清:在上样孔中加入稀释的抗血清,37℃水浴1 h。采用含2%BSA PBS缓冲液稀释抗血清,稀释比分别为1∶1 000、1∶4 000、1∶16 000、1∶64 000,以1∶200稀释的正常兔血清作为阴性对照。(4)加二抗:每孔加入工作浓度为1∶10 000的HRP-标记羊抗兔二抗100 μl,37℃孵育1h。以上每步结束后都用PBS缓冲洗涤液洗板5次并扣干。最终采用TMB显色系统进行显色,酶标仪读取450 nm波长处的OD值,当效价大于1∶4 000后,采兔血清,并纯化抗血清获得多克隆抗体。
1.6抗体的纯化
方法参照文献[7]进行。首先将HBx-d431多肽与Sepharose 4B偶联,制备多肽偶联的Sepharose 4B。然后将20 ml兔抗血清与1.6 ml多肽偶联的Sepharose 4B共同加入50 ml离心管,4℃旋转混合6 h。将凝胶加入层析柱,弃去流出液,用15 ml PBS冲洗凝胶。每次加0.8 ml 0.1 mol/L甘氨酸缓冲液(pH2.9)洗脱,共13次,洗脱液分别接入13支预先加入80 μl 2 mol/L Tris-HCl缓冲液(pH 7.5)的小管内。20 ml PBS洗凝胶。上述操作过程在4℃下完成。每管取洗脱液2 μl,稀释50倍后测OD280值,计算蛋白质含量并绘制洗脱曲线。收集洗脱峰,冻干备用。
1.7Dot blot鉴定抗体的特异性
将0.01 mol/L,PH7.4 PBS稀释的抗原液2 μl(100 ng)点于硝酸纤维素膜上,置37℃温箱中干燥30 min,滴加封闭液37℃温盒中封闭10 min,用洗涤液洗1~2次,滤纸吸干。同时以多肽CVGDGGLFEKKL为阴性对照。加用稀释液稀释的抗体,置37℃湿盒中30 min,用洗涤液震洗3次,每次3 min、吸干。水洗终止反应,观察结果。出现明显综色斑点者为阳性。
2 结果
2.1多肽的合成、纯化及鉴定
HPLC试验共发现5个成分峰,其保留时间与其对应的浓度见图1、表1,其中主要成分峰的含量为85.37%,远高于其它4个成分峰的总浓度(14.63%)。主要成分峰经ESI-MS分析,合成肽的质荷比(m/z)[M+3H]3+、[M+2H]2+离子峰所得到的分子量与理论分子量1836.36相吻合,结果见图2。合成的多肽达到了抗体制备试验的要求,可以用作目的免疫原。
2.2抗血清的制备和亲和层析纯化
在所初筛的10只新西兰大白兔中,没有兔血清与HBxd-431P有交叉免疫反应。采用间接ELISA方法,对2只免疫兔抗血清进行检测,阳性判断的依据是抗血清OD450值/阴性OD450值>2.1。结果见表2,兔抗血清的效价达到6.4×104。免疫周期结束后,采用亲和层析法对兔血清进行纯化,洗脱速度为20~25秒/ml。根据回收流出液各管的280 nm测得的OD值绘出洗脱曲线,由图3可见,第3管为洗脱最高峰。收集洗脱峰,透析后冻干备用。
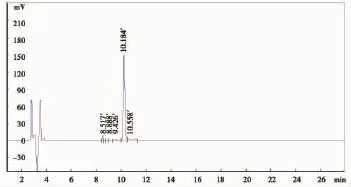
图1 合成多肽纯度HPLC检测结果Figure 1The HPLC result of the peptide
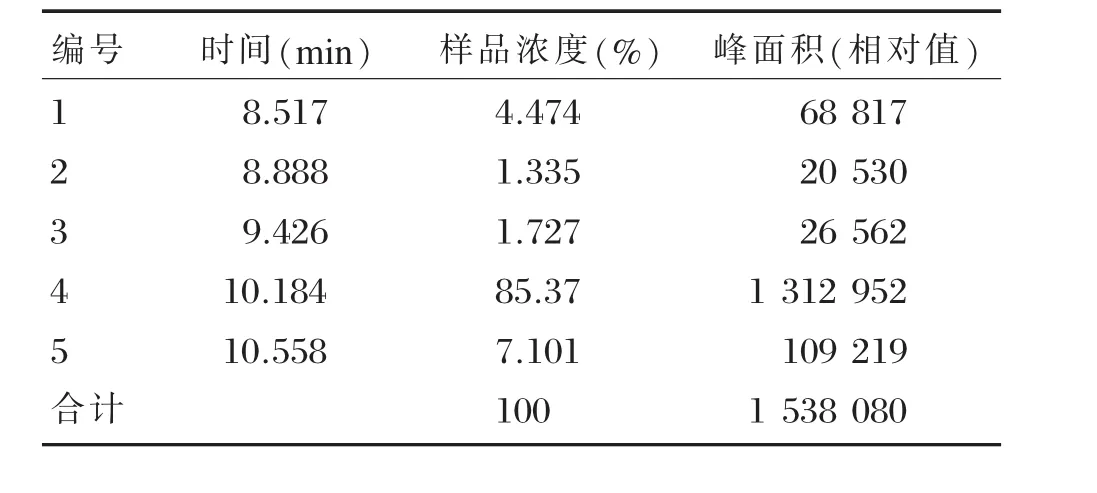
表1 高效液相色谱测定多肽的纯度Table 1Determination of peptide purity using HPLC
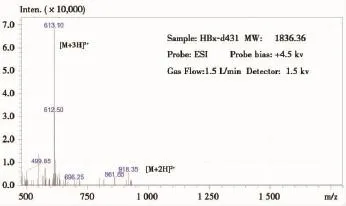
图2 合成多肽质谱检查结果Figure 2 The ESI-MS result of the peptide
2.5抗血清特异性的鉴定
采用Dot blot方法对兔抗血清特异性进行检测。图4所示,第1号位置为阴性对照,其多肽序列为CVGDGGLFEKKL;第2号至5号位置为HBx-d431特异性多肽。第1号、第2号位置使用的抗体滴度为1∶5 000,第3号至第5号抗体滴度分别为1∶10 000、1∶20 000、1∶40 000。结果发现,经亲和层析纯化后的抗体仅识别HBxd-431特异性多肽,而不识别阴性对照多肽。
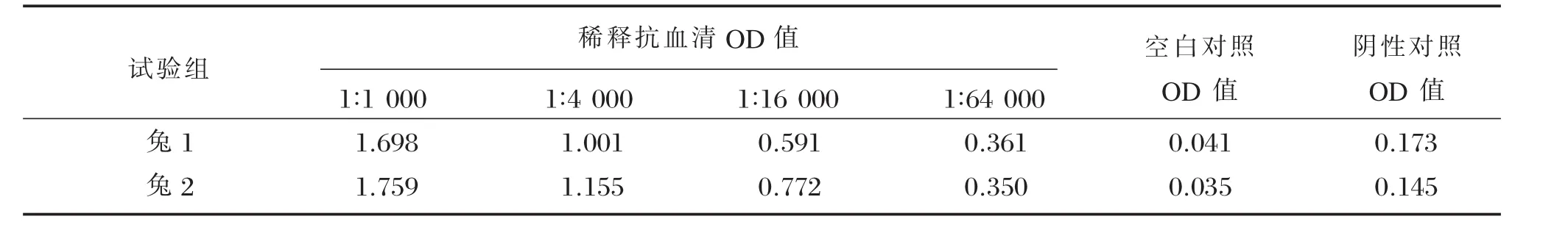
表2 ELISA测定多克隆抗体效价OD450值Table 2OD450values of immunized rabbit serum using ELISA
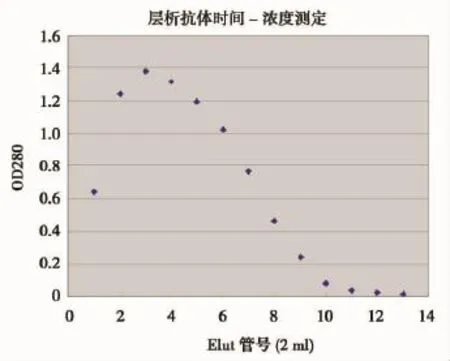
图3 抗HBx-d431多肽抗体的亲和层析纯化Figure 3The affinity purification of anti-HBx-d431 peptide antibody

图4 Dot blot检测纯化抗体Figure 4Dot blot analysis using the purified antibody
3 讨论
在全球范围内,肝癌发病率逐年上升,每年约新增加60余万病例,其中50%以上病例发生在中国。对于肝癌的病因,许多学者认为与肝炎病毒感染(包括乙肝病毒、丙肝病毒、丁肝病毒)、黄曲霉毒素、饮水污染、遗传等因素有关[1_3]。在我国肝癌患者中,90%以上有乙肝病毒感染背景,且肝细胞癌病人家庭内有乙肝病毒感染的聚集性倾向[8],慢性乙肝病毒感染是导致肝硬化与肝细胞癌的最主要原因[2_4]。HBV基因组包括C、S、P和X 4个重叠的开放读框,HBx基因及其编码的HBx蛋白参与HBV的复制以及宿主细胞的转录、增生、转化和凋亡,与肝细胞癌发生发展密切相关[4,9]。Hwang等[10]在肝细胞癌病人血和癌组织中分别检出了抗HBx蛋白,检出率为85%;肝细胞癌病人血清中抗HBx抗体检出率与肝癌组织中HBx蛋白检出率呈正相关。同时,在血清学模式为抗HBs(+)/抗HBc(+)肝细胞癌病人血清中也检出了抗HBx抗体,其检出率为17.1%(6/35)。Pál等[11]对急性乙型肝炎、慢性乙型肝炎和HBV无症状携带者血清中抗HBx抗体(IgG和IgM)与HBxAg水平进行检测与分析,结果显示具有转录功能的HBxAg C端能促进上述三组患者IgG产生,而作为负调节因子HBxAg N端,不能促进抗体的产生。同时,HBx蛋白N-端和C-末端具有不同的调节细胞生长的作用,前者是促进作用,后者抑制作用[12],而HBx基因C-末端缺失,能改变HBx蛋白的功能,影响它在控制细胞增殖、生长和转化方面的作用,与HCC的发生发展密切相关[5_6、13]。
我们在肝细胞癌组织中发现了HBx-d431突变体,该突变体C-末端缺失,能促进肝细胞恶性转化、肿瘤的形成[6]。为了进一步研究HBx突变体致HCC的分子机制,探讨HBx-d431突变体在肝癌早期诊断和预防中价值,我们合成了HBx-d431特异性多肽,并与大分子载体蛋白钥孔血蓝蛋白偶连,免疫新西兰大白兔,制备了HBx-d431多克隆抗体。表1、图1结果显示,HPLC分析发现了5个成分峰,主要成分峰的含量为85.37%,表明合成肽的纯度较高。合成肽经ESI-MS分析,质荷比(m/z)[M+3H]3+、[M+2H]2+离子峰所得到的分子量与理论分子量1836.36相吻合,从分子量角度证明了合成多肽序列的准确性,表明合成的多肽符合抗体制备的要求。Dot blot实验结果显示,亲和层析纯化的抗体仅识别HBxd-431特异性多肽,制备的多克隆抗体特异性高,且不会影响抗体的免疫功能。HBx-d431多克隆抗体的成功制备为进一步研究HBx-d431突变体、开发HBx-d431免疫诊断试剂盒奠定了重要基础。
[1]Malek N P,Schmidt S,Huber P,et al.The diagnosis and treatment of hepatocellular carcinoma[J].Dtsch Arztebl Int,2014,111(7):101_106.
[2]MoradpourD,BlumHE.Pathogenesisof hepatocellular carcinoma.Eur J Gastroenterol Hepatol, 2005,17(5):477_483.
[3]Chemin I,Zoulim F.Hepatitis B virus induced hepatocellular carcinoma[J].Cancer Lett,2009,286(1): 52_59.
[4]Kew M C.Hepatitis B virus x protein in pathogenesis of hepatitis B virus-induced hepatocellular carcinoma [J].J Gastroenterol Hepatol,2011,26(Suppl 1):144_ 152.
[5]Motavaf M,Safari S,Saffari Jourshari M,et al.Hepatitis B virus-induced hepatocellular carcinoma:the role of the virus x protein[J].Acta Virol,2013,57(4): 389_396.
[6]朱平安,谭德明,彭忠田,等.肝癌组织中HBx基因的多态性及突变体对QSG7701细胞生物学行为的影响[J].中华肝脏病杂志,2008,16(1):7_11.
[7]赵明辉,王彦,张春明,等.抗Resistin合成多肽抗体的制备及鉴定[J].生物医学工程与临床,2005,9(3):163_ 165.
[8]张建军,牟振云,刘勖,等.肝癌家庭成员乙型肝炎病毒、丙型肝炎病毒感染的调查分析[J].中华流行病学杂志,2002,23(1):70_71.
[9]Gong D Y,Chen E Q,Huang F J,et al.Role and functional domain of hepatitis B virus X protein in regulating HBV transcription and replication in vitro and in vivo[J].Viruses,2013,5(5):1261_1271.
[10]Hwang G Y,Lin C Y,Huang L M,et al.Detection of the hepatitis B virus X protein(HBx)antigen and anti-HBxantibodiesincasesofhumanhepatocellular carcinoma[J].J Clin Microbiol,2003,41(12):5598_ 5603.
[11]Pál J,Nyárády Z,Marczinovits I,et al.Comprehensive regression analysis of hepatitis B virus X antigen level and anti-HBx antibody titer in the sera of patients with HBV infection[J].Pathol Oncol Res,2006,12(1):34_40.
[12]Chau D K,Chen G G,Zhang H,et al.Differential functions of C-and N-terminal hepatitis B x protein in liver cells treated with doxorubicin in normoxic or hypoxic condition[J].PLoS One,2012,7(11):e50118.
[13]Ma N F,Lau S H,Hu L,et al.COOH-terminal truncated HBV X protein plays key role in hepatocarcinogenesis[J].Clin Cancer Res,2008,14(16):5061_5068.
Preparation and identification of polyclonal antibody with a peptide of HBx-d431 mutant
ZHU Lingling1,ZHU Pingan1★,JIN Xian1,ZHONG Xiaoting1,WU Xiang2
(1.The Seventh Hospital of Shenzhen,Guangdong Shenzhen 518081,China;2.Xiangya School of Medicine,Central South University,Hunan Changsha 410013,China)
ObjectiveTo prepare polyclonal antibody against HBV X gene mutant HBx-d431,and lay a foundation for development of HBx-d431 ELISA kit.MethodsSpecific polypeptide of HBxd431 mutant(HBx-d431P)was prepared by bioinformatics and polypeptide synthesis methods,and purity andmolecularweightofsyntheticpolypeptideweredeterminedbyusinghigh-performanceliquid chromatography(HPLC)and electrospray ionization mass spectrometry(ESI-MS).The polypeptide was coupled to keyhole limpet hemocyanin(KLH)to form a complex of HBx-d431P-KLH.The New Zealand male rabbits were immunized with HBx-d431P-KLH emulsified by complete Freund’s adjuvant(CFA)and incomplete Freund’s adjuvant(IFA),and rabbit antisera were purified by affinity chromatography.The titer of antisera and specificity of polyclonal antibody were determined by ELISA and Dot blot analysis respectively.ResultsThe results of HPLC and ESI-MS analysis showed that synthetic peptide could meet the requirement of HBx-d431 antibody preparation.The titer of rabbit antiserum was 6.4×104.Dot blot analysis showed that the purified antibody reacted with HBx-d431P only.ConclusionThe antibodies with high specificity against HBx-d431P are obtained in this study,which would promote the development of HBx-d431 mutant detecting kit.
Hepatitis B virus;HBx-d431 mutant;Polypeptide;Antibody
深圳市科技计划(201102184);深圳市盐田区科技计划(201210)
1.深圳市第七人民医院,广东,深圳518081 2.中南大学湘雅医学院,湖南,长沙410013
★通讯作者:朱平安,E-mail:pan_zhu@126.com

