使用Taqman技术监测慢性粒细胞白血病患者微小残留病灶
赵晶晶王颖张文伟余秀雪姜波梁辉李剑★
·论著·
使用Taqman技术监测慢性粒细胞白血病患者微小残留病灶
赵晶晶1王颖2张文伟3余秀雪4姜波4梁辉5李剑4★
目的动态的监测bcr-abl融合基因mRNA表达水平以及评估经格列卫治疗后的慢性粒细胞白血病(CML)患者微小残留病灶。方法荧光定量RT-PCR法(Q-RT-PCR)检测bcr-abl融合基因mRNA表达水平,收集来自广州金域的34例CML患者(包括经格列卫治疗后缓解病人17例,未经治疗病人17例)。CML患者的检测结果与其他良性血液病患者进行比较,并且结合临床表现,得到CML和其它非白血病病人中bcr-abl L表达信息,以及在慢性粒细胞白血病的治疗中微小残留病灶的重要意义。结果在CML病人中bcr-abl融合基因表达阳性率为88.3%(30/34),在其他的良性血液病中无表达。我们也能观察到经格列卫治疗的病人有一定的治疗效果,经格列卫治疗的病人bcr-abl融合基因的表达水平较未经治疗者明显降低(P<0.05)。结论Q-RT-PCR法是检测慢性粒细胞白血病微小残留病灶的重要方法,BCR-ABL融合基因可以做为CML的分子标志。
慢性粒细胞白血病;bcr-abl融合基因;微小残留病灶;荧光定量PCR
慢性粒细胞白血病(chronicmyelocyticleukemia,CML)是一种起源于造血干细胞的恶性增殖性疾病,占全部白血病的15%~20%,成人发病率1~2/10万,以9号和22号染色体易位t(9:22)(q34;q11)形成的费城染色体(Ph)为特征[1]。bcr-abl融合基因是CML特异性的肿瘤分子标志,90%以上的CML病人血细胞中可检测到Ph染色体t(9;22)(q34;q11),即9号染色体长臂上C2abl原癌基因易位至22号染色体长臂的断裂点集中区(bcr)形成bcr-abl融合基因。根据BCR基因断裂点的不同,主要有三种类型:m-型(minor)、e1a2、M-型(major):包括b2a2(e13a2)和b3a2(e14a2)及u型(e19a2),分别翻译成融合蛋白P190,P210和P230[2]。
残留白血病(MRD)是导致疾病复发的主要原因,常规的检测方法不能有效地进行监测。bcr-abl重排可能是其血液学和遗传学缓解时残留肿瘤的惟一证据。bcr-abl转录的动态变化可预测白血病复发,bcr-abl转录的定量监测是判断疾病预后的可靠指标。随着治疗手段和化疗药物的不断发展,大多数白血病患者可得到血液学和细胞遗传学缓解,血液学完全缓解(CHR)为外周血WBC<10× 109/L,PLT<300×109/L,WBC分类正常,无幼稚粒细胞,无髓外白血病浸润,维持4周,完全细胞遗传学缓解(CCyR)为骨髓中Ph阳性细胞为0,主要细胞遗传学缓解(MCyR)为骨髓中Ph阳性细胞≤35%,部分细胞遗传学缓解为骨髓中Ph阳性细胞>35%,但缓解后的复发成为影响患者远期预后的主要因素,是困扰白血病治疗的一个难点。CML病人复发率高达15%~60%[3]。治疗后体内残留的白血病细胞—微小残留病变(MRD)是导致疾病复发的主要原因。
本实验在逆转录酶作用下将RNA逆转录为cDNA,在引物的指导下,以四种脱氧核苷酸为底物,通过耐热DNA聚合酶的酶促作用,对cDNA进行体外扩增,利用Taqman®MGB探针技术,以ABL基因作为内参,对bcr-abl融合基因进行定量。
Taqman技术的特点在于其探针,探针的5″端与3″端分别带有一个荧光报告基团与荧光淬灭基团,当探针完整时,报告基团所发出的荧光被淬灭基团所吸收。在进行PCR扩增时,由于Taq酶的5′_3′外切酶活性,将与模板结合的特异性探针切断,探针上的报告基团与淬灭基团因而被分开,使荧光报告基团在激发光的激发下,产生特定的荧光,荧光量与扩增产物量成正比,并与样本中其原始模板数相关,通过测定荧光强度即可进行起始模板的定量分析。
1 材料与方法
1.1标本及分组
实验组:随机选取2010~2011年广州金域医学检验中心接收的白血病患者血液样本34例。男20例,女14例;年龄在20~65岁之间,平均年龄46岁。其中经格列卫治疗后缓解病人17例,未经治疗病人17例。对照组:随机选取18例良性血液病病人(地贫、PV等)作为对照,其中男11例,女7例,年龄在18~71岁之间,平均年龄48岁。
1.2实验方法
1.2.1RNA的提取
吸取200 μl全血到1.5 mL EP管中。加入200 μl裂解液,13 000 rpm涡旋15 s。使用Eppendorf(5424R)离心机,离心2 min。吸取上清液至1.5 ml EP管中,加入200 μl无水乙醇,反复颠倒混匀。溶液转入Spin Cartridge中,13 000 rpm离心30 s,去收集管中的液体。吸取700 μl洗液Ⅰ于洗脱柱中,13 000 rpm,离心30 s。吸取500 μl上清液至洗脱柱中,加洗液Ⅱ,13 000 rpm,离心30 s,去收集管中的液体。再吸取500 μl洗液Ⅱ到洗脱柱中,13 000 rpm,离心30 s,弃收集管,把洗脱柱转入新的EP管中。向洗脱柱的中央缓慢的加入60 μl去离子水,室温温育1 min,13 000 rpm离心2 min。取10 μl进行琼脂糖凝胶电泳;取5 μl DNA原液稀释10倍,采用BiomateⅢ核酸蛋白分析仪,分析纯度和浓度。
1.2.2RT-PCR
荧光定量PCR实验使用Molecular MD公司BCR-ABL试剂盒。按照试剂盒说明书进行操作,简单步骤包括:按实验模板所示向每个反应孔分装20 μl反应液(含0.5 μl SuperScriptⅢPlatinum Taq Enzyme Mix(Invitrogen,1732-088);12.5 μl反应混合物;1 μl引物探针;0.5 μl ROX Reference染液;0.5 μl RNaseOUT(invitrogen,10777-019);5 μl无Nuclease水)。向所对应的孔分别加入加入5 μl去离子水、质控RNAs和样本RNAs,加入后用枪头轻微吹,混匀。质粒校准品温育后,震荡混匀30 s,全速离心1 min,对应实验模板位置,分别加入5 μl,加入后用枪头吹打,混匀。加样完毕后,震荡混匀,微离心,进行PCR。PCR反应条件为:50℃15 min,95℃2 min;95℃15 s,60℃1 min,共42个循环。1%琼脂糖凝胶电泳,使用实时PCR定量仪(Roche 480)进行检测。
1.3统计学分析
所有实验均重复3次,实验数据均采用均数±标准差(x±s)表示,使用SPSS 13.0进行统计学分析,组间比较采用方差分析,以P<0.05为有显著性统计学意义。
2 结果
2.1实时荧光定量PCR检测结果的判定
每一个检测样本每一个检测样本均设置平行对照。依据PCR扩增过程中荧光信号曲线具有典型的校正期、指数增长期和平台期三期特征,并且Ct值(cycle at threshold,指在PCR扩增过程中,荧光信号开始由本底进入指数增长阶段的拐点所对应的循环次数)不高于最大稀释倍数(即最小基因拷贝数)阳性标准品的Ct值,将符合上述条件的未知样本定为检测结果阳性(指表达融合基因),反之为结果阴性。由定量PCR仪自带的分析软件根据阳性标准曲线和检测样本的Ct值自动计算出样本融合基因或ABL基因的绝对拷贝数。结果以(融合基因拷贝数/ABL基因拷贝数× 100%)来表示(图1、2)。
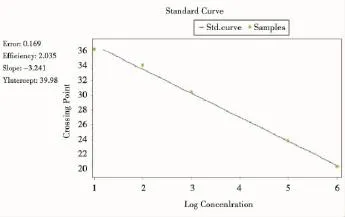
图1 实时定量PCR阳性标本标准曲线Figure 1Real-time quantitative PCR standard curve of positive specimens
2.2bcr-abl融合基因的表达情况bcr-abl融合基因在对照组患
者标本中无表达。在经过伊马替尼治疗的CML缓解病人标本中的表达情况,阳性率为88.3%(30/34)。在未治疗病人标本中均有表达(表1)。同时,我们对病人标本中bcr-abl融合基因的拷贝数进行了比较。结果如图3所示,bcr-abl融合基因在未治疗病人标本中的拷贝数明显高于伊马替尼治疗缓解组(P<0.05)。
3 讨论
荧光定量RT-PCR是近年研制出的一种核酸定量技术[4]。该技术是在常规PCR基础上加入荧光标记探针,该技术即保持了PCR技术灵敏、快速的特点,又克服了以往PCR存在的假阳性污染和对PCR产物观察过程的繁杂、费时、费力及对操作者的毒害作用等缺点,同时它使得PCR由定性经历过半定量阶段终于实现了真正的定量,已成为分子生物学研究的一种重要的手段。RQ-PCR的特点是建立实时扩增曲线,根据标准品的Ct值建立标准曲线,进而对未知样品定量,由于Ct值与起始cDNA量有良好的相关性,因此可以实现真正意义的定量[5]。与普通定性PCR比较。实时定量RT-PCR具有高灵敏、高特异、快速简便和结果可靠的优点。通过实时定量RT-PCR监测bcr-abl转录水平的变化,可以预测CML患者的治疗反应、定量白血病细胞的残余数量和预测急变,这比细胞遗传学检查早数月[6]。因为样品之间RNA质量以及cDNA含量有差异,所以需要用合适的参比基因进行归一化。我们选用各种细胞中表达量较恒定的ABL基因作为参比基因。
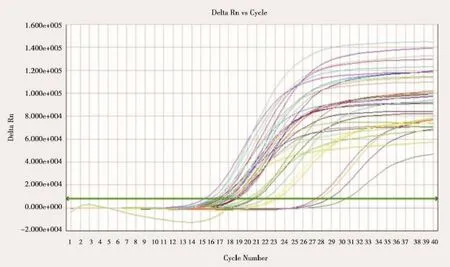
图2 不同样品中检测基因实时扩增曲线Figure 2Real-time amplification curve of different samples

表1 CML缓病人标本中bcr-abl表达情况Table 1Expression of bcr-abl of CML patients
Ph染色体是CML的特异性标志染色体,是由9q34和22q11相互易位所致[7]。bcr-abl融合基因见于95%以上CML患者,也见于20%~25%成人ALL和2%~4%儿童ALL患者。约6%成人急性髓细胞性白血病(acute myeloblastic leukemia,AML)、1%儿童AML和10%急性混合细胞型白血病(acute mixed lineage leukemia,AMLL)患者中也可检测到Ph染色体和bcr-abl融合基因[8]。bcr-abl融合基因与CML发病发展密切相关,是CML的重要诊断指标之一,监测其转录水平的动态变化可预测白血病复发,是判断白血病预后的可靠指标[9]。
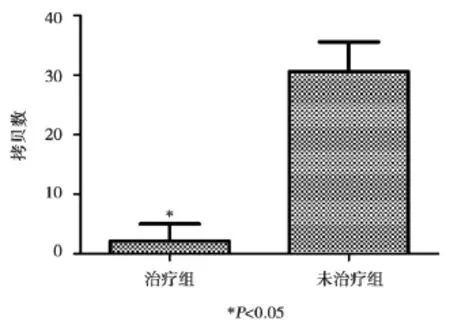
图3 治疗缓解病人与未经治疗病人bcr-abl表达情况Figure 3Expression of bcr-abl of patients with treatment remission and untreated patients
随着治疗手段和化疗药物的不断发展,大多数白血病患者可得到血液学和细胞遗传学缓解。但缓解后的复发成为影响患者远期预后的主要因素,是困扰白血病治疗的一个难点[10]。治疗后体内残留的白血病细胞-微小残留病变(minimal residual disease,MRD)是导致疾病复发的主要原因。MRD是指经放、化疗及造血干细胞移植等治疗,未达到清除性效果时,患者体内残留白血病细胞或肿瘤细胞的状态。在目前判断标准确定的MRD范围内,常规骨髓细胞形态学及细胞遗传学方法,不能敏感地检测MRD,难以客观地对病情转归进行科学预测,使治疗上存在较大的盲目性。检测MRD的临床意义,在于指导治疗方案设计、发现耐药、评估疗效、预测复发[11,12]。
bcr-abl基因作为CML的一种标志物,在临床中的应用已日益受到关注,以PCR为代表的分子生物学技术检测MRD得到广泛运用,其敏感性达10_6~10_5水平,是当今检测MRD的最灵敏手段。定量荧光RT-PCR持续性检测白血病融合基因是了解白血病患者体内肿瘤负荷及监控MRD的良好技术手段,可以动态观察患者体内融合基因转录表达水平的变化[13]。bcr-abl融合基因的水平与临床疗效有很好的相关性,并能预先对临床病情变化提出警示,对于肿瘤微小残留病灶的监测和及时调整治疗方案都有重要意义[14]。
在本研究全部良性非白血病人标本中未检测到bcr-abl融合基因,而在大部分CML检测到,阳性率是88.3%(30/34),bcr-abl融合基因是慢性粒细胞白血病的分子病理基础,对bcr-abl融合基因的检测有助于临床诊断和鉴别诊断。
在治疗缓解的CML病人中,bcr-abl融合基因的表达量比未经治疗病人的低,且具有统计学意义,说明随着病情缓解,bcr-abl融合基因表达量下解,所以bcr-abl融合基因定量可以用以指示慢性粒细胞白血病病人的病程,并且可以预测CML治疗效果的,MRD的监测是指导临床治疗、评价治疗效果和预测疾病预后的基础。所以,荧光定量PCR检测bcr-abl融合基因在评价预后以及微小残留病灶的检测方面是不可替代的。
[1]孟昭彦,温莉娟,刘丽明,等.应用荧光原位杂交技术检测慢性粒细胞白血病的融合基因[J].中国优生与遗传杂志,2011(2):21_22.
[2]Chen R,Hu T,Mahon G M,et al.Ubiquitin-mediated interaction of p210 bcr-abl with beta-catenin supports disease progression in a murine model for chronic myelogenous leukemia[J].Blood,2013,122(12):2114_ 2124.
[3]许家仁,朱广荣.老年白血病bcr-abl融合基因的表达及其临床意义[J].实用老年医学,2004(6):310_ 312.
[4]Piorkowska K,Oczkowicz M,Rozycki M,et al.Novel porcinehousekeepinggenesforreal-timeRT-PCR experiments normalization in adipose tissue:assessment of leptin mRNA quantity in different pig breeds[J].Meat Sci,2011,87(3):191_195.
[5]Puig N,Sarasquete M E,Balanzategui A,et al.Critical evaluationofASORQ-PCRforminimalresidualdisease evaluation in multiple myeloma.A comparative analysis with flow cytometry[J].Leukemia,2013,217.[Epub ahead of print]
[6]Muller M C,Gattermann N,Lahaye T,et al.Dynamics of BCR-ABL mRNA expression in first-line therapy of chronic myelogenousleukemia patients with imatinib or interferon alpha/ara-C[J].Leukemia,2003,17(12): 2392_2400.
[7]Ghaith F,Abdou S,El-Bendary A,et al.Prognostic relevanceof9q34deletionandthesuppressorof cytokine signalling-1 in CML patients[J].Int J Lab Hematol,2010,32(1 Pt 2):103_112.
[8]Kondo T,Tasaka T,Sano F,et al.Philadelphia chromosome-positive acute myeloid leukemia(Ph+ AML)treated with imatinib mesylate(IM):a report with IM plasma concentration and bcr-abl transcripts[J].Leuk Res,2009,33(9):e137_e138.
[9]Klamova H,Polakova K M,Muzik J,et al.Evaluation of 5-year imatinib treatment of 458 patients with CPCML in routine clinical practice and prognostic impact of different BCR-ABL cutoff levels[J].Cancer Med, 2013,2(2):216_225.
[10]金凤祥,江继发,程玮.造血干细胞移植后白血病复发2例的治疗体会并文献复习[J].临床和实验医学杂志, 2009(8):119_120.
[11]姚利,陈子兴,岑建农,等.荧光实时定量逆转录PCR监测急性早幼粒细胞白血病患者的分子学反应[J].癌症,2008(2):214_217.
[12]刘小华,孙爱宁,吴德沛,等.流式细胞术对急性白血病微小残留病的检测及意义[J].江苏医药,2007(5):455_ 457.
[13]Riva G,Luppi M,Quadrelli C,et al.BCR-ABL-specific cytotoxic T cells in the bone marrow of patients with Ph(+)acute lymphoblastic leukemia during secondgeneration tyrosine-kinase inhibitor therapy[J].Blood Cancer J,2011,1(7):e30.
[14]Scheuring U J,Pfeifer H,Wassmann B,et al.Early minimal residual disease(MRD)analysis during treatment of Philadelphia chromosome/Bcr-abl-positive acute lymphoblastic leukemia with the Abl-tyrosine kinase inhibitor imatinib(STI571)[J].Blood,2003,101 (1):85_90.
Detection of minimal residual in chronic myelocytic leukemia(CML)patients by Taqman technique
ZHAO Jingjing1,WANG Ying2,ZHANG Wenwei3,YU Xiuxue4,JIANG Bo4,LIANG Hui5,LI Jian4★
(1.Department of Clinical Laboratory,The First Affiliated Hospital of Guangzhou Medical University,Guangdong,Guangzhou 510120,China;2.Intensive Care Unit,the Third Affiliated Hospital,Sun Yat-sen University,Guangdong,Guangzhou 510630,China;3.Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangdong,Guangzhou 510080,China;4.Department of Pathogenic Biology and Immunology,Guangzhou Medical Univercity,Guangdong,Guangzhou 510182,China;5.Department of Urology,People's Hospital of New District Longhua,Guangdong,Shenzhen 518109,China)
ObjectiveTo detect the expression level of mRNA of bcr-abl fusion gene dynamical ly,and evaluate minimal residual disease(MRD)after therapy by Glivec(Imatinib Mesylate Capsules)for the patients of chronic myelocytic leukemia(CML).MethodsExpression levels of bcr-abl fusion gene mRNA was detected by Real Time Quantitative PCR(RQ-PCR)technique.34 samples from CML patients(including 17 patients treated with Glivec and 17 untreated patients)were collected from Kingmed.The expression levels of bcr-abl fusion gene mRNA CML patients were compared with that of the patients with other benign blood tumors,and combined with clinical situation,to explore the correlation of expression of bcr-abl between CMLpatients and others,and the significance of minimal residual disease(MRD)on CML’s therapy.Results Expression of bcr-abl was 88.3%(30/34)in CML,and no expression in the patients with benign blood disease was found.The patients treated with Glivec who showed improvement was observed,too.The expression of bcr-abl is lower than those untreated patients(P<0.05).ConclusionRQ-PCR was the suitable method for monitored MRD in CML,bcr-abl could serve as a molecular mark for CML.
Chronic Myelocytic Leukemia;bcr-abl;Minimal Residual Disease(MRD);RQPCR
广东省医学科研基金(A2012603)
1.广州医科大学附属第一医院检验科,广东,广州510120 2.中山大学附属第三医院重症监护室,广东,广州510630 3.广东省人民医院广东省医学科学院,广东,广州510080 4.广州医科大学病原生物学与免疫学教研室,广东,广州510182 5.深圳市龙华新区人民医院泌尿外科,广东,深圳518109
★通讯作者:李剑,E-mail:stevenlee9@sina.com

