间充质干细胞治疗肝纤维化:促进纤维化还是逆转纤维化?
王汉裕 刘拥军
·述评·
间充质干细胞治疗肝纤维化:促进纤维化还是逆转纤维化?
王汉裕 刘拥军★
间充质干细胞对肝纤维化的作用尚未有定论。有些数据显示间充质干细胞促进肝纤维化的发展;另一些数据显示间充质干细胞能逆转肝纤维化,促进肝脏机制中胶原纤维的降解。结合间充质干细胞的细胞生物学特性,我们尝试分析目前的文献,进一步阐述间充质干细胞对肝纤维化所起的作用。通过分析文献和总结我们的实验结果,大量数据支持间充质干细胞能逆转肝纤维化。另外,四氯化碳诱导的肝纤维化模型动物存在自愈的现象。因此,在间充质干细胞治疗肝纤维化实验中,必须优化实验设计和治疗方案,才能很好的评价实验结果。
间充质干细胞;肝纤维化;促进肝纤维化;逆转肝纤维化
肝纤维化(liver fibrosis)是细胞外基质(extracellular matrix,ECM)在肝内过渡沉积的病理改变,是各种慢性肝病发展为肝硬化的重要中间环节。目前认为其机制主要是慢性致病因素作用于肝脏,造成肝脏长期的慢性损伤,激活肝星状细胞(hepatic stellate cells,HSC),引起肝脏细胞中外基质(extracellular matrix,ECM)的合成与降解失衡,导致细胞间质过度沉积所致。干细胞治疗作为新技术的深入研究,促进了间充质干细胞治疗肝纤维化的动物实验和临床试验的发展。
在骨髓中存在两种主要的干细胞,造血干细胞和间充质干细胞(mesenchymal stem cells,MSC)。这两种干细胞的细胞生物学特性和功能完全不同。在一些文献中,通过把密度梯度分离方法,收集骨髓干细胞,并应用这些骨髓干细胞治疗肝病。由于骨髓干细胞包括造血干细胞、间充质干细胞,还有一些血液系统的祖细胞,因此用这些混合群体的干细胞治疗肝病,尤其是肝纤维化,其结论是值得商榷的。
有些研究发现MSC促进肝纤维化的发展[1-2],然而更多的研究证明了MSC能逆转肝纤维化,促进了基质中纤维化胶原的降解[3-7];相似的实验得出完全相反的结论,因此非常值得我们深入分析这些文献的数据和实验设计。目前的临床试验报道证明MSC治疗仅限于明显改善肝功能[8-12],因此本文结合间充质干细胞的一些细胞生物学特性和我们的实验结果,对目前的动物实验文献进行述评,以期引起研究者的讨论和进一步深入的研究。
1 如何选取评价疗效的标准
尽管四氯化碳诱导的肝纤维化模型动物,在停止注射四氯化碳后,具有自愈能力[13],但是这依然是最经典的肝纤维化动物模型。在肝纤维化/肝硬化的病理发展过程中,肝星状细胞发挥最重要的病理作用[14,15]。肝脏受到各种原因引起的损伤后,激活肝脏中静止状态的HSC,活化的HSC增殖并分泌基质金属蛋白酶降解正常基质,随后分泌大量的Ⅰ型和Ⅲ型胶原纤维,沉积在肝脏基质中,从而形成纤维化基质[14,16](图1A)。
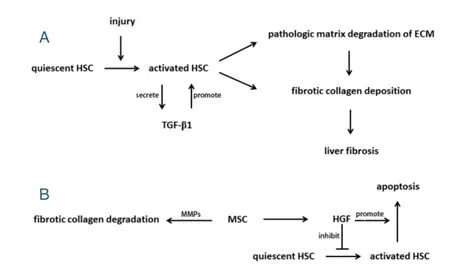
图1肝纤维化机制及MSC治疗肝纤维化的潜在机制Figure 1Mechanism of liver fibrosis and of MSC treatment
图1 A,肝脏受到损伤后,损伤信号激活静止状态的肝星状细胞进入活化状态;活化的肝星状细胞分泌高浓度的转化生长因子β1(transforming growth factor-β1,TGF-β1),通过旁分泌作用于肝星状细胞自身,促进了肝星状细胞的持续活化,诱导肝星状细胞早期分泌MMPs,降解正常的基质成分,形成了肝纤维化早期基质的病理性降解;同时,活化的肝星状细胞分泌纤维化性的胶原纤维,沉积于肝脏基质中,肝纤维化形成。图1B,MSC分泌MMPs,降解肝脏基质中纤维化性胶原纤维;亦分泌HGF,不仅抑制肝星状细胞的活化,而且促进活化的肝星状细胞的凋亡,从而治疗肝纤维化。
不少研究发现HSC激活后,平滑肌肌动蛋白α(smooth muscle actin-α,α-SMA)表达增加,同时表达结蛋白(desmin)和胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)[17,18]。有研究发现,给纤维化动物输入MSCs后,肝脏基质中α-SMA表达增加,据此证明MSC促进HSC的增殖,进而促进肝纤维化[1]。然而,此结论是值得商榷的,因为MSC本身就高表达α-SMA和GFAP[19,20],MSC趋化富集到损伤的肝脏后,肝脏中总的α-SMA表达是增加的,但这并不能证明活化的HSC在MSC治疗后进一步增殖;只有当活化的HSC进入静止期或者凋亡后,肝脏总α-SMA才会出现下降的趋势。
肌纤维母细胞(myofibroblasts)亦表达平滑肌肌动蛋白α、纤维连接蛋白(fibronectin)、波形蛋白(vimentin)[21]。肝脏中肌纤维母细胞的起源存在争议,可能来源于骨髓干细胞[22],也可能来源于肝脏干细胞[23]。然而,我们发现MSCs不仅表达α-SMA,也高表达纤维连接蛋白和波形蛋白。这也可能是早期研究认为肝脏肌纤维母细胞来源于骨髓基质干/祖细胞的原因[1,19,22]。因此,如果在MSCs治疗后,肝脏基质中出现α-SMA、纤维连接蛋白(fibronectin)、波形蛋白(vimentin)表达的增加,尚不能判断为肝星状细胞或者肌纤维母细胞增殖。
TGF-β1是激活肝星状细胞分泌I型胶原和其他基质组分的最强效因子。在肝纤维化的早期阶段,骨髓巨噬细胞和肝脏Kupffer细胞是TGF-β1最主要的来源。在四氯化碳诱导的肝纤维化模型动物中,肝脏基质中TGF-β1的mRNA水平增高将近2倍[1]。TGF-β1激活HSC分泌多种细胞因子和生长因子,通过自分泌环促进HSC本身的增殖,从而进入肝纤维化持续阶段[15]。TGF-β1在肝纤维化病理变化过程中起到非常重要的作用,不仅能促进肝星状细胞的增殖和继续活化,而且能诱导活化的肝星状细胞分泌纤维化性的胶原纤维,从而加剧了肝纤维化的进展(图1A)。肝细胞生长因子(hepatocyte growth factor,HGF)促进肝细胞的增殖,直接抑制肝脏HSC分泌TGF-β1。肝细胞的凋亡促进HSCs的激活,HGF通过减少刺激物对肝细胞的损伤及凋亡,间接地抑制HSCs的激活。HGF刺激HSC分泌基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1)[24],这有利于肝纤维化的恢复。由于HGF对肝纤维化的治疗有多重作用机制,直接用HGF注射治疗肝纤维化模型动物,能促进肝基质中沉积的胶原纤维的降解和肝细胞的再生[25,26]。但是,我们发现MSC在正常培养的条件下,同时表达HGF和TGF-β1(图2);MSC进入肝纤维化动物体内的因子表达谱非常值得深入研究。
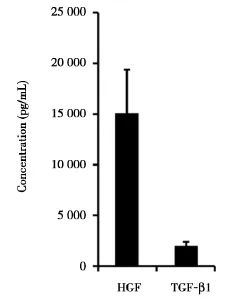
图2 MSC在正常培养条件下,同时表达HGF和TGF-β1Figure 2MSC express both HGF and TGF-β1
由于MSC自身表达α-SMA和TGF-β1,因此,在MSC治疗肝纤维化的动物实验中,α-SMA和TGF-β1不适合作为肝纤维化病理变化的指标。虽然组化染色结果与取材部位密切相关,但肝脏组化染色,包括苏木精_伊红染色法(HE染色)和Masson三色染色法,应该作为肝纤维化病理变化的金标准。
2 肝纤维化的MSC治疗方案
在研究和评价MSC治疗肝纤维化的疗效及作用时,必须考虑MSC治疗方案;同时,也需要分清MSC在整个实验中所起的作用:是治疗还是预防?治疗,意味着先建立动物模型,再进行MSC治疗;预防,意味着在模型建立结束前,已经给予MSC干预。四氯化碳诱导肝纤维化的经典动物模型中,四氯化碳给药时间大概连续8周;有研究者在四氯化碳注射4周后,给予MSC治疗,然后继续四氯化碳注射4周,继而评价MSC的疗效[3,5]。在这样的动物实验设计中,MSC所起的作用应该是预防肝纤维化而不是治疗肝纤维化。
治疗后的观察周期也是值得重视和研究的。我们研究发现MSC治疗2周后,能明显减轻肝脏基质中胶原纤维的沉积,但是尚未能恢复到正常基质。早期研究证明治疗4周后,肝纤维化大鼠亦不能完全恢复到正常基质[6],这说明模型大鼠要恢复到健康状态需要不少于4周的时间。有研究发现MSC治疗肝纤维化大鼠,疗效和安慰剂对照组没有统计学差异[2]。分析这篇文献,我们发现MSC治疗组和安慰剂对照组大鼠在2个月后的肝脏基质中胶原纤维沉淀都显著减少,虽然没显示出统计学差异,但是MSC治疗组大鼠的胶原纤维消退速度更快。这也说明肝纤维化大鼠的自愈速度超出设计者的想象,而在建立模型后没给予一定程度的维持下肝损伤。不少研究发现单次MSC治疗即可明显减轻基质中胶原纤维的沉积[4,6]。很明显,不同的实验设计可能产生不同的实验结果,进而对MSC的疗效评价产生影响,必须重视这个问题的存在(表1)。
3 总结与展望
由于肝纤维化动物具有很强的自愈能力,在建立模型后,给予一定程度的四氯化碳维持肝损伤有利于减缓自愈速度。虽然在体外实验中发现MSC同时表达HGF和TGF-β1,但是需要深入研究MSC进入纤维化肝脏的局部环境后,其因子分泌表达谱等细胞生物学等的改变。大多数的实验证明单次MSC治疗肝纤维能取得较好的疗效,但是还需要继续优化MSC的治疗方案,使得MSC治疗后纤维化肝脏能恢复到接近正常肝脏的水平。我们和其他研究小组的动物实验证明,MSC能有效地降解纤维化性的胶原纤维,促进了肝脏的恢复,其治疗机制可能在于MSC分泌高浓度的HGF和MMPs。HGF能抑制肝星状细胞的激活,并促进已经激活的肝星状细胞的凋亡;而MMPs则能降解纤维化性的胶原纤维(图1B)。目前认为MSC的治疗机制之一在于其趋化到损伤组织后,分泌可溶性因子,通过旁分泌发挥作用。而我们发现转化生长因子β1和血管内皮生长因子对MSC的趋化能力有不同的影响,从而可能会影响MSC的治疗效果[27,28]。

表1 MSC治疗肝纤维化动物实验信息表Table 1Animal study using MSC treatment for liver fibrosis
虽然目前的临床试验数据证明MSC治疗能改善肝功能[8_12],但还缺乏足够的组化证据,而且尚没有MSC治疗能逆转肝纤维化/肝硬化的临床报道,其原因可能在于以下方面尚未得到优化:①MSC的剂量;②MSC治疗频率;③观察周期。间充质干细胞具有其独特的免疫调节和修复组织器官等功能,广泛地应用于临床细胞治疗研究。虽然目前已经明确间充质干细胞治疗多种疾病的有效性,尤其是肝脏疾病,但是治疗机制尚未非常明确,更重要的是,个体化的最佳治疗方案依然需要大规模的研究。只有治疗方案优化后,才能取得最佳治疗效果,更好地促进患者健康。
[1]Li C,Kong Y,Wang H,et al.Homing of bone marrowmesenchymalstemcellsmediatedby sphingosine 1-phosphate contributes to liver fibrosis[J].J Hepatol,2009,50(6):1174_1183.
[2]Carvalho A B,Quintanilha L F,Dias J V,et al.Bone marrow multipotent mesenchymal stromal cells do not reduce fibrosis or improve function in a rat model of severe chronic liver injury[J].Stem Cells,2008,26(5): 1307_1314.
[3]Zhang D,Jiang M,Miao D.Transplanted human amniotic membrane-derived mesenchymal stem cells ameliorate carbon tetrachloride-induced liver cirrhosis in mouse[J].PLoS One,2011,6(2);e16789.
[4]Lee M J,Jung J,Na K H,et al.Anti-fibrotic effect of chorionic plate-derived mesenchymal stem cells isolated from human placenta in a rat model of CCl(4)-injured liver:potential application to the treatment of hepatic diseases[J].J Cell Biochem,2010,111(6):1453-1463.
[5]Tsai P C,Fu T W,Chen Y M,et al.The therapeutic potential of human umbilical mesenchymal stem cells from Wharton's jelly in the treatment of rat liver fibrosis[J].Liver Transpl,2009,15(5):484_495.
[6]Jung K H,Shin H P,Lee S,et al.Effect of human umbilical cord blood-derived mesenchymal stem cells in a cirrhotic rat model[J].Liver Int,2009,29(6):898_ 909.
[7]Shao C H,Chen S L,Dong T F,et al.Transplantation of bone marrow-derived mesenchymal stem cells after regional hepatic irradiation ameliorates thioacetamideinduced liver fibrosis in rats[J].J Surg Res,2014,186 (1):408_416.
[8]Zhang Z,Lin H,Shi M,et al.Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients[J].J Gastroenterol Hepatol,2012,27 Suppl:2112_2120.
[9]Kharaziha P,Hellstrom P M,Noorinayer B,et al.Improvement of liver function in liver cirrhosis patients after autologous mesenchymal stem cell injection:a phaseⅠ_Ⅱclinical trial[J].Eur J Gastroenterol Hepatol,2009,21(10):1199_1205.
[10]Terai S,Ishikawa T,Omori K,et al.Improved liver function in patients with liver cirrhosis after autologousbone marrow cell infusion therapy[J].Stem Cells,2006, 24(10):2292_2298.
[11]Shi M,Zhang Z,Xu R,et al.Human mesenchymal stem cell transfusion is safe and improves liver function in acute-on-chronic liver failure patients[J].Stem Cells Transl Med,2012,1(10):725_731.
[12]Zhang Z,Wang F S.Stem cell therapies for liver failure and cirrhosis[J].J Hepatol,2013,59(1):183_185.
[13]Iredale J P,Benyon R C,Pickering J,et al.Mechanisms of spontaneous resolution of rat liver fibrosis.Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors[J].J Clin Invest,1998,102 (3):538_549.
[14]Bataller R,Brenner D A.Liver fibrosis[J].J Clin Invest,2005,115(2):209_218.
[15]Friedman S L.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655_1669.
[16]Friedman S L,Roll F J,Boyles J,et al.Hepatic lipocytes:the principal collagen-producing cells of normal rat liver[J].Proc Natl Acad Sci U S A,1985,82 (24):8681_8685.
[17]Geerts A.History,heterogeneity,developmental biology,and functions of quiescent hepatic stellate cells [J].Semin Liver Dis,2001,21(3):311_335.
[18]Friedman S L.Hepatic stellate cells:protean, multifunctional,and enigmatic cells of the liver[J].Physiol Rev,2008,88(1):125_172.
[19]Di Bonzo L V,Ferrero I,Cravanzola C,et al.Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine:engraftment and hepatocyte differentiation versus profibrogenic potential[J].Gut, 2008,57(2):223_231.
[20]Kinner B,Zaleskas J M,Spector M.Regulation of smooth muscle actin expression and contraction in adult human mesenchymal stem cells[J].Exp Cell Res,2002, 278(1):72_83.
[21]Eyden B.The myofibroblast:phenotypic characterization as a prerequisite to understanding its functions in translational medicine[J].J Cell Mol Med,2008,12(1): 22_37.
[22]Forbes S J,Russo F P,Rey V,et al.A significant proportion of myofibroblasts are of bone marrow origin in human liver fibrosis[J].Gastroenterology,2004,126 (4):955_963.
[23]Kisseleva T,Brenner D A.Hepatic stellate cells and the reversal of fibrosis[J].J Gastroenterol Hepatol,2006, 21 Suppl:3S84_87.
[24]Ozaki I,Zhao G,Mizuta T,et al.Hepatocyte growth factor induces collagenase(matrix metalloproteinase-1) via the transcription factor Ets-1 in human hepatic stellate cell line[J].J Hepatol,2002,36(2):169_178.
[25]Ueki T,Kaneda Y,Tsutsui H,et al.Hepatocyte growth factor gene therapy of liver cirrhosis in rats[J].Nat Med,1999,5(2):226_230.
[26]Yasuda H,Imai E,Shiota A,et al.Antifibrogenic effect of a deletion variant of hepatocyte growth factor on liver fibrosis in rats[J].Hepatology,1996,24(3): 636_642.
[27]王汉裕,王立华,朱德林,等.转化生长因子β1下调间充质干细胞表达CXCR4[J].分子诊断与治疗杂志, 2012,4(2):79_83.
[28]王汉裕,李燕,刘圆,等.血管内皮生长因子通过CXCR4增强间充质干细胞的趋化能力[J].分子诊断与治疗杂志,2012,4(5):299_303.
Application of mesenchymal stem cells for liver fibrosis:pro-fibrosis or anti-fibrosis?
WANG Hanyu,LIU Yongjun★
(Alliancells Institute of Stem Cells and Translational Regenerative Medicine,Tianjin 300308,China)
The contribution of mesenchymal stem cells to liver fibrosis remains controversial.Some evidences showed mesenchymal stem cells promoted liver fibrogenesis.Others revealed the anti-fibrosis effect of mesenchymal stem cells.Combined with some properties of mesenchymal stem cells,and with our previous results,we tried to elaborate the contribution of mesenchymal stem cells to liver fibrosis.And mesenchymal stem cells reduce liver fibrosis by complex mechanism.In addition,continuous liver injury(such as prolonged admimistration of carbon tetrachloride)would retard spontaneous resolution of liver fibrosis.It is necessary to optimize both therapeutic regimen of MSCs and experimental design for liver fibrosis.
Mesenchymal stem cells;Liver fibrosis;Pro-fibrosis;Anti-fibrosis
国家自然科学基金(30872618)
和泽干细胞转化再生医学研究中心,天津300308
★通讯作者:刘拥军,E-mail:andyliuliu2001@aliyun.com

