裸鼠人异位移植胃癌肝转移和腹膜转移模型的实验研究
刘福全,王 健,赵雪峰
(大连大学 附属新华医院 胃肠微创外科中心,辽宁 大连116021)
胃癌是最常见的消化道恶性肿瘤之一,发病率占恶性肿瘤的第4 位,肿瘤相关死亡率的第2 位[1]。胃癌根治术后最常见的3 种复发转移模式为区域淋巴结复发和转移、肝转移、腹膜种植转移。肝脏是胃癌血行转移最常见的部位,是胃癌转移的第一靶器官;腹膜又成为胃癌细胞种植的适宜的“土壤”[2]。胃癌晚期主要发生肝转移和腹膜种植转移,转移率高达40% ~50%[3-4]。研究胃癌转移癌的发生机理及防治策略,需要可靠而稳定的动物模型系统。
胃癌的原位移植模型再现胃癌的大多数生物学特性,但转移部位广泛,缺少系统的以肝或腹膜为主要靶向的转移模型,使其应用受到一定的限制。本课题主要将同等数量不同种类胃癌细胞株建立裸鼠异位移植胃癌肝转移模型及腹膜转移模型,观察转移癌的生物学过程,揭开胃癌侵袭转移的生物学行为,为胃癌的基础与临床研究提供可靠、实用的动物模型。
1 材料和方法
1.1 材 料
人胃癌细胞株MKN-45 和TMK-1(ATCC)由韩国CNU 肿瘤研究所Young -Kyu Park 教授捐赠。BALb/c 品系裸鼠40 只,7 周龄雌性,体重18 ~20 g,由韩国CNU 实验动物研究中心提供。
1.2 方 法
1. 2. 1 细胞培养及悬液制备:人胃癌细胞株MKN-45 和TMK -1 在37 ℃、5% CO2,含10%小牛血清的RPMI 1640 培养液中传代培养,每2 ~3 天换1 次培养液。培养至80% ~90% 融合时,用0.25%胰酶消化液消化后,1 200 r/min 离心3 min,弃上清液,加无血清RPMI 1640 培养液洗细胞2 次,显微镜下计数。制备好的细胞悬液放冰浴保存,于30 min 内进行接种。
1.2.2 异位移植胃癌肝转移模型的建立:根据麻醉预实验结果选取5%水合氯醛5 mg/kg 行腹腔内麻醉。常规消毒皮肤,取上腹正中切口约0.5 cm,入腹后小心显露脾脏,使脾中、下极拉出切口外,将31号针头从脾脏中央进针约5 mm 缓慢注入肿瘤细胞悬液至脾被膜下,注入5 ×106MKN -45 或TMK -1癌细胞悬液100 μL。可见注射部位脾被膜发白肿胀,拔出针头同时即用止血小纱布压迫,轻轻按压约20 s。10 min 后夹闭、切断脾脏两侧血管,完整切除脾脏,送回网膜等附件后,关腹。建立模型全程应防止胰腺和胃及主要血管的损伤,也要防止注射细胞的渗漏。
1.2.3 异位移植胃癌腹膜转移模型的建立:左手抓住裸鼠使腹部朝上,头低位约15°,向头侧摇晃裸鼠使肠管移向膈肌层面。右手常规消毒腹壁,利用31号针头选择左下腹迷路进针达腹腔,挑起针头确认为腹腔后,注入5 ×106MKN-45 或TMK-1 癌细胞悬液200 μL。拔出针头同时小纱布压迫片刻。建立模型全程应防止针头刺入空腔脏器、皮下及腹部肌层。
1.2.4 胃癌肝转移和腹膜转移评分标准:肝转移模型评分标准如下:0 为无肝转移;1 为最低限度侵及肝脏,浸润范围<0.5 cm2;2 为轻度侵及肝脏,浸润范围0.5 ~1.0 cm2;3 为中度侵及肝脏,浸润范围1.0 ~2.0 cm2;4 为重度侵及肝脏,浸润范围>2.0 cm2。腹膜转移模型的评分标准分为有或无。
1.2.5 实验观察指标:每天常规观察记录裸鼠状态,包括饮食、营养、活动量、皮肤及排泄物状态。裸鼠出现濒死前症状或观察期满3 周或6 周时予以处死。首先解剖观察腹腔内移植瘤情况,包括直径大小、生长部位,质地、颜色变化、播散及侵袭范围、腹盆腔有无腹水及其性状、区域或远处淋巴结肿大或转移、远处脏器转移情况等。同时观察胸腔内、颅内转移瘤情况。所有肉眼可疑部位照相并取材,病灶进行计数和计量,取出后充分固定在4%多聚甲醛,行病理学检查。
1.3 统计学方法
应用SPSS 14.0 统计软件分析,两组统计数据的差异采用t 检验,不同种类细胞间的相关性分析采用Spearman 等级相关分析,P <0.05 表示有统计学意义。
2 结 果
2.1 不同种类胃癌细胞接种的成瘤效果比较
异位移植转移模型的制模过程无一例死亡,成功率达100%(40/40)。
MKN-45 胃癌细胞经脾肝转移制模3 周后解剖腹腔,发现肝转移灶突出肝表面,大多分布在肝缘,部分融合,呈灰白色,椭圆形结节,质硬,肝转移评分为2 ~3,但未发现周围淋巴结肿大,也无血性腹水及腹膜种植转移。制模6 周后,发现肝转移灶累及全肝,融合成片,高低不平结节,质硬,肝转移评分均为4,区域淋巴结肿大或转移(2/5;40%),血性腹水(1/5;20%)(图1A -B,表1)。胸腔内、颅内未见转移灶。TMK -1 胃癌细胞经脾肝转移制模3周后解剖腹腔,发现肝转移灶突出肝表面,但零星可数,分布在胆囊周围的肝缘,呈淡白色,不规则结节,质中,肝转移评分为1 ~2,未发现周围淋巴结肿大,也无血性腹水及腹膜种植转移。制模6 周后,发现肝转移灶增多,病灶明显突出于肝表面,未融合,肿物巨大,呈灰白色,略圆形,肿物高低不平,质硬,肝转移评分均为4,出现血性腹水(2/5;40%),但无区域淋巴结肿大(图1C-D,表1)。胸腔内、颅内未见转移灶。
MKN-45 胃癌细胞注入腹腔制模3 周后解剖腹腔,发现肠系膜转移灶清楚可数(范围No.19 ~30),病灶较小,略透明,椭圆形,质软,无血性腹水和远处转移。制模6 周后,发现腹膜转移灶明显增多(范围No.49 ~96),病灶变大,多侵及高位胆管而形成胆汁淤积、胆汁渗漏,肿物表面呈淡黄色,略圆形,质地变硬,出现血性腹水(2/5;40%),肺等远处脏器转移(3/5;60%)(图1E - F,表2)。TMK -1胃癌细胞注入腹腔内制模3 周后解剖腹腔,发现肠系膜转移灶部分融合,呈灰白色,不规则形状,质中,病灶数少(范围No.2 ~8),无血性腹水和远处转移。制模6 周后,发现腹膜转移灶明显增多(范围No.18 ~28),病灶巨大,与其他脏器分界不清,呈白色,质硬,大多与肠系膜血管粘连融合,开始出现血性腹水(2/5;40%),肺等远处脏器转移(2/5;40%)(图1G-H,表2)。

图1 接种MKN-45 和TMK-1 胃癌细胞转移瘤照片Fig 1 Photographs of the tumor growth in the metastatic tumors after MKN-45 and TMK-1 gastric cancer cell line inoculation
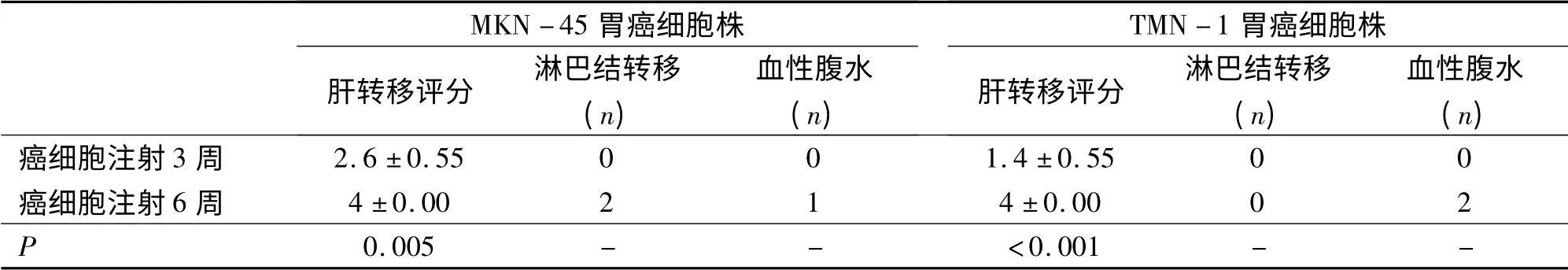
表1 胃癌肝转移模型成膜比较Tab 1 comparison of liver metastasis model
MKN -45 和TMK -1 胃癌细胞经脾肝转移制模3 周组肝转移评分明显低于制模6 周组,差异有显著性意义(分别为P = 0. 005 和P <0. 001);MKN-45 和TMK-1 胃癌细胞注入腹腔制模3 周组腹膜转移结节数明显少于制模6 周组(分别为P=0.003和P <0.001);两组模型的不同种类胃癌细胞株之间的局部和远处转移率无明显相关性(r =0.251,P >0.05)(表1-2)。

表2 胃癌腹膜转移模型成膜比较Tab 2 comparison of peritoneal metastasis model
2.2 成瘤组织病理学观察
接种MKN -45 胃癌细胞株为例,其成瘤癌细胞特点为片状、巢状或条索状排列,形态呈圆形、椭圆形、条索形或不规则形,细胞分化程度低,核大,深染,核质比大,易见核分裂,浸润性生长。转移至淋巴结、肝脏及腹膜的癌细胞,依次为居中分布在诸多淋巴细胞周围、肝血管窦周围及血管周围(图2)。转移瘤细胞形态特征与原发胃癌细胞相似。

图2 接种MKN-45 胃癌细胞株后转移瘤病理切片 (×200)Fig 2 Pathological identification of the metastatic tumors in the lymph node,liver,and peritoneum after MKN-45 gastric cancer cell line inoculation (Original magnification ×200)
3 讨 论
肿瘤转移是极其复杂的过程,包括细胞外基质的降解、细胞粘附性能改变、肿瘤血管形成、细胞存活等几个方面[5]。大多数肿瘤转移都遵循每个复杂的转移步骤,但只有少数具有突破一系列的屏障的潜能而发生转移。每个转移步骤都涉及多种分子事件,这一分子事件的了解将为肿瘤转移的预防和治疗提供理论依据。因此,了解胃癌肝转移和腹膜转移的分子机制是胃癌诊治中的一项重要而迫切的任务。
建立合理的异位移植胃癌肝转移及腹膜转移模型是研究胃癌转移机制的基础。目前对原位移植和异位移植模型的制作有一定的分歧,趋向于原位移植转移法比异位移植转移法更好地完成并再现肿瘤发生、发展的恶性生物学行为过程。原位移植模型,虽然有肿瘤原位生长、又有区域淋巴结肿大及转移癌形成等优点,但腹腔内区域淋巴结及腹腔转移灶区分困难,也不利于实验观察和抗转移治疗的处理,更不便于胃癌单纯肝转移或腹膜转移的相关研究[6]。为此,本组将不同种类癌细胞为媒介制作异位移植模型,判断其模型可否值得前临床推广。本实验研究的优势在于:(1)同等数量不同种类癌细胞株建立的异位移植模型,并同等条件下观察模型的成瘤变化,成功再现同种类又不同分化程度癌肿的浸润和转移能力;(2)癌细胞与Matrigel 的混匀注入,可使癌细胞游动空间局限而成模稳定,也有防止术中渗漏的功效;(3)经脾注入癌细胞数分钟后切除脾脏的方法,不仅能将癌细胞充分游移至肝脏并粘附于肝脏,且减少了其他影响因素,更适合单纯性胃癌肝转移的研究;(4)腹膜转移模型未进行腹腔内麻醉,使得癌细胞在腹腔内的成活率倍增,加上操作完成后裸鼠方可立即活动,增加了癌细胞在腹腔内的扩散和移动。(5)所有操作简便易行,且成瘤率达100%,能满足量化实验,值得临床推广应用。但其弱势在于使用了癌细胞株,产生的肿瘤无法形成原有的腺管样改变。
原位移植模型的预制模过程中,发现制模6 周后才开始出现区域淋巴结及腹膜种植转移。由于胃壁注射层面控制困难等诸多因素的制约,模型制作后成瘤相差悬殊,且制模时易控的浆膜下的肿物极易破溃,并肉眼很难辨认结节的来源。因此不适于肿瘤转移机制的研究模型。本研究主推的异位移植肝转移模型中易见,制模3 周的肝转移评分为≤3,无区域淋巴结转移及腹膜种植转移;制模6 周的肝转移评分均为4,开始出现区域淋巴结肿大或转移,但无腹膜种植转移或远处转移。说明此模型可谓良好的肝转移专一模型。异位移植腹膜转移模型中也不难发现,制模3 周时无远处转移迹象;但制模6 周时开始出现肺转移。此模型弥补了单纯转移模型不符合多脏器转移研究的空白,也可谓良好的腹膜转移或腹膜转移+肺转移研究模型。
由于各种条件的限制只能观察制模3 周或6 周后处死的裸鼠,不能以1 周为单量策划详细、周密、系统的实验。因此购进小动物专用IVIS、SPECT/CT、PET/CT 等分子影像学设备是满足前临床实验研究与科技同步高速发展的需求,也弥补基础实验越来越满足不了飞速发展的临床医学的需求[7-8]。
综合评价本研究的结果:异位移植模型是研究胃癌转移规律及防治措施的可取模型。组织病理学研究结果也表明,异位移植模型较好地体现出胃癌转移的基本生物学特点,包括胃周淋巴结转移、肝脏转移及腹膜转移。该模型符合区域或远处转移的生物学行为研究,值得推广应用。
特此,感谢韩国Young Kyu Park 教授的捐赠。
[1] Jemal A,Siegel R,Xu J,et al. Cancer statistics,2010[J]. CA Cancer J Clin,2011,61(2):133 -134.
[2] Yashiro M,Chung YS,Inoue T,et al. Hepatocyte growth factor (HGF)produced by peritoneal fibroblasts may affect mesothelial cell morphology and promote peritoneal dissemination[J]. Int J Cancer,1996,67(2):289 -293.
[3] Miki Y,Fujitani K,Hirao M,et al. Significance of surgical treatment of liver metastases from gastric cancer[J].Anticancer Res,2012,32(2):665 -670.
[4] Bozzetti F,Yu W,Baratti D,et al. Locoregional treatment of peritoneal carcinomatosis from gastric cancer[J]. J Surg Oncol,2008,98:273 -276.
[5] Fidler IJ. Critical determinants of metastasis[J]. Cancer Biology,2002,12:89 -96.
[6] Bhullar JS,Makarawo T,Subhas G,et al. A true orthotopic gastric cancer murine model using electrocoagulation[J]. J Am Coll Surg,2013,217 (1):64 -70.
[7] Ruan J,Song H,Li C,et al. DiR - labeled Embryonic Stem Cells for Targeted Imaging of in vivo Gastric Cancer Cells[J]. Theranostics,2012,2(6):618 -628.
[8] Wiehr S,von Ahsen O,Röse L,et al. Preclinical evaluation of a novel c -Met inhibitor in a gastric cancer xenograft model using small animal PET[J]. Mol Imaging Biol,2013,15(2):203 -211.

