微小核糖核酸-34a对大鼠肥厚心肌组织肌球蛋白重链α基因表达的调控*
杨蕊珂,杨丽红,王淑辉,乔鹏,徐金义,李涵,张强
基础与实验研究
微小核糖核酸-34a对大鼠肥厚心肌组织肌球蛋白重链α基因表达的调控*
杨蕊珂,杨丽红,王淑辉,乔鹏,徐金义,李涵,张强
目的: 探讨微小核糖核酸-34(amiRNA-34a)对左心室肥厚大鼠心肌组织肌球蛋白重链α基因表达的调控及其意义。
心肌肥厚; 微小核糖核酸-34a; 肌球蛋白重链α
(Chinese Circulation Journal, 2014,29:138.)
心肌肥厚是心肌对长期压力超负荷、内分泌激活、能量代谢障碍等刺激因素的代偿表现。肥厚心肌结构功能的改变与肌球蛋白“胚胎化” 密切相关,即肌球蛋白重链α基因表达下调,肌球蛋白重链β基因表达上调,这一过程受多种微小核糖核酸(miRNA)调控[1]。通过miRNA靶基因预测网站,美国国家生物技术信息中心基因序列数据库查找结果显示,肌球蛋白重链α基因表达可能受miRNA-34a调控,本研究通过腹主动脉缩窄术建立左心室肥厚大鼠模型,探讨miRNA-34a对大鼠肥厚心肌组织肌球蛋白重链α基因表达的调控作用,以及对肥厚心肌组织结构及功能的影响。
1 材料与方法
阻遏物及其阴性对照物: miRNA-34a表达阻遏物经锁核酸修饰的可皮下释放的改良寡聚核苷酸(LNA-antimiRNA-34a)[2],miRNA-34a序列打乱后形成的阴性对照物(LNA-contrl-34a), 均购自上海生工生物有限公司。
动物模型建立及分组:2013-02由郑州大学动物实验中心提供健康12周龄雄性SD大鼠40只,体重250~320 g。采用随机数字表法将大鼠分为4组,每组10只。分别为腹主动脉缩窄术后皮下注射miRNA-34a表达阻遏物组(ant-34a/AAC组),腹主动脉缩窄术后皮下注射miRNA-34a表达阻遏物阴性对照物组(con/AAC组),假手术后皮下注射miRNA-34a表达阻遏物组(ant-34a/SH组),假手术后皮下注射miRNA-34a表达阻遏物阴性对照物组(con/SH组)。ant-34a/AAC组和con/AAC组行腹主动脉缩窄术建立左心室肥厚大鼠模型[3]:以10%水合氯醛腹腔注射麻醉后开腹,分离腹主动脉,在右肾动脉上方腹主动脉处用5~0缝线将其与外径为0.6 mm的注射器针头一并扎紧,迅速将针头移去,逐层缝合关腹;ant-34a/SH组和con/SH组穿线不结扎,其他手术处理与前两组相同。4组大鼠术后均给予青霉素5000 U/只,肌肉注射1周,预防感染。各组分笼饲养5周后从第6周开始每周1、3、5,ant-34a/AAC组和ant-34a/SH组分别皮下注射25 mg/kg LNA-antimiR-34a,con/AAC组和con/SH组分别皮下注射25 mg/ kg LNA-contrl-34a,连续注射6周[4]。第12周存活大鼠:ant-34a/AAC组6只,con/AAC组7只,ant-34a/SH组8只,con/SH组8只。
血流动力学参数及心肌肥厚指数测定:大鼠称重后,以10%水合氯醛腹腔注射麻醉,经颈动脉插管至左心室,用PowerLab/4SP型生物信号处理和分析系统记录左心室收缩压,左心室舒张末期压以及压力最大变化速率;检测完毕后,开胸迅速取出心脏,置入冰生理盐水漂洗,滤纸吸干,称取全心重量,取左心室及室间隔称重,并计算心肌肥厚指数:心重指数=全心重量(mg)/体重(g),左心指数=左心室重量(mg)/体重(g)。将左心室心肌组织分为两部分,一部分放入无菌冻存管中并置于液氮罐中,然后转移至-80℃冰箱保存;另一部分放置于4%多聚甲醛溶液中固定24 h后取出,常规石蜡包埋备用。
心肌组织病理学观察:各组大鼠心肌组织蜡块切片,苏木素伊红染色,在光镜(×200)下观察心肌组织形态学变化。
心肌组织miRNA-34a,肌球蛋白重链α基因表达的测定:Trizol法提取总RNA,使用Applied Biosystems 7300型PCR基因扩增仪进行荧光定量逆转录-聚合酶链反应 (qRT-PCR), miRNA-34a、肌球蛋白重链α基因相对表达倍数按2-△△Ct计算。引物序列见表1。

表1 引物序列表
统计学处理:采用SPSS 17.0统计学软件进行数据处理,计量资料以均数±标准差表示。两组计量资料间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
各组血流动力学参数、心肌肥厚指数及qRTPCR结果比较:与con/AAC组相比, ant-34a/AAC组心重指数、左心指数、左心室收缩压、 左心室舒张末期压以及miRNA-34a相对表达量降低,压力最大上升和下降速率、肌球蛋白重链α基因相对表达量明显升高(P均<0.05)。与con/AAC组相比,con/SH组心重指数、左心指数、左心室收缩压、 左心室舒张末期压以及 miRNA-34a相对表达量明显降低,压力最大上升和下降速率、肌球蛋白重链α基因相对表达量明显升高 (P均<0.05)。与con/SH组相比, ant-34a/SH组miRNA-34a相对表达量明显降低,肌球蛋白重链α基因相对表达量明显升高 (P均<0.05),心重指数、左心指数、左心室收缩压、左心室舒张末期压、压力最大变化速率差异无统计学意义(P>0.05)。表2
心肌组织病理学观察:ant-34a/SH组(图1C)和con/SH组(图1D)心肌细胞排列整齐,大小正常,胞浆均匀,胞核染色均匀,胞外基质胶原沉淀少,无炎症细胞浸润;con/AAC组(图1B)大鼠心肌细胞排列紊乱,心肌细胞明显肥大增宽,细胞浆浓染,细胞间距增大,胞外较多胶质沉积。ant-34a/AAC组(图1A)病理学表现介于两个SH组与con/AAC组之间。
表2 各组血流动力学参数、心肌肥厚指数及qRT-PCR 结果比较

表2 各组血流动力学参数、心肌肥厚指数及qRT-PCR 结果比较
注:与con/AAC组比*P<0.05,与con/SH组比△P<0.05。ant-34a/AAC组:腹主动脉缩窄术后皮下注射miR-34a表达阻遏物组;con/AAC组:腹主动脉缩窄术后皮下注射miR-34a表达阻遏物阴性对照物组;ant-34a/SH组:假手术后皮下注射miR-34a表达阻遏物组;con/SH组:假手术后皮下注射miR-34a表达阻遏物阴性对照物组;α-MHC:肌球蛋白重链α;qRT-PCR:荧光定量逆转录-聚合酶链反应。1 mmHg=0.133 kPa。余注见表1
组别 con/AAC组 (n=7) ant-34a/AAC组 (n=6) con/SH组 (n=8) ant-34a/SH组 (n=8)血流动力学参数左心室收缩压(mmHg) 145.93±6.83 138.36±5.73* 130.55±5.73* 128.96±7.45左心室舒张末期压(mmHg) 6.63±0.32 5.67±0.36* 4.41±0.36* 4.49±0.36压力最大上升速率(mmHg/s) 5681.04±92.19 6237.42±37.50* 6734.09±82.78* 6723.09±85.37压力最大下降速率(mmHg/s) 4632.04±138.70 4938.84±105.46* 5221.86±145.11* 5256.45±125.43心肌肥厚指数体重 (g) 406.151±37.673 405.557±38.764 406.415±30.626 405.714±31.454心重指数 (mg/g) 3.453±0.256 3.325±0.263* 3.012±0.124* 3.022±0.241左心指数 (mg/g) 2.531±0.254 2.404±0.341* 2.134±0.213* 2.021±0.102 qRT-PCR结果miRNA-34a相对表达量 1.03±0.26 0.18±0.22* 0.49±0.17* 0.06±0.12△α-MHC基因相对表达量 0.81±0.21 1.13±0.37* 1.61±0.29* 1.74±0.36△
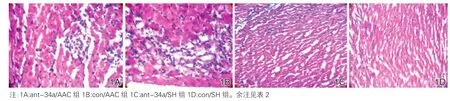
图1 各组大鼠心肌组织病理学表现(×200)
3 讨论
心肌肥厚表现为心肌细胞肥大、细胞外基质胶质沉积和纤维化等一系列病理生理变化。各种因素引起的心肌肥厚,均伴随着肌球蛋白重链胚胎基因的激活和异常表达[5]。
肌球蛋白是心肌重要的收缩蛋白,主要由两条重链和两条轻链构成,哺乳动物心肌肌球蛋白重链由肌球蛋白重链α和β基因编码,其表达产物构成三种二聚体,即α-α同二聚体(V1型)、αβ-异二聚体(V2型)和β-β(V3型)同二聚体,三者的三磷酸腺苷酶活性及收缩活性依次降低。心肌肥厚发生的主要组织学和分子遗传学基础是心肌细胞肌球蛋白重链基因表达向“胚胎型”转变[6],即肌球蛋白重链α基因表达下调伴随着肌球蛋白重链β基因表达上调,二聚体由V1型向V3型转化,肌球蛋白三磷酸腺苷酶活性下降,心肌收缩功能降低。肌球蛋白重链α基因的表达对维持心肌正常的收缩功能起重要作用,近年来,通过靶向调节肌球蛋白重链α基因表达,逆转或减慢心肌肥厚进程成为治疗高血压性心脏病、肥厚性心肌病、心力衰竭等的新热点[7]。
miRNA是一类由内源基因编码的15~22 bp的非编码单链RNA分子,通过结合靶基因mRNA的3'非编码区而对其表达进行转录后表达调控[8]。目前,已经证实miRNA在心肌病理重塑、缺血后损伤修复等病理生理机制中具有重要作用[9-11]。经基因检索发现,哺乳动物肌球蛋白重链α基因为miRNA-34a下游靶基因,Bernardo等[4]研究表明,阻断miRNA-34家族在大鼠肥厚心肌中的表达,可能对心肌重构及功能减退有保护作用,本研究在其基础上通过靶向阻断miRNA-34a在心肌的表达,观察其对肥厚心肌组织肌球蛋白重链α基因表达的调控作用。结果表明miRNA-34a在腹主动脉缩窄术后大鼠肥厚心肌中表达明显上调,伴随肌球蛋白重链α基因表达下降以及心肌收缩舒张功能的减退,通过两组腹主动脉缩窄模型大鼠比较证明通过靶向阻断miRNA-34a表达可上调肌球蛋白重链α基因表达,抑制心肌向“胚胎型”转变,减慢心肌肥厚进程。
心肌肥厚是心血管疾病的独立危险因素,临床流行病学资料显示高血压合并左心室肥厚使心血管疾病发生率明显增加[12]。现有的治疗措施只是延缓而不是阻止和逆转心肌肥厚进程,其最终转归都是不可逆的心脏泵衰竭[13],而β受体阻滞剂、血管紧张素受体拮抗剂、血管紧张素转换酶抑制剂等药物往往存在电解质紊乱、肝肾功能损害、低血压、加重心力衰竭等副作用[14],随着miRNA-34家族在心肌细胞生长[15]、心肌肥厚[16]、病理重构[17]等方面的调节作用,及其在活体容易被阻断的特性被逐渐了解[18],同时随着反义寡核苷酸化学和反义治疗技术的发展通过靶向阻断miRNA-34a表达[19],上调肌球蛋白重链α基因的表达,减缓或者逆转心肌肥厚进程,改善心功能的治疗潜能被看好[18-20]。
由于哺乳动物心室肌肌球蛋白异构体的分布与种属、年龄等因素有关,有待进一步研究明确miRNA-34a在人体内对肌球蛋白重链α基因表达的调控机制,同时还需要大量研究明确反义治疗可能存在的不良靶目标外作用,为进一步应用于临床提供可靠依据。
[1] 刘媛圆, 杨新春, 蔡军, 等. microRNA 在心血管系统中的表达和功能. 国际心血管病杂志, 2010, 37: 101-105.
[2] Stenvang J, Petri A, Lindow M, et al. Inhibition of microRNA function by antimiR oligonucleotides. Silence, 2012, 3: 1.
[3] 胡咏梅, 李法琦, 罗羽慧, 等. 腹主动脉缩窄大鼠模型制作及临床意义. 重庆医科大学学报, 2004, 3: 322-324.
[4] Bernardo BC, Gao XM, Winbanks CE, et al. Therapeutic inhibition of the miR-34 family attenuates pathological cardiac remodeling and improves heart function. Proc Natl Acad Sci USA, 2012, 109: 17615-17620.
[5] Narolska NA, Eiras S, Van Loon RB, et al. Myosin heavy chain composition and the economy of contraction in healthy and diseased human myocardium. J Muscle Res Cell Motil, 2005, 26: 39-48.
[6] 戴文建, 王以光. 心肌肥厚分子机制研究进展. 心血管病学进展, 2009, 1: 47-50.
[7] Lowes BD, Gilbert EM, Abraham WT, et al. Myocardial gene expression in dilated cardiomyopathy treated with β-blocking agents. N Engl J Med, 2002, 346: 1357-1365.
[8] 陆永光. 微小核糖核酸与冠心病关系的研究进展. 中国循环杂志, 2010, 25: 484-486.
[9] 郭威早, 李琳. 冠心病候选基因β2肾上腺素能受体基因相关微小核糖核酸let-7i的实验研究. 中国循环杂志, 2013, 28: 63-66.
[10] Small EM, Olson EN. Pervasive roles of microRNAs in cardiovascular biology. Nature, 2011, 469: 336-342.
[11] Bernardo BC, Charchar FJ, Lin RCY, et al. A microRNA guide for clinicians and basic scientists: Background and experimental techniques. Heart Lung Circ, 2012, 21: 131-142.
[12] 何疆春, 李田昌. 心血管疾病风险评估的现状与展望. 心血管病学进展, 2013, 1: 50-55.
[13] Cubbon RM, Gale CP, Kearney LC, et al. Changing characteristics and mode of death associated with chronic heart failure caused by left ventricular systolic dysfunction: a study across therapeutic eras. Circ Heart Fail, 2011, 4: 396-403.
[14] McMurray JJV. Systolic heart failure. N Engl J Med, 2010, 362: 228-238. [15] Cheng Y, Ji R, Yue J, et al. MicroRNAs are aberrantly expressed in hypertrophic heart: do they play a role in cardiac hypertrophy?. Am J Pathol, 2007, 170: 1831-1840.
[16] Divakaran V, Mann DL. The emerging role of microRNAs in cardiac remodeling and heart failure. Circ Res, 2008, 103: 1072-1083.
[17] Sayed D, Hong C, Chen IY, et al. MicroRNAs play an essential role in the development of cardiac hypertrophy. Circ Res, 2007, 100: 416-424.
[18] Van Rooij E, Purcell AL, Levin AA. Developing microRNA therapeutics. Circ Res, 2012, 110: 496-507.
[19] 尚明美, 刘秀文, 汤仲明, 等. 反义寡核苷酸的药代动力学研究进展. 国外医学 (药学分册), 2004, 4: 240-245.
[20] Van Rooij E, Purcell AL, Levin AA. Developing microRNA therapeutics. Circ Res, 2012, 110: 496-507.
Regulation of MicroRNA-34a on Myosin Heavy Chain-α Expression in Rats With Left Ventricular Hypertrophic Tissue
YANG Rui-ke, YANG Li-hong, WANG Shu-hui, QIAO Peng, XU Jin-yi, LI Han, ZHANG Qiang.
Department of Cardiology, the Second Aff i liated Hospital of Zhengzhou University, Zhengzhou (450014), Henan, China Corresponding Author: ZHANG Qiang, Email: zq3397@163.com
Objective: To explore the regulation effect of microRNA-34a (miR-34a) on myosin heavy chain α (α-MHC) expression in rats of left ventricular hypertrophic tissue with overloaded pressure.Methods: The cardiac hypertrophy rats’ model was established by abdominal aortic constriction (AAC), and 40 SD rats were randomly divided into 4 groups. ①AAC rats with LNA-anti-miR-34a (ant-34a/AAC) group, ②AAC rats with LNA-control-34a (con/AAC) group, and ③sham operation rats with LNA-anti-miR-34a (ant-34a/SH) group, ④con/ SH group. n=10 in each group. With 12 weeks treatment, the surviving conditions were as 6 in ant-34a/AAC group, 7 in con/AAC group, and 8 in ant-34a/SH group, 8 in con/SH group. The left ventricular systolic pressure (LVSP), left ventricular eud distolic pressure (LVEDP), the maximum changing rate of pressure (±LVdp/dt)max, heart weight index (HM/ BM) and cardiac index (LVM/BM) were calculated, the pathological changes of myocardial tissue was observed and the expressions of miR-34a and α-MHC in the left ventricular tissue were analyzed.Results: Compared with con/AAC group, the ant-34a/AAC group had decreased HM/BM, LVSP, LVEDP and miR-34a expression, increased (±LVdp/dt)max and α-MHC expression, all P<0.05. Compared with con/AAC group, the con/SH group showed decreased HM/BM, LVSP, LVEDP and miR-34a expression, increased (±LVdp/dt)max and α-MHC expression, all P<0.05. Compared with con/SH group, the ant-34a/SH group presented decreased miR-34a expression and increased α-MHC expression, both P<0.05; the HM/BM, LVSP, LVEDP and (±LVdp/dt)max were similar, all P>0.05.Conclusion: The rats of left ventricular hypertrophy with overloaded pressure had increased miR-34a and decreased α-MHC, LNA-anti-miR-34a could elevate α-MHC expression and therefore, reduce or delay the myocardial hypertrophy and improve the cardiac function.
Ventricular hypertrophic; MicroRNA-34a; Myosin heavy chain-α
2013-08-22)
(编辑:王宝茹)
河南省科技厅科研基金(72102310023)
450014 河南省郑州市,郑州大学第二附属医院 心内科(杨蕊珂、王淑辉、张强),心电图科(杨丽红);郑州大学基础医学院生理教研室(乔鹏); 河南省人民医院(徐金义、李涵)
杨蕊珂 硕士研究生 主要从事高血压相关临床与基础研究 Email: qiaoyangguo@163.com 通讯作者:张强Email: zq3397@163.com
R54
A
1000-3614(2014)02-0138-04
10.3969/j.issn.1000-3614.2014.02.015
方法: 将40只雄性SD大鼠随机分为4组(n=10),分别为腹主动脉缩窄术后皮下注射miRNA-34a表达阻遏物组(ant-34a/AAC组),腹主动脉缩窄术后皮下注射miRNA-34a表达阻遏物阴性对照物组(con/AAC组),假手术后皮下注射miRNA-34a表达阻遏物组(ant-34a/SH组), 假手术后皮下注射miRNA-34a表达阻遏物阴性对照物组(con/SH组)。模型建立第12周存活大鼠:ant-34a/AAC组6只,con/AAC组7只,ant-34a/SH组8只,con/SH组8只。测定各组大鼠左心室收缩压、左心室舒张末期压及压力最大变化速率,计算心肌肥厚指数,观察心肌组织病理学改变,应用荧光定量逆转录-聚合酶链反应( qRT-PCR)检测大鼠左心室心肌组织miRNA-34a、肌球蛋白重链α基因表达水平。
结果:与con/AAC组相比, ant-34a/AAC组心肌肥厚指数、左心室收缩压、 左心室舒张末期压以及miRNA-34a相对表达量降低,压力最大变化速率、肌球蛋白重链α基因相对表达量明显升高(P均<0.05)。与con/AAC组相比,con/SH组心肌肥厚指数、左心室收缩压、 左心室舒张末期压以及 miRNA-34a相对表达量明显降低,压力最大变化速率、肌球蛋白重链α基因相对表达量明显升高( P均<0.05)。与con/SH组相比,ant-34a/SH组miRNA-34a相对表达量明显降低,肌球蛋白重链α基因相对表达量明显升高( P均<0.05),心肌肥厚指数、左心室收缩压、 左心室舒张末期压、压力最大变化速率差异无统计学意义(P>0.05)。
结论:压力负荷性左心室肥厚大鼠心肌组织中 miRNA-34a表达上调,肌球蛋白重链α基因表达减少,利用特异性阻遏物阻断 miRNA-34a表达可使大鼠肥厚心肌组织肌球蛋白重链α基因表达水平增高,减轻或者延缓心肌肥厚、提高心肌顺应性、改善心功能。

