藏羊AMPK、ACC和GS酶活分布及饥饿应激对其酶活的影响
商振达,李长忠,毛学荣
(青海大学,西宁 810016)
繁殖与生理
藏羊AMPK、ACC和GS酶活分布及饥饿应激对其酶活的影响
商振达,李长忠,毛学荣
(青海大学,西宁 810016)
为分析AMPK等酶对机体代谢的影响,采用酶联免疫分析法(ELISA),分别测定正常饲养和饥饿48 h后藏羊各组织的AMPK、ACC和GS的活性。结果表明:AMPK、ACC和GS分布于藏系绵羊各组织中,且各组织器官中3种酶活性差异显著(P<0.05);饥饿应激导致骨骼肌、肝脏、肾脏和小肠组织中AMPK活性升高,骨骼肌、肝脏、脾脏、肺脏、肾脏和小肠组织中ACC活性下降,骨骼肌、肝脏、脾脏、肺脏、肾脏和小肠组织中GS活性下降。因此,AMPK、ACC和GS在藏系绵羊的各组织器官中分布广泛;饥饿应激可能通过激活AMPK表达,下调ACC和GS表达而调节藏羊的应激代谢。
藏系绵羊;AMPK;ACC;GS;饥饿应激
藏羊在我国青藏高原及与其毗邻的川、滇、甘等高寒地区均有分布,是经过长期自然和人工选择形成的品种。由于生活环境的复杂性,藏系绵羊形成了体格大、体质结实、抗病力强、适应性好等的特点[1]。此外,藏羊肉具有高蛋白、高能量、低胆固醇的特点[2]。
一磷酸腺苷活化蛋白激酶(AMPK)是一种AMP激活蛋白激酶[3],是由α、β和γ亚基组成的异源三聚体酶[4-5],在动物应激过程中起重要作用[6]。乙酰辅酶A(ACC)属于生物素包含酶类型Ⅰ,催化脂肪酸的代谢途径中乙酰辅酶A生成丙二酸辅酶A这一关键步骤[7-9]。糖原合成酶(GS)是糖原合成关键酶,有磷酸化的非活性型糖原合成酶D和脱磷酸形成的活性型糖原合成酶两种形式[10]。AMPK、ACC以及GS间存在密切联系。AMPK可以通过磷酸化GS的Ser7和磷酸化ACC,使GS和ACC失活,从而抑制糖原和脂肪酸合成,降低ATP消耗,促进ATP生成[11-12]。因此,分析藏系绵羊体内AMPK、ACC和GS三种酶的酶活分布以及饥饿应激对宰AMPK、ACC和GS活性的影响,可为探讨AMPK活性变
化对ACC、GS活性的影响,从而为分析AMPK对机体代谢的机理提供理论基础。
1 材料与方法
1.1 材料
1.1.1 动物 从青海省刚察县一屠宰场选取营养状况相同的6只藏羊,分成两组,即正常饲养和饥饿48 h的试验组,每组各3只。
1.1.2 样品采集与处理
1.1.2.1 组织的采集与处理 将藏羊屠宰后迅速取其骨骼肌、心肌、肝脏、脾脏、肺脏、肾脏和小肠组织,液氮保存(-180℃),以制备组织匀浆,提取酶液用。
1.1.2.2 组织匀浆的制备和酶液提取 参照Underwood等(2008)的方法,取冷冻的各组织器官,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称取0.1~0.5 g磨碎,放入预冷的离心管中,加入0.5~2.5 mL冰的匀浆液匀浆(整个过程需要在冰浴中进行),然后在13 000 g、4℃下离心5 min,得到上清液置于-80℃冰箱中保存,用于AMPK、ACC和GS活性的测定。
匀浆液成分为:甘露醇0.25mol/L,Tris/HCl 0.05mol/L,EDTA 1 mmol/L,EGTA 1 mmol/L,DTT 1 mmol/L,NaF 50 mmol/L,焦磷酸钠5 mmol/L。
1.2 方法
1.2.1 AMPK活性测定 使用美国rapidbio公司生产的绵羊磷酸化腺苷酸活化蛋白激酶(AMPK)酶联免疫分析试剂盒进行测定。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中绵羊磷酸化腺苷酸活化蛋白激酶浓度。
1.2.2 ACC和GS活性测定方法 分别使用美国rapidbio公司生产的绵羊乙酰辅酶A羧化酶(ACC)酶联免疫分析试剂盒和绵羊糖原合成酶(GS)酶联免疫分析试剂盒进行测定。
1.2.3 数据处理 所有结果均以平均值±标准差表示。在进行正常藏羊各组织分析时,采用SPSS 17.0进行单因素方差分析,用Duncan氏法进行多重比较(P=0.05)。
2 结果与分析
2.1 正常生理条件下藏羊体内3种酶活分布
2.1.1 AMPK酶活 从表1可以看出,肺脏中AMPK活性最高,肾脏、脾脏和骨骼肌中AMPK活性较高,而心肌和小肠中的AMPK活性较低,肝脏中AMPK活性最低。各组织器官中AMPK活性总体差异显著(P<0.05)。
2.1.2 ACC酶活 从表1可见,肾脏和小肠中ACC活性最高,脾脏和肝脏中ACC活性较高,而骨骼肌和肺脏中ACC活性较低,心肌中ACC活性最低。各组织器官中ACC活性总体差异显著(P<0.05)。
2.1.3 GS酶活 从表1可见,肝脏和肾脏中GS活性最高,脾脏、骨骼肌和小肠中GS活性较高,而心肌中的GS活性较低,肺脏中GS活性最低。各组织器官中GS活性总体差异显著(P<0.05)。
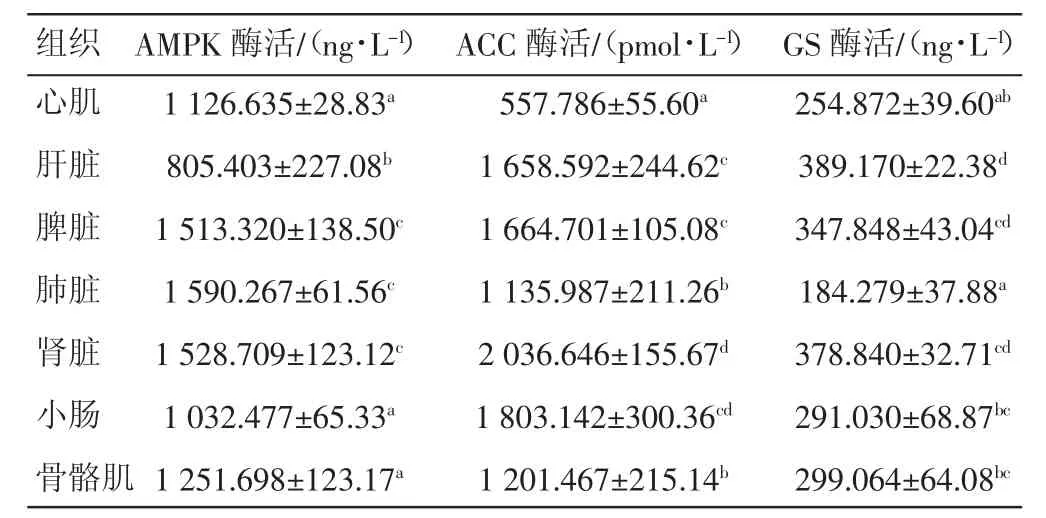
表1 藏羊体内3种酶活分布
2.2 饥饿应激对藏羊各组织器官3种酶活的影响
2.2.1 AMPK酶活 由表2、表3可知,饥饿应激对藏系绵羊各组织器官AMPK酶活有不同程度的影响。与正常藏羊相应组织器官相比,饥饿应激对藏羊小肠AMPK活性影响最大,酶活升高了45.1%;其次是骨骼肌和肾脏,分别升高了23.4%和21.1%;对肝脏活性影响较小,只升高了14.3%;对心肌和脾脏AMPK活性无影响。而肺脏AMPK活性则下降。
2.2.2 ACC酶活 从表2、表3可见,与正常饲养藏羊相比,饥饿应激使藏羊肺脏ACC活性下降50.9%;其次是肾脏和骨骼肌,分别下降44.2%和43.4%;对小肠和肝脏ACC活性影响较小,分别下降22.5%和20.1%;对脾脏ACC活性影响最小,只下降17.1%;心肌ACC活性反而升高。
2.2.3 GS酶活 从表2、表3可见,肺脏和骨骼肌GS活性变化最大,饥饿应激使其分别下降73.8%和73.4%;其次是肝脏,下降37.6%;小肠和肾脏活性变化较小,分别下降21.9%和20.9%;脾脏GS活性变化最小,只下降10.0%,而心肌GS活性无变化。
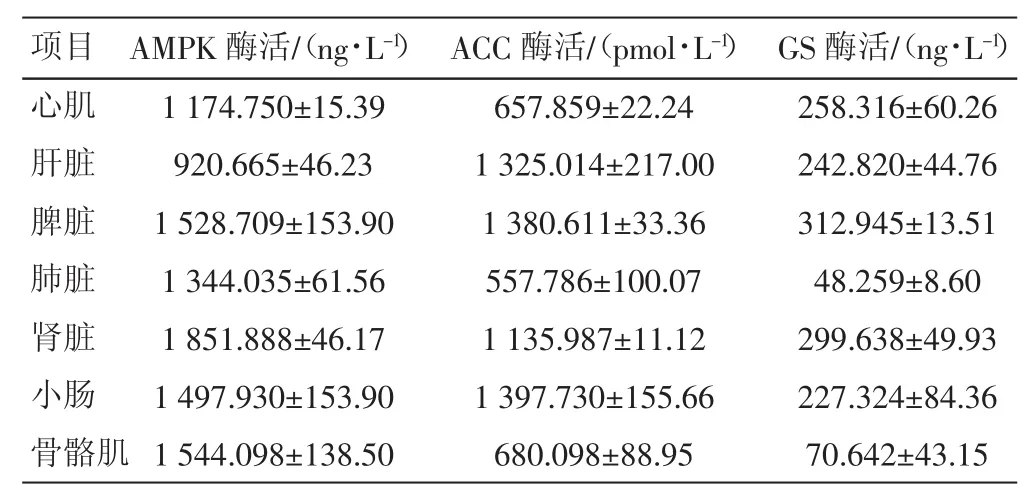
表2 饥饿应激对藏羊各组织器官3种酶活影响
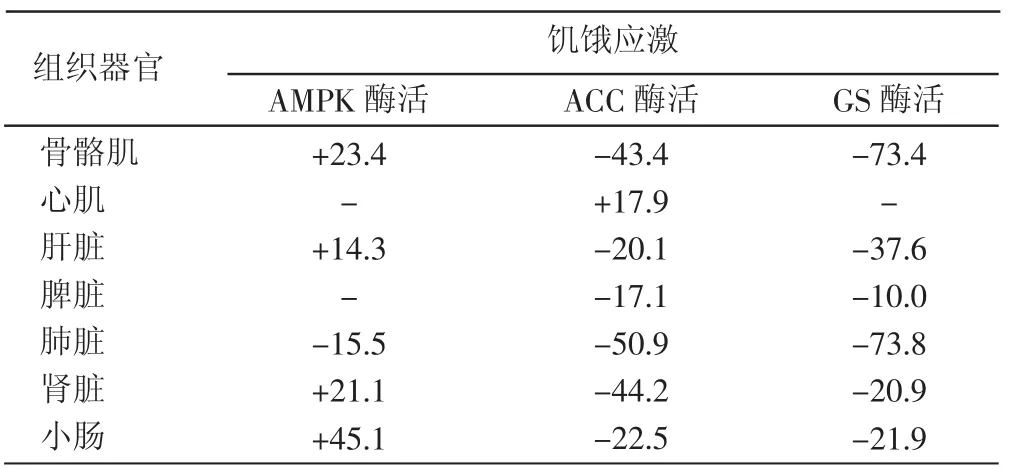
表3 与对照组相比AMPK、ACC和GS活性变化%
2.3 AMPK活性变化对相应组织器官ACC和GS活性的影响
分析结果显示,在骨骼肌、肝脏、肾脏和小肠中,饥饿应激引起AMPK活性变化与ACC和GS活性变化呈负相关。而在心肌、脾脏和肺脏中,3种酶活变化没有相关性。
3 讨论
AMPK、ACC、GS三种酶活是反映机体代谢的主要指标。余冰[13]研究结果表明,仔猪体内骨骼肌AMPK活性最高,肝脏中活性最低。秦玉辉[14]报道,蛋鸡体内骨骼肌和心肌中AMPK活性较高,肝脏中活性最低。本研究对藏羊体内酶活进行了测定,结果与余冰[13]对猪仔和秦玉辉[14]对蛋鸡的研究结果相似。藏羊各组织中肺脏、肾脏和脾脏中AMPK酶活最高,这可能与组织器官功能有关。肺脏呼吸时不停地收缩和舒张,肾脏排泄体内代谢废物,而脾脏过滤和储存血液,这些生理过程中均需要大量能量,导致AMPK不断被活化。饥饿应激使藏羊骨骼肌、肝脏、肾脏和小肠组织中的AMPK活性升高,肺脏AMPK活性下降,而对心肌和脾脏AMPK活性无显著影响,可能是机体适应饥饿的结果。
本研究发现藏羊肾脏ACC酶活最高,脾脏和肝脏ACC酶活较高,而心肌ACC酶活最低,这可能与组织结构和功能有关。肾脏的肾窦含有脂肪组织,脾脏是机体最大的免疫器官,含有大量淋巴细胞,而淋巴细胞具有运输脂肪的功能,而肝脏能将脂肪与磷酸及胆碱结合,转变成磷脂,转运到体内其他部位。饥饿应激使藏羊骨骼肌、肝脏、脾脏、肺脏、肾脏和小肠组织ACC活性下降,而使心肌ACC活性上升,均反映了藏羊对饥饿的适应性反应。
本研究还发现肝脏中GS活性最高,肾脏和脾脏GS活性较高,而肺脏中GS活性最低。这也许与各组织中糖原含量及与糖原合成不同有关。肝脏是机体内储存糖原的主要器官。饥饿应激使藏羊骨骼肌、肝脏、脾脏、肺脏、肾脏和小肠组织GS活性下降,而对心肌组织中GS活性没有显著影响,说明糖代谢对心脏功能的重要性。
综上所述,AMPK、ACC和GS三种酶在藏系绵羊体内广泛存在,饥饿应激使藏系绵羊体内的ATP含量下降,AMP含量升高,而AMP是AMPK的激活剂,因此饥饿应激会激活AMPK,而AMPK可以通过磷酸化作用,使ACC和GS失活,进而抑制糖原和脂肪酸的合成来阻止ATP的消耗。所以,动物可以通过AMPK活性的变化来调节机体的应激代谢。
[1]刘海珍,焦销路,范涛.青海藏羊肉的品质特性研究[J].中国草食动物,2005,25(4):57-58.
[2]王永等.草地藏系绵羊羊肉品质特性研究[J].黑龙江畜牧兽医,2006(10):111-114.
[3]Shen QW,Gerrard DE,Du M.Compound C,an inhibitor of AMP-activated protein kinase,inhibits glycolysis in mouse longissimus dorsi postmortem[J].Meat Science,2008,78:323-330.
[4]HardieDG.AMP-activatedproteinkinase:Akeysystemmediatingmetabolic responses to exercise[J].Medicine and Science in Sports and Exercise,2004,36(1):28-34.
[5]Shen Q W,Means W J,Thompson S A,et al.Pre-slaughter transport,AMP-activatedproteinkinase,glycolysis,andqualityofporkloin[J].Meat Science,2006,74:388-395.
[6]Park S H,Gammon S R,Knippers J D,et al.Phosphorylation-activity relationships ofAMPKand acety-l CoAcarboxylase in muscle[J].J Appl Physiol,2002,92:2475-2482.
[7]Herbert D,Walker K A,Price L J,et al.Acetyl-CoA carboxylase-a graminicide target site[J].Pestic Sci,1997,50:67-71.
[8]韩春春,王继文,魏守海.乙酰辅酶A羧化酶(ACC)的结构与功能[J].安徽农业科学,2006,34(3):413-414,416.
[9]龚莹,彭少丹,王骞.乙酰辅酶A羧化酶的结构·功能及基因的研究进展[J].安徽农业科学,2010,38(35):19893-19896.
[10]Guinovart J J,Salavert A,Massague J,et al.Glycogen synthase:A new activity ratio assay expressing a high sensitivity to the phosphorylation state[J].FEBSLett,1979,106:284-288.
[11]Carling D,Hardie D G.The substrate and sequence specificity of the AMP-activated protein kinase.Phosphorylation ofglycogen synthase and phosphorylase kinase[J].Biochemica et BioPhysics Acta,1989,1012(1):81-86.
[12]Chen ZP,McConell BJ.AMPKsignalingin contractinghuman skeletal muscle:acetyl-CoA carboxylase and NO synthase phosphorylation[J]. AmericanJournalofPhysiology,EndocrinologyandMetabolism,2000,279(5):E1202-1206.
[13]余冰.AMPK对应激状态下仔猪脂质代谢的调节作用[D].雅安:四川农业大学,2003.
[14]秦玉辉.蛋鸡体内AMPK酶活分布及应激对AMPK酶活影响研究[D].雅安:四川农业大学,2003.
Distribution of AMPK,ACC and GS Enzyme Activity and the Fast Effects in the Tibetan Sheep
Shang Zhen-da,Li Chang-zhong,MaoXue-rong
(Qinhai University,Xining 810016,China)
For analyzing the AMPK and other enzymes effect on metabolism,using enzyme-linked immunoassay(ELISA),the AMPK,ACCand GSactivityin everyorgans ofTibetan sheep after normal breedingand fast for 48 h were determined.The results showed that AMPK,ACC and GS distributed in every organs of Tibetan sheep,significant difference was found in three kinds of enzyme activity(P<0.05);fast could increase AMPK activity in the skeletal muscle,liver,kidney and intestine tissues;decrease ACC activity in the skeletal muscle,liver,spleen,lung,kidney and intestine tissues;decrease GS activity in the skeletal muscle, liver,spleen,lung,kidneyand intestine tissues.So,AMPK,ACCand GSdistributed in the organs ofTibetan sheep extensively;fast might activate AMPKexpression and reduce ACCand GSexpression toadjust the stress metabolismofTibetan sheep.
Tibetan sheep;fast;AMPK;ACC;GS
S826.1
A
2095-3887(2014)01-0023-03
10.3969/j.issn.2095-3887.2014.01.006
2013-11-04
国家科技部科技计划项目(2010-GA-870011)
商振达(1988-),男,硕士研究生。
毛学荣(1966-)。Email:mkymxr@163.com

