浓缩鱼油对前列腺细胞生长的影响
沈钰珍,于海宁,张程程,曾思敏,沈生荣,*(.浙江大学,生物系统工程与食品科学学院食品生物科学技术研究所,浙江杭州30058;.浙江工业大学药学院,浙江杭州3004)
浓缩鱼油对前列腺细胞生长的影响
沈钰珍1,于海宁2,张程程1,曾思敏1,沈生荣1,*
(1.浙江大学,生物系统工程与食品科学学院食品生物科学技术研究所,浙江杭州310058;2.浙江工业大学药学院,浙江杭州310014)
探讨了鱼油对前列腺正常细胞(RWPE-1)和前列腺癌细胞(PC-3)生长和代谢的影响。经鱼油处理,MTT法及流式细胞术考察鱼油对以上两细胞生长的影响,气相色谱法分析处理前后脂肪酸组成,酶联免疫法检测细胞炎性因子(TNF-α,IL-6,LXA4)的表达。结果显示,本实验所用浓缩鱼油基本不影响前列腺正常细胞RWPE-1的生长,而50倍稀释鱼油作用48h可使PC-3细胞存活率降至70.34%,凋亡率上升至15.47%±0.64%;鱼油作用后PC-3细胞内γ-亚麻酸、花生四烯酸、EPA和DHA比例明显增加,而在RWPE-1细胞内并无明显增加;RWPE-1细胞的LXA4表达量基本不变,IL-6和TNF-α表达量逐渐上升,而PC-3细胞的LXA4表达量呈明显上升趋势,IL-6、TNF-α的表达量却显著下降。本实验所用浓缩鱼油对RWPE-1和PC-3细胞的生长、代谢具有不同的影响。
鱼油,前列腺癌,细胞凋亡,脂肪酸组成,炎性因子
流行病学调查发现,摄入一定量的鱼油可以降低前列腺癌症的发病率[1]。鱼油中含大量的多不饱和脂肪酸,其中EPA和DHA是深海鱼油的特征脂肪酸。n-3多不饱和脂肪酸在多种疾病的预防及治疗方面得到了广泛的应用[2-3]。研究发现,n-3多不饱和脂肪酸对机体下调炎症细胞因子表达,如IL-l、IL-6、TNF-α,起到免疫调节的作用[4],而且对很多癌症具有预防、治疗作用。近来,越来越多的研究表明n-3多不饱和脂肪酸(DHA、EPA)在肿瘤治疗方面有着重要的作用[5],其中有研究证明n-3和n-6多不饱和脂肪酸有降低前列腺癌风险的作用[6-7]。同时,有关实验证实,n-3多不饱和脂肪酸(如DHA、EPA)可以抑制前列腺癌细胞增殖并联合化疗药物达到化疗增敏的作用[8]。细胞内脂肪酸比例变化会影响细胞的生存状态,膳食或细胞中n-6/n-3的比值发生变化将会影响细胞生存,并引起很多细胞功能发生变化[9]。鱼油中存在天然配比的n-3,n-6多不饱和脂肪酸,在降低癌症及心血管疾病方面有着独特的优势。Saw等研究证明鱼油对高脂饮食下的前列腺癌小鼠有一定的保护作用[10]。
研究表明,n-3和n-6多不饱和脂肪酸对前列腺癌症有预防、治疗作用[11-12],但其在正常细胞和癌细胞中的代谢差异研究并不多。本文选取市售浓缩鱼油研究其对前列腺正常细胞(RWPE-1)和前列腺癌细胞(PC-3)的生长、代谢的影响,希望通过本研究能更好地阐释鱼油在防治前列腺癌症方面的作用。
1 材料与方法
1.1 材料与仪器
前列腺癌细胞株PC-3、前列腺上皮正常细胞RWPE-1 中科院细胞生物所;MTT Sigma公司;RPMI 1640培养基、胎牛血清、双抗 Gibco公司;SOD、CAT、GSH-Px、MDA试剂盒和蛋白测定试剂盒 南京建成生物工程研究所;TNF-α、IL-6酶联免疫试剂盒 武汉博士德生物工程有限公司;LXA4酶联免疫试剂盒 上海源叶生物科技有限公司;正己烷 国产色谱纯;浓缩鱼油软胶囊。
W201型恒温水浴锅 上海申顺生物科技有限公司;LDIX-40BI型立式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂;L500型低速离心机 湖南湘仪实验室仪器开发有限公司;二氧化碳培养箱SheLLba MSA公司;MD29SpectraMax190型酶标仪
芬兰;7890-A型安捷伦气相色谱 安捷伦公司;FC500MCL型流式细胞仪 美国Beckman Coulter。
1.2 气相色谱法测定鱼油中脂肪酸的组成[13]
取1mL鱼油置于具塞玻璃试管内,快速加入5%盐酸甲醇(w/v)3mL,密封后立即放入100℃恒温箱甲酯化3h,取出冷却至室温,加入等体积高纯水,用3mL正己烷分3次萃取,将正己烷相合并后加入等体积高纯水洗涤,回收正己烷相,过滤后用氮气吹干,用正己烷定容至1mL,取1μL进样,分流比为1∶10。气相色谱条件:进样口温度250℃,检测器温度260℃,色谱柱为DB-23(0.25mm,60m,安捷伦,美国),程序升温条件:130℃保留1min,6.5℃/min升至170℃,然后2.75℃/min升至225℃并保留10min。用动物源脂肪酸甲酯混标(FAME Mix,Supelco)进行脂肪酸外标法定量。
1.3 MTT法检测鱼油对RWPE-1和PC-3细胞存活率的影响
用无水乙醇溶解鱼油形成10倍稀释液,实验前用细胞培养液稀释鱼油成200、150、100、50倍的鱼油稀释液。RWPE-1和PC-3培养条件:RPMI 1640培养液中加10%胎牛血清和双抗(青霉素和链霉素各100U/mL),37℃,5%CO2。将对数生长期的RWPE-1和PC-3细胞分别以5×104个/mL和1×105个/mL密度接种于96孔板,每组设6个平行,每孔设培养液对照。24h后加入不同稀释倍数的鱼油,无水乙醇为溶剂对照,继续培养。分别于24、48、72h后取出,甩掉孔内培养液,每孔加入20μL MTT(5mg/mL),CO2培养箱内放置4h后,每孔加入150μL DMSO,水平振荡器摇匀直至蓝紫色结晶溶解完全,用酶标仪测定各孔在490nm处的吸光度值。鱼油对照孔与溶剂对照孔的吸光度百分比为细胞存活率,存活率计算公式如下:

1.4 流式细胞术分析鱼油作用下RWPE-1和PC-3细胞凋亡变化
取对数生长期细胞(RWPE-1:5×104个/mL,PC-3:1×105个/mL)接种于6孔板,24h后加入稀释鱼油处理48h。处理完成后,收集细胞并用预冷PBS洗涤细胞两次,Annexin V结合液悬浮细胞,细胞密度约为10个/mL,按1∶80加入Annexin V-FITC染色液,轻轻混匀后于4℃避光染色15min,按1∶40加入PI染色液(50μg/mL),轻轻混匀后于4℃避光染色5min,1h内用流式细胞仪检测。
1.5 鱼油作用下测定RWPE-1和PC-3细胞SOD、CAT及GSH-Px活力和MDA含量
取对数生长期细胞(RWPE-1:5×104个/mL,PC-3:1×105个/mL)接种于6孔板,24h后用稀释鱼油处理48h。收集细胞,PBS洗涤细胞两次,重悬于200μL PBS中,于冰浴中超声破碎细胞,细胞破碎液用于SOD、MDA、CAT及GSH-Px含量测定,测定方法参照试剂盒说明书。蛋白测定参照蛋白测定试剂盒说明书进行。SOD、CAT及GSH-Px活性表示为U/mg protein,MDA含量表示为nmol/mg protein。
1.6 鱼油作用下分析RWPE-1和PC-3细胞内脂肪酸组成[14]
RWPE-1和PC-3细胞分别以5×104个/mL和1×105个/mL密度接种于细胞培养瓶内,24h后用稀释鱼油处理48h,同时做空白对照。鱼油处理后,胰酶消化细胞并离心收集细胞,PBS洗涤细胞两次,将细胞转移到具塞玻璃试管内,甲酯化及萃取方法同1.2,最后用正己烷定容至100μL,取1μL进样,不分流。气相色谱条件与1.2所述一致。
1.7 鱼油作用下测定RWPE-1和PC-3细胞内炎性因子(TNF-α,IL-6,LXA4)的表达[15]
取对数生长期细胞RWPE-1和PC-3接种于6孔板中,密度分别为5×104个/mL和1×105个/mL,24 h后加入稀释鱼油处理48h,收集细胞培养液用于细胞内炎性因子(TNF-α,IL-6,LXA4)的测定,检测前将细胞培养液离心去除死细胞,测定方法参照试剂盒说明书。细胞悬浮液用于蛋白测定,参照试剂盒说明书进行。炎性因子表达量表示为ng/mg protein。本文最终以各处理下炎性因子表达量相对于空白对照组的百分含量表示鱼油处理后炎性因子表达的变化。
1.8 数据统计分析
数据统计分析采用SAS 9.1,绘图采用Excel 2003,数据表示为平均值±SD。
2 结果分析
2.1 鱼油中的脂肪酸组成
鱼油中含有丰富的多不饱和脂肪酸,本文所用鱼油为浓缩鱼油,产品标签上显示每粒重量为1g,其中含EPA 300mg,DHA 200mg。图2为鱼油的气相色谱图,根据气相分析结果发现该鱼油中含有多种脂肪酸,其中EPA占35.08%,DHA占24.46%(如表1所示),与鱼油标签上所示基本一致。从表1可以看出鱼油中含有多种脂肪酸,反亚油酸和亚油酸比例分别高达4.28%和5.49%,γ-亚麻酸、花生酸的含量也分别达到4.83%、4.19%。
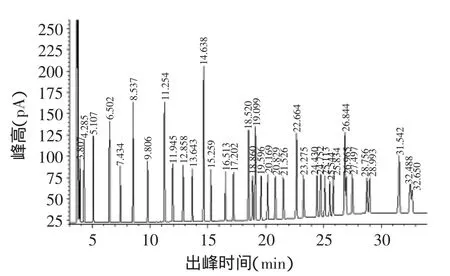
图1 脂肪酸甲酯混标标样GC色谱图Fig.1 GC chromatography of Fatty Acid Methyl Ester Mix

图2 鱼油气相色谱图Fig.2 GC chromatography of fish oil

表1 鱼油中的脂肪酸组成Table 1 Fatty acid compositions of fish oil
2.2 鱼油对RWPE-1和PC-3细胞存活率的影响
如图3所示,随着鱼油浓度(200、150、100、50倍稀释)增加,RWPE-1细胞存活率呈上升趋势,并随培养时间的延长而逐渐升高。而PC-3细胞的存活率随鱼油浓度上升呈下降趋势(图4),且在50倍稀释浓度下存活率有较大幅度的下降,48h时细胞存活率为70.34%,72h时细胞存活率仅为44.02%。由此可以看出,鱼油对RWPE-1细胞基本没有杀伤力,对PC-3细胞有一定的杀伤作用。

图3 鱼油对RWPE-1细胞存活率的影响Fig.3 Effect of fish oil on cell viability of RWPE-1 cells

图4 鱼油对PC-3细胞存活率的影响Fig.4 Effect of fish oil on cell viability of PC-3 cells
2.3 鱼油对RWPE-1和PC-3细胞凋亡的影响
通过流式细胞仪可将正常细胞、早期凋亡细胞、晚期凋亡细胞和死细胞区分开来。从表2中可以看到,RWPE-1和PC-3在未经鱼油处理时(CK组)表现出良好的生长状态,死细胞、早期凋亡细胞、晚期凋亡细胞的比例几乎为零。鱼油作用下,RWPE-1和PC-3都发生了一定程度的凋亡,且PC-3的凋亡、死亡情况较RWPE-1严重。100倍稀释鱼油作用下,RWPE-1早凋和晚凋的细胞分别占5.77%±0.25%、1.84%±0.15%,而PC-3中对应比例为6.76%±0.34%和5.32%±0.22%;50倍稀释鱼油作用下,检测到6.07%± 0.19%和2.84%±0.18%的RWPE-1分别发生了早凋、晚凋现象,而在PC-3中对应比例分别达到8.68%± 0.31%和6.79%±0.33%。与RWPE-1相比,鱼油对PC-3的凋亡影响更大。
2.4 鱼油对RWPE-1和PC-3细胞SOD、CAT及GSH-Px活力和MDA含量的影响
从图5~图8可以看出,经100、50倍稀释鱼油作用48h后,RWPE-1内SOD和GSH-Px的活力基本维持在一个水平;而PC-3内SOD活力明显下降,GSH-Px活力却有较大幅度的上升,特别是在50倍稀释鱼油作用下(图5和图8)。与此同时,经鱼油处理后,RWPE-1内的MDA含量有所上升,但相对PC-3还是处于一个较低的水平(图6);图7显示鱼油作用下RWPE-1和PC-3的CAT活力有很大幅度的下降。表明鱼油对RWPE-1和PC-3的抗氧化系统均有一定程度的损伤。

表2 鱼油处理后RWPE-1和PC-3细胞凋亡中B1、B2、B3、B4区所占比例变化Table 2 Percentage changes of B1,B2,B3,B4 area in apoptosis of RWPE-1 and PC-3 cells treated with fish oil
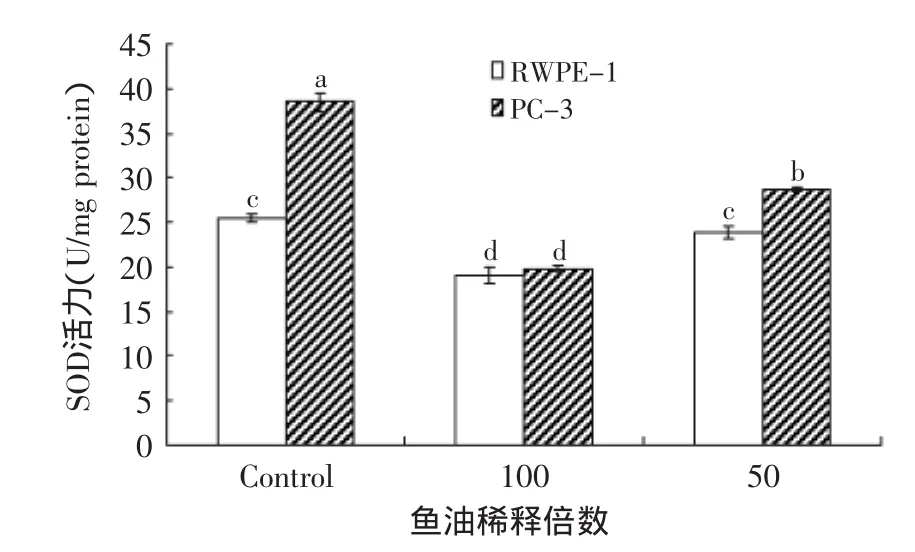
图5 鱼油对RWPE-1和PC-3细胞SOD活力的影响Fig.5 Effect of fish oil on SOD activity of RWPE-1 and PC-3 cells

图6 鱼油对RWPE-1和PC-3细胞MDA含量的影响Fig.6 Effect of fish oil on MDA contents in RWPE-1 and PC-3 cells
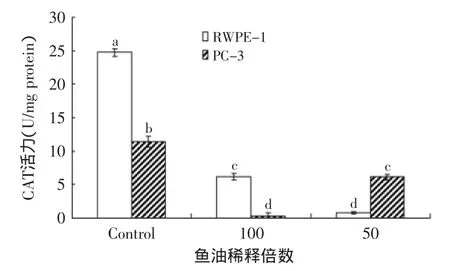
图7 鱼油对RWPE-1和PC-3细胞CAT活力的影响Fig.7 Effect of fish oil on CAT activity of RWPE-1 and PC-3 cells

图8 鱼油对RWPE-1和PC-3细胞GSH-Px活力的影响Fig.8 Effect of fish oil on GSH-Px activity of RWPE-1 and PC-3 cells
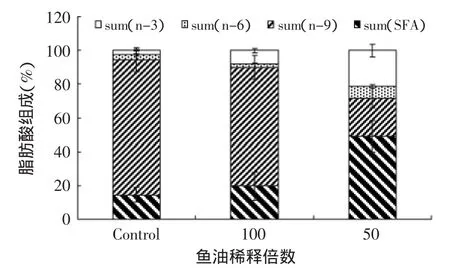
图9 鱼油对PC-3细胞内饱和脂肪酸、n-9、n-6、n-3多不饱和脂肪酸比例变化的影响Fig.9 Effect of fish oil on proportion changes of saturated fatty acids,n-9,n-6,n-3 PUFAs in PC-3 cells
2.5 鱼油作用下RWPE-1和PC-3细胞内脂肪酸组成变化
从图9、图10和表3、表4可以看出,RWPE-1和PC-3细胞内的脂肪酸组成存在显著差异。与PC-3相比,RWPE-1内棕榈烯酸(1.22%±0.15%)、γ-亚麻酸(7.24%±0.67%)、花生四烯酸(1.64%±0.21%)含量明显较高。鱼油作用后,RWPE-1和PC-3内饱和脂肪酸的比例均呈上升趋势,50倍稀释鱼油处理下其比例均接近50%。从图9可以看出,随着鱼油浓度的上升,PC-3内n-9 PUFAs的比例逐渐下降,对照组、100倍鱼油处理组、50倍鱼油处理组分别为80.07%±7.00%、70.22%±11.02%、22.77%±6.01%,n-3 PUFAs的比例从对照组的2.72%±0.51%上升至50倍稀释鱼油组的21.45%±9.91%。而RWPE-1内n-9和n-3 PUFAs的比例没有发生显著变化,但n-6 PUFAs的比例却从对照组的11.81%±0.41%下降到100倍鱼油稀释组的3.07% ±1.01%和50倍稀释组的2.88%±0.047%。

图10 鱼油对RWPE-1细胞内饱和脂肪酸、n-9、n-6、n-3多不饱和脂肪酸比例变化的影响Fig.10 Effect of fish oil on proportion changes of saturated fatty acids,n-9,n-6,n-3 PUFAs in RWPE-1 cells

表3 PC-3细胞内主要脂肪酸比例变化Table 3 Proportion changes of major fatty acids in PC-3 cells
鱼油作用后,PC-3内γ-亚麻酸(从0.58%±0.01%上升到0.60%±0.08%、2.68%±0.17%)、花生四烯酸(从0.88%±0.02%上升至1.47%±0.17%、4.15%±0.57%)、EPA(从1.05%±0.09%上升至2.76%±0.47%、10.50%± 0.89%)、DHA(从N.D上升至5.18%±0.34%、16.16%± 1.03%)比例均明显增加(表3),说明鱼油进入PC-3细胞后可代谢成不同种类的脂肪酸。相同浓度的鱼油作用下,RWPE-1内γ-亚麻酸、花生四烯酸、EPA和DHA比例的增加并不明显(表4),而这四种脂肪酸的比例在PC-3内却将显著升高。
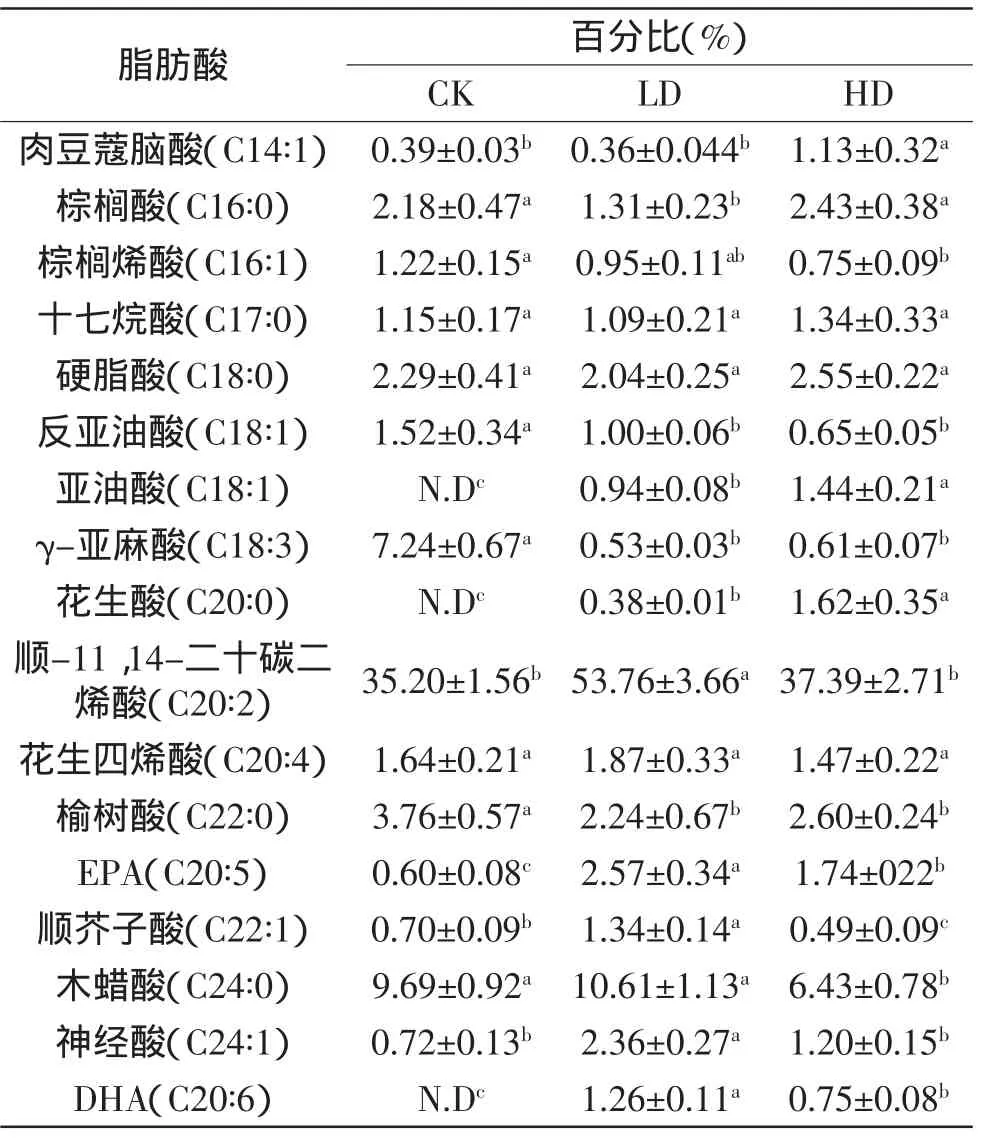
表4 RWPE-1细胞内主要脂肪酸比例变化Table 4 Proportion changes of major fatty acids in RWPE-1 cells
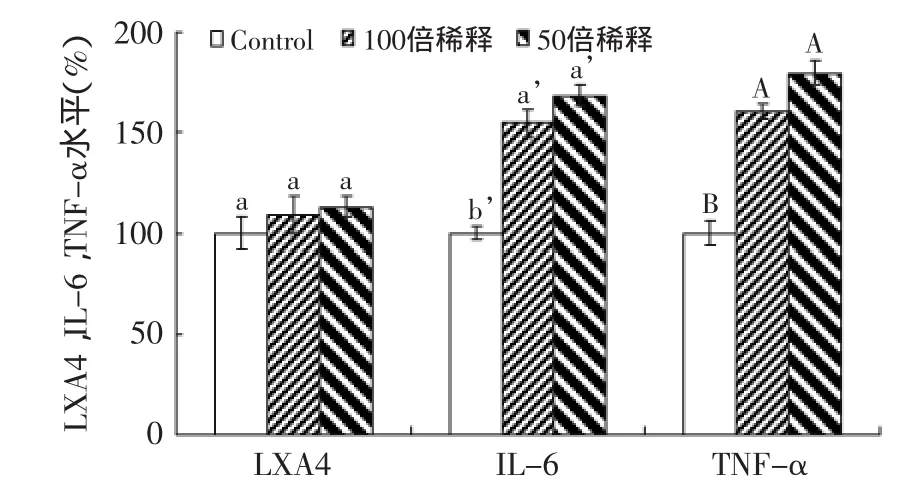
图11 鱼油对RWPE-1细胞炎性因子(LXA4,IL-6和TNF-α)表达的影响Fig.11 Effect of fish oil on contents of inflammatory factors(LXA4,IL-6 and TNF-α)in RWPE-1 cells
2.6 鱼油对RWPE-1和PC-3细胞内炎性因子(TNF-α,IL-6,LXA4)表达的影响
脂肪酸是细胞代谢过程中的重要参与者。细胞内的脂肪酸代谢存在多种途径,随之产生不同类型的代谢产物,促进或抑制细胞内的炎症反应。TNF-α,IL-6,LXA4都是细胞内重要、典型的炎性因子。从图11可以看出,经鱼油作用后,RWPE-1的LXA4表达量基本在同一个水平,而随着鱼油浓度的增加,IL-6和TNF-α表达量都逐渐上升。图12显示,PC-3的LXA4表达量随鱼油浓度的增加表现出明显的上升趋势,而IL-6、TNF-α的表达量却显著下降。表明RWPE-1和PC-3经鱼油作用后炎性因子(TNF-α,IL-6,LXA4)的表达水平存在很大的差异。

图12 鱼油对PC-3细胞炎性因子(LXA4,IL-6和TNF-α)表达的影响Fig.12 Effect of fish oil on contents of inflammatory factors(LXA4,IL-6 and TNF-α)in PC-3 cells
3 讨论
流行病学研究表明饮食中脂肪酸的摄入是前列腺癌发生发展的一个重要诱因。Paul Terry等通过对6272位男性的鱼摄入情况进行30年的跟踪调查,发现摄入鱼少的男性其前列腺癌发病率是其他人的2~ 3倍,说明饮食中摄入一定量的鱼有助于降低患前列腺癌症的风险[16]。菜油中多含n-6多不饱和脂肪酸,而鱼油中含有丰富的n-3多不饱和脂肪酸,特别是EPA和DHA,Sangita Manna等研究发现鱼油可抑制乳腺癌细胞的增值,保护DNA免受损伤,以及抑制HER-2/neu和c-Myc蛋白的表达[17]。很多研究结果显示鱼油在防治癌症方面有一定的作用,但至今为止,有关鱼油和多不饱和脂肪酸影响前列腺癌发生发展的复杂机理还不清楚。n-6 PUFAs和n-3 PUFAs是两类主要的多不饱和脂肪酸,但不能在哺乳动物体内重新合成,哺乳动物必须从饮食中摄入这些脂肪酸,并在体内进行相应的代谢转化。本文主要研究浓缩鱼油(EPA∶DHA=3∶2)在前列腺癌细胞PC-3及其对应的正常细胞RWPE-1中的代谢问题,尤其是脂类代谢相关的炎性因子的表达。气相色谱结果显示本文所用的浓缩鱼油中EPA和DHA的含量较高,EPA占35.08%,DHA占24.46%,其中还有很多其他种类的脂肪酸,但含量普遍较低。实验结果表明鱼油对RWPE-1细胞基本没有杀伤作用,反而促进RWPE-1细胞生长;低浓度的鱼油对PC-3的杀伤力也不大,但50倍稀释浓度下对PC-3细胞有较大的杀伤作用。而且在相同处理下PC-3的凋亡率远高于RWPE-1,RWPE-1活细胞的比例均在90%以上,这与MTT法的结果相符合。通过SOD、MDA、CAT、GSH-Px四种抗氧化指标的测定也表明鱼油对PC-3抗氧化系统的损伤大于RWPE-1。综上所述,鱼油对PC-3生存状态和细胞功能的损伤较RWPE-1大。
脂肪酸是细胞生命活动中重要的能量物质,脂肪酸在细胞内的代谢活动可以直接影响细胞的生存状态。脂肪酸进入细胞后可通过去除饱和酶、环氧化酶、脂氧合酶等转化成其他脂肪酸,研究已证明癌细胞与正常细胞在代谢上存在差异。因此,我们利用气相色谱法分析了鱼油作用PC-3和RWPE-1后细胞内的脂肪酸组成,结果发现两种细胞内的脂肪酸组成均发生了变化,包括饱和脂肪酸、n-9 PUFAs、n-6 PUFAs、n-3 PUFAs的比例以及细胞内不同种类脂肪酸的含量,且RWPE-1和PC-3内的脂肪酸组成存在很大的差异,相同浓度鱼油作用后两种细胞内脂肪酸比例增加的幅度也存在很大的差异。分析细胞内γ-亚麻酸、花生四烯酸、EPA和DHA组成发现鱼油作用下PC-3内这四种多不饱和脂肪酸的比例大幅上升,而在RWPE-1内却没有明显增加。分析两种细胞内饱和脂肪酸、n-9、n-6、n-3 PUFAs总比例的变化,发现鱼油作用下PC-3内n-3 PUFAs的比例明显上升,而RWPE-1内这一比例反而有所下降,说明PC-3和RWPE-1内的脂肪酸合成途径存在很大差异,PC-3在利用鱼油中的脂肪酸方面较RWPE-1更具优势,特别是n-3 PUFAs(EPA和DHA)。因为鱼油中含有大量的EPA和DHA,鱼油作用后PC-3内EPA和DHA的比例显著上升。
同样,作为脂肪酸代谢中的重要产物,炎性因子(TNF-α,IL-6,LXA4)表达量的变化也能有力地反映鱼油对RWPE-1和PC-3代谢的影响[18]。鱼油中高含量的EPA和DHA是脂氧素的重要前体物质,可提高细胞内的脂氧素含量,从而表现出很强的抗炎作用。在众多类型的脂氧素中,LXA4已被证实具有较强的抗炎活性。本研究中,我们发现鱼油处理后RWPE-1的LXA4含量的上升幅度并不大,而在PC-3中却显著上升。有研究发现在癌症发生过程中IL-6表达量会明显上升[19],IL-6是一种自分泌或旁分泌的多效性细胞因子,在前列腺正常上皮细胞和前列腺癌细胞中都有明显的表达。我们研究发现鱼油可使PC-3的IL-6、TNF-α表达量显著下降,而在RWPE-1中却表现出相反的结果。有研究发现TNF-α处理后,前列腺癌细胞的转移和迁移能力增强,这是因为TNF-α可以刺激选择性糖基和巯基转移酶基因的表达,从而增加选择素配体的形成。因此TNF-α表达量的增加是癌症发展进程加快的标志,本研究发现鱼油作用后PC-3细胞对TNF-α的表达显著下降,说明鱼油对前列腺癌细胞有一定抑制效果。
4 结论
鱼油在PC-3和RWPE-1细胞内的代谢存在很多差异,可能是炎性因子表达上的差异、脂肪酸重新合成的路径不同,或者前列腺癌细胞PC-3能更有效地利用鱼油中的脂肪酸进行代谢转化。本研究对前列腺癌细胞和前列腺正常细胞内的脂类代谢机制提供了新的见解,为鱼油用于防治前列腺癌提供了一定的理论基础。但对于鱼油及其他脂肪酸在前列腺癌细胞和正常细胞内的动态代谢过程有待进一步探讨。
[1]刘国栋,刘晓,马宝良,等.饮食防治前列腺癌[J].现代泌尿外科杂志,2011,16(4):287-289.
[2]郭楠楠,李珊珊,于长海,等.ω-3鱼油脂肪乳对食管癌患者术后炎性反应的影响[J].胃肠病学和肝病学杂志,2012,21(10):930-932.
[3]李殿鑫,陈银基,周光宏,等.n-3多不饱和脂肪酸分类、来源与疾病防治功能[J].中国食物与营养,2006(6):52-54.
[4]王新颖,黎介寿.ω-3多不饱和脂肪酸影响炎症和免疫功能的基础研究[J].肠外与肠内营养,2007,14(1):54-58.
[5]Chen Y Q,Edwards I J,Kridel S J,et al.Dietary fat-gene interactions in cancer[J].Cancer Metastasis Reviews,2007,6(3-4):535-551.
[6]Leitzmann M F,Stampfer M J,Michaud D S,et al.Dietary intake of n-3 and n-6 fatty acids and the risk of prostate cancer [J].The American Journal of Clinical Nutrition,2004,80:204-216.
[7]易龙,张乾勇,糜漫天,等.ω-3多不饱和脂肪酸抑制人前列腺癌细胞黏附和侵袭的体外实验研究[J].第三军医大学学报,2007,29(5):396-398.
[8]Istfan N W,Person K S,Holick M F,et al.1 alpha,25-dihydroxyvitamin D and fish oil synergistically inhibit G(1)/S-phase transition in prostate cancer cells[J].Jouranal of Steroid Biochemistry and Molecular Biology,2007,103(3-5):726-730.
[9]Aronson W J,Glaspy J A,Reddy S T,et al.Modulation of omega-3/omega-6 polyunsaturated ratios with dietary fish oils in men with prostate cancer[J].Urology,2001,58(2):283-288.
[10]Saw C L L,Wu T Y,Paredes-Gonzalez X,et al. Pharmacodynamics of Fish Oil:Protective Effects Against Prostate Cancer in TRAMP Mice Fed with a High Fat Western Diet[J]. Asian Pacific Journal of Cancer Prevention,2011,12:3331-3334.
[11]Berquin I M,Min Y N,Wu R P,et al.Modulation of prostate cancer genetic risk by omega-3 and omega-6 fatty acids[J].The Journal of Clinical Investigation,2007,117(7):1866-1875.
[12]Magbanua M J M,Roy R,Sosa E V,et al.Gene Expression and Biological Pathways in Tissue of Men with Prostate Cancer in a Randomized Clinical Trial of Lycopene and Fish Oil Supplementation[J].Plos One,2011,6(9):134-140.
[13]李波,杨景贤,韩丽,等.鱼油类保健品中不饱和脂肪酸的气相色谱及质谱检测研究[J].上海预防医学,2004,16(5):211-214.
[14]Seppänen-Laakso T,Laakso I,Hiltunen R.Analysis of fatty acids by gas chromatography,and its relevance to research on health and nutrition[J].Analytica Chimica Acta,2002,465:39-62.
[15]Malagarie-Cazenave S,Olea-Herrero N,Vara N,et al.The vanilloid capsaicin induces IL-6 secretion in prostate PC-3 cancer cells[J].Cytokine,2011,54:330-337.
[16]Terry P,Lichtenstein P,Feychting M,et al.Fatty fish consumption and risk of prostate cancer[J].The Lancet,2001,357:1764-1766.
[17]Manna S,Janarthan M,Ghosh B,et al.Fish oil regulates cell proliferation,protect DNA damages and decrease HER-2/ neu and c-Myc protein expression in rat mammary carcinogenesis [J].Clinical Nutrition,2010(29):531-537.
[18]Sfanos K S,De Marzo A M.Prostate cancer and inflammation:the evidence[J].Histopathology,2012,60:199-215.
[19]Twillie D A,Eisenbserger M A,Carducci M A,et al. Interleukin 6:a candidate mediator of human prostate cancer morbidity[J].Urology,1995,45:542-549.
Effects of condensed fish oil on the growth of prostate cells in vitro
SHEN Yu-zhen1,YU Hai-ning2,ZHANG Cheng-cheng1,ZENG Si-min1,SHEN Sheng-rong1,*
(1.Department of Biosystem Engineering and Food Science,Zhejiang University,Hangzhou 310058,China;2.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
In order to elucidate the effects of fish oil on the growth and metabolism of prostate cells,in the present paper an epithelial cell(RWPE-1)and prostate cancer cell(PC-3)were employed.Effects of fish oil on cell growth and apoptosis were investigated by MTT assay and flow cytometry after treatment with fish oil. Also gas chromatography was used to analyse fatty acids composition and inflammatory factors(TNF-α,IL-6,LXA4 secreted by cells were detected using ELISA.Results showed that condensed fish oil used in our study had little damage to RWPE-1 cell growth,but the viability of PC-3 cells reduces to 70.34%and the apoptosis rate of PC-3 cells is up to 15.47%±0.64%after treated with fish oil for 48h which was diluted into 50 times.The proportions of GLA,AA,EPA and DHA in PC-3 cells increased markedly,which had no significant increase in RWPE-1 cells.For RWPE-1 cells,the secreted LXA4 maintains almost in a same level and the expression of IL-6 and TNF-α rises gradually.However,PC-3 cells resulted in higher levels of LXA4 and lower expressions of IL-6 and TNF-α when incubated with fish oil.Effects of condensed fish oil used in our study on the growth of these two kinds of prostate cells are quite different.
fish oil;prostate cancer;cell apoptosis;fatty acids composition;inflammatory factors
TS201.1
A
1002-0306(2014)12-0358-07
10.13386/j.issn1002-0306.2014.12.070
2013-10-24 *通讯联系人
沈钰珍(1989-),女,硕士研究生,研究方向:食品分子营养学。

