改性壳聚糖为载体制备喹乙醇分子印迹聚合物及其表征
赵冬艳,乔旭光,徐志祥,安艳冬(.浙江医药高等专科学校生物与食品系,浙江宁波3500;.山东农业大学食品科学与技术学院,山东泰安7000)
改性壳聚糖为载体制备喹乙醇分子印迹聚合物及其表征
赵冬艳1,乔旭光2,*,徐志祥2,安艳冬2
(1.浙江医药高等专科学校生物与食品系,浙江宁波315100;2.山东农业大学食品科学与技术学院,山东泰安271000)
以交联化壳聚糖微球为表面载体,水和乙腈为混合溶剂,将模板分子(喹乙醇),功能单体(丙烯酰胺)及交联剂(N,N’-亚甲基双丙烯酰胺)采用表面分子印迹与溶胶-凝胶法合成喹乙醇分子印迹聚合物(MIP)。并对新型水相分子印迹聚合进行红外光谱、扫描电镜、吸附动力学实验、吸附平衡实验、选择性实验的表征。实验结果表明:以壳聚糖为载体的分子印迹聚合物对喹乙醇的吸附容量为10.14mg·g-1,对喹烯酮的印迹效率因子为2.29,乙酰甲喹的印迹效率因子为2.22。以壳聚糖为载体的分子印迹聚合物具有较高识别选择能力,对喹乙醇具有快速吸附效果。
壳聚糖,喹乙醇,分子印迹聚合物,表征
喹乙醇(olaquindox)是一种抗菌促生长剂,在我国作为饲料添加剂被广泛用于畜禽及水产品的养殖。一度被称为“水产品中的瘦肉精”,大量生物毒性实验表明,喹乙醇可在动物体内形成蓄积,有致突变、致畸和致癌性[1-2]。欧盟、日本禁止使用喹乙醇[3],《中国兽药典》(2005版)中明确规定,喹乙醇被禁止用于家禽及水产养殖。目前国内外对喹乙醇的检测研究报道不多,主要采用高效液相色谱法[4-5]、高效液相串联质谱法[6-8]以及免疫分析法[9-10]等,上述方法存在各自的优缺点,因此,快速、简单并对目标物有选择性分离和富集的前处理技术有必要进行积极开发,其中分子印迹技术即是一种在快速检测中对目标物有较好的选择性富集作用的新型技术。
分子印迹聚合物(MIPs)是仿照抗体的形成机理,人工合成的对目标分子具有高选择识别性能的高聚物,具有一定的机械稳定性、热稳定性和较好的特异性[11]。壳聚糖是一种天然聚阳离子碱性多糖,含有大量羟基和氨基,对壳聚糖进行交联改性可以使壳聚糖对许多物质都具有离子交换、螯合和吸附等作用[12]。以交联化壳聚糖为载体,制备喹乙醇分子印迹聚合物目前未见报道。制备的分子印迹聚合物作为固相萃取材料,可以实现固相萃取对喹乙醇的选择分离和富集,进一步与液相色谱技术联用可以有效提高从复杂样品对目标物的检测限,从而为提高我国食品安全技术水平提供一定技术参考,对推动食品安全的发展具有重要意义。
1 材料与方法
1.1 材料与仪器
喹乙醇、乙酰甲喹、喹烯酮 分析纯,中国兽医药品监察所;丙烯酰胺(AM)、2-丙烯酰胺基-2-甲基丙磺酸(AMPS) 分析纯,上海迈瑞尔化学技术有限公司;乙二醇二甲基丙烯酸酯(EGDMA) 分析纯,美国Sigma公司;N,N-亚甲基双丙烯酰胺(MBA)
分析纯,百灵威科技有限公司;壳聚糖 上海伯奥生物科技有限公司;环氧氯丙烷 分析纯,天津市巴斯夫化工有限公司;甲基丙烯酸(MAA)、三聚磷酸钠、乙酸乙酯、冰乙酸、甲醇、乙腈、过硫酸钾(KPS)、偶氮二异丁腈(AIBN) 分析纯,天津市凯通化学试剂有限公司;聚乙二醇-2000 分析纯,天津市河东区红岩试剂厂。
UV-2450型紫外-可见分光光度计 日本岛津有限公司;KA-1000型离心机 上海安亭科学仪器厂;DZF-6030A型真空干燥箱 上海一恒科技有限公司;HY-4型调速多用振荡器 常州市华普达教学仪器有限公司;SHB-IV双A循环水式多用真空泵 郑州长城科工贸有限公司;KDM型可调控温电热套 山东邺城华鲁电热仪器有限公司;恒温磁力搅拌器 上海闵行虹浦仪器厂;JA1003A型电子天平 上海精天电子仪器有限公司;HH-2型数显恒温水浴锅 常州国华电器有限公司;傅里叶变换红外分光光度计 Thermo,USA;Cary 50-Bio型紫外分光光度计 Victoria,Australia;SS-35型扫描电子显微镜 Shimadzu,日本。
1.2 实验方法
1.2.1 喹乙醇标准曲线的绘制 准确称取50.0mg喹乙醇,于500mL棕色容量瓶用去离子水定容,配制成质量浓度为100mg·L-1标准液。用去离子水稀释,依次配制成浓度为2、4、6、8、10、12、14、16、18、20mg·L-1的标准溶液液。用紫外可见分光光度仪测定其吸光度(A)值,以去离子水作为参比,重复实验三次取平均值,将测得的吸光度(A)值与喹乙醇浓度对应绘制标准曲线,测定波长为372nm。
1.2.2 交联壳聚糖微球的制备方法 称取3.0g壳聚糖,在磁力搅拌下缓慢加入到100mL 2.0%醋酸水溶液中,溶胀12h;取15mL壳聚糖醋酸溶液,超声10min排除气泡,采用离子交联法,将壳聚糖醋酸溶液经医用针头滴入到3.0%三聚磷酸钠溶液中,制得壳聚糖微球,静置2h后,用pH为10的无水乙醇浸泡24h,用蒸馏水洗涤,抽滤,将制备的壳聚糖微球放置于装有100mL pH为10的NaOH溶液烧杯中,加入0.5mL的乙酸乙酯和0.5mL环氧氯丙烷,在60℃磁力搅拌6h,将交联后的壳聚糖微球用大量蒸馏水洗涤去除未反应的环氧氯丙烷,40℃下真空干燥10h,备用[13]。
1.2.3 以壳聚糖微球为载体的印迹聚合物的制备 在150mL具塞的三颈瓶中加入1mmol(0.263g)喹乙醇,6mL水和4mL乙腈,加热回流溶解;加入2mmol(0.142g)丙烯酰胺,磁力搅拌30min,加入0.500g改性壳聚糖微球搅拌10min,加入亚甲基双丙烯酰胺4mmol(即0.616g)搅拌30min,加入0.400g过硫酸钾(KPS)搅拌20min,充氮气15min,放入58℃水浴锅内静置24h,抽滤,用去离子水和甲醇先后洗涤,置100℃下真空干燥10h。
将聚合物放入100mL的具塞圆底烧瓶中,加入50mL甲醇和15mL 1mol·L-1盐酸,磁力搅拌4h,过滤,用0.1mol·L-1氢氧化钠、热水先后洗涤至中性,在80℃下真空干燥10h。然后将聚合物置于索氏萃取器中,用150mL甲醇和冰乙酸(9∶1,v/v),连续萃取24h洗至无喹乙醇检出,用甲醇和蒸馏水洗到中性,100℃下真空干燥10h。
制备非分子印迹聚合物(NIP)除不加模板分子喹乙醇,其余操作步骤同上述分子印迹聚合物(MIP)的制备[14]。
1.2.4 傅立叶红外光谱分析 采用KBr压片法制样,扫描范围为400~4000cm-1,对喹乙醇及喹乙醇印迹聚合物(除去模板分子)和非印迹聚合物进行红外光谱分析。
1.2.5 扫描电镜分析 为了研究合成的分子印迹聚合物的表面结构特性,对印迹聚合物和非印迹聚合物进行扫描电镜分析,将聚合物在IB-5离子溅射仪中镀铂,用SS-35扫描电镜观察并拍照。
1.2.6 吸附平衡结合实验 准确称取20.0mg分子印迹聚合物于50mL的棕色容量瓶中,加入10mL喹乙醇标准溶液,振荡4h,4000r/min离心20min。准确移取上清液1.0mL稀释至5.0mL,在紫外-可见光度计上测定其吸光度,测定波长为372nm。同时平行做非分子印迹聚合物对喹乙醇的平衡结合实验。
根据聚合物平衡吸附后测定的吸光度值和喹乙醇标准曲线,求得在平衡吸附后溶液浓度(Ce),根据吸附前后溶液浓度的改变计算吸附容量Q(mg·g-1)[15]。
Q=(Co-Ce)V/W 式(1)
式中,Co为原始浓度(mg/mL),Ce为吸附后溶液浓度(mg/mL),V为溶液体积(mL),W为样品用量(g)。1.2.7 吸附动力学实验 准确称取20.0mg分子印迹聚合物于50mL的棕色容量瓶中,加入100mg·L-1的喹乙醇溶液10mL,在室温下振荡5、30、60、120、180、240min,4000r/min离心20min。准确移取上清液1.0mL稀释至5.0mL,在紫外-可见光度计上测定上清液的吸光度,测定波长为372nm。
1.2.8 选择吸附性实验 分别称取20.0mg分子印迹聚合物于50mL的棕色容量瓶中,加入10mL 100mg·L-1喹乙醇标准溶液,10mL 100mg·L-1乙酰甲喹标准溶液以及10mL 100mg·L-1喹烯酮标准溶液,振荡4h,4000r/min离心20min。准确移取上清液1.0mL稀释至5.0mL,在紫外-可见光度计上测定其吸光度,测定波长为372、372、314nm。
分离因子(α)=QMIP/QNIP式(2)
静态吸附分配系数KD定义为:KD=CP/Cs 式(3)
式中,Cp表示底物在聚合物上的浓度(mg·L-1),Cs表示底物在溶液中的浓度(mg·L-1)。
分离因子α又可以定义为:
α=KDi/KDj式(4)
式中,i和j表示模板分子和底物,规定j=i时,α=1.0
印迹效率因子(β)=α/α’ 式(5)
式中,α’表示喹乙醇的结构类似物乙酰甲喹或喹烯酮的分离因子。
2 结果与讨论
2.1 喹乙醇标准曲线的绘制

图1 喹乙醇标准曲线的绘制Fig.1 Standard curve olaquindox
通过全波长扫描,确定372nm为喹乙醇的最大吸收波长。标准曲线如图1所示,R2为0.997,具有较好的线性关系。
2.2 以壳聚糖为载体分子印迹聚合物的制备影响因素
2.2.1 功能单体和交联剂的选择 由表1的结果可以得知,功能单体为丙烯酰胺,交联剂为MBA时吸附容量最高。在亲水性分子印迹聚合物的制备中,常选用的交联剂MBA,此交联剂常与功能单体丙烯酰胺一起作用,形成聚丙烯酰胺凝胶,该凝胶具有良好生物兼容性,并有柔软的大孔结构,可方便模板分子进出等优点,但是聚丙烯酰胺凝胶过于柔软,没有刚性结构,以壳聚糖微球为载体制备分子印迹聚合物则克服了凝胶固有的缺点,提高了其作为聚合物高吸附容量的优势。

表1 不同功能单体和交联剂组成Table 1 Various consistute of the functional monomer and cross-linker investigated for the preparation
2.2.2 功能单体和交联剂的配比优化 表2结果表明:将1mmol(0.263g)喹乙醇溶解在4mL水和6mL乙腈中,充分溶解后加入2mmol(0.142g)丙烯酰胺,磁力搅拌30min,再加入0.5g改性壳聚糖微球搅拌10min,最后加入亚甲基双丙烯酰胺4mmol(即0.616g)和引发剂所合成的材料对喹乙醇的吸附效果最佳,即MIP8,因此聚合物的性能表征实验均以MIP8及其空白聚合物进行。
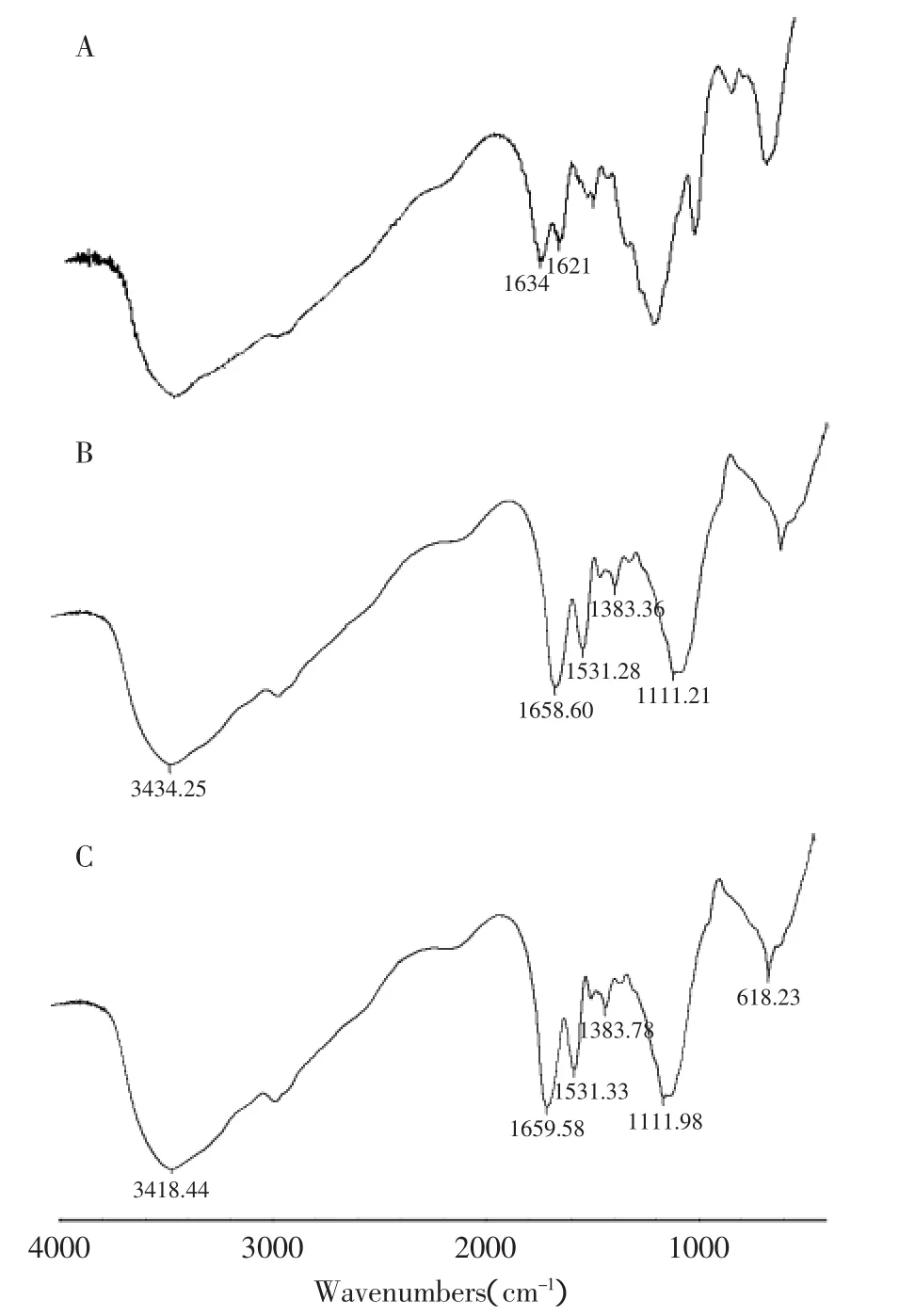
图2 红处光谱图Fig.2 Infrared spectrogram

表2 不同功能单体和交联剂配比Table 2 Various ratios of the functional monomer and cross-linker investigated for the preparation of the olaquidox MIPs
2.3 壳聚糖为载体分子印迹聚合物的表征
2.3.1 傅立叶红外光谱分析 图2(A)中改性壳聚糖红外光谱图中基本上保留了壳聚糖原有的特征吸收峰形,在1561cm-1和1416cm-1处峰形的消失,说明壳聚糖的氨基和羟基参与了交联反应。从图2(B)中可以看到,在3434cm-1处有吸收峰出现,在此频率出现的吸收峰是胺和酰胺的N-H伸缩振动,1658cm-1是C=O的振动频率,酰胺基里C=O由于氨基的影响,使得C=O伸缩振动向低波数位移,另外,酰胺基的C-N键在1300~1260cm-1里出现,由于聚合反应的影响,C=C的伸缩振动频率在1531cm-1附近。由图谱可知,喹乙醇分子与功能单体成功发生反应,图2(C)是非印迹聚合物红外光谱图,从谱图中可以看到印迹聚合物和非印迹聚合物有相似的图谱,说明模板喹乙醇已从印迹聚合物里洗脱出来。
2.3.2 扫描电镜分析 由图3(A)列可以看出,壳聚糖经适量改性后,其表面不再光滑,但经1000倍放大后观察可见其表面有较多的褶皱,可能是其具有较好的吸附性能的原因;图3(B1)是分子印迹聚合物的外部形貌,可以看到聚合物呈球形,表面覆盖一层聚合膜,从图3(B2)中可以看到聚合物表面有许多细小均匀的孔穴,有可能是洗脱模板喹乙醇后留下的孔穴;图3(C)列是非印迹聚合物的电镜图,从图3(C1)可以看到聚合物表面较光滑,且有许多裂缝,图3(C2)中可以看到表面也有许多孔隙,但大小不均,可能是洗脱过程中萃取剂随机对聚合物洗脱,从而留下不规则的孔穴。

图3 扫描电镜图Fig.3 Scanning electron micrographs
2.3.3 平衡结合实验 由图4可以看出,随喹乙醇标液浓度逐渐增大,分子印迹聚合物和非印迹聚合物对其吸附量逐渐增大,非印迹聚合物对100mg·L-1浓度的喹乙醇吸附容量为5.93mg·g-1,而印迹聚合物吸附容量为10.14mg·g-1,在相同条件下,印迹聚合物对模板分子的吸附容量明显高于非印迹聚合物,说明印迹聚合物对喹乙醇具有较好的选择性吸附。制备的聚合物对喹乙醇具有选择性吸附的原因可能是因为在壳聚糖表面制备的聚合物内部形成了与喹乙醇的官能团位置与形状相适宜的空腔,从而使得聚合物对模板分子具有良好的选择性结合能力。
2.3.4 吸附动力学 图5是分子印迹聚合物的吸附动力学曲线,从图5中可以看到,分子印迹聚合物对喹乙醇的吸附容量随时间的延长而逐渐增加,在60min的吸附容量为5.89mg·g-1,占最大吸附容量的57.6%,吸附大约在3h后达到平衡。说明分子印迹聚合物具有较好的吸附动力学,因为分子印迹聚合物在壳聚糖表面合成,所以模板分子进入聚合物内部与其形状和结合基团相配合的孔穴需要较短的时间,从而具有较快的吸附速度。
2.3.5 选择吸附性 表3比较了以壳聚糖为载体的分子印迹聚合物和非印迹聚合物对喹乙醇、喹烯酮和乙酰甲喹的吸附容量、静态吸附分离因子α和印迹效率因子β。

图4 分子印迹聚合物及非分子印迹聚合物的吸附等温线Fig.4 Adsorption isotherms of the molecularly imprinted polymers and non-molecular imprinted polymer

图5 分子印迹聚合物的吸附动力学曲线Fig.5 Kinetics uptake plot of the MIP toward olaquindox

表3 印迹聚合物和非印迹聚合物对喹乙醇、喹烯酮和乙酰甲喹的选择吸附性Table 3 The selectivity for olaquindoxs,quinocetone,mequindox by MIP and NIP
从表3中可知,以壳聚糖为载体的分子印迹聚合物对喹乙醇的吸附容量为10.14mg·g-1,远远高于喹烯酮和乙酰甲喹,表明印迹聚合物对模板分子喹乙醇主要是特异性吸附。另外,印迹聚合物对两种类似物喹烯酮和乙酰甲喹的印迹效率因子很大(2.0及以上),说明印迹聚合物对喹乙醇具有显著的印迹效应,对其他两种类似物的识别能力和选择性较差。这些结果进一步表明,在分子印迹聚合物中存在固定排列的结合基团的立体空腔,空腔的大小与空腔内结合基团的位置和模板分子相适宜,从而对模板分子有“记忆”功能,因此对模板分子有特异的选择性。
3 结论
本研究以壳聚糖为载体,运用表面印迹-溶胶凝胶法制备喹乙醇分子印迹聚合物。制备的印迹聚合物对100mg·L-1浓度的喹乙醇吸附容量为10.14mg·g-1,而非印迹聚合物的吸附容量仅为5.93mg·g-1,说明其具有较高的吸附容量;制备的印迹聚合物在60min的吸附容量为5.89mg·g-1,占最大吸附容量的57.6%,吸附大约在3h后达到平衡,表明具有较快的吸附速度;对喹烯酮的印迹效率因子达2.29,对乙酰甲喹的印迹效率因子为2.22,表明制备的印迹聚合物具有较好的选择吸附性。因此,所合成的功能材料适用于对喹乙醇的检测。
[1]赵从民.喹乙醇的作用与使用方法[J].吉林畜牧兽医,2003(11):41.
[2]邓云波,段苏华,陈启友.喹乙醇的特性及其规范合理使用[J].湖南畜牧兽医,2004(1):14-17.
[3]宋春美,侯玉泽,刘宣兵,等.喹乙醇的危害及检测方法研究进展[J].河南农业科学,2009(12):13-17.
[4]罗杨,张剑勇.高效液相色谱法测定饲料中喹乙醇含量[J].中国饲料,2006(12):35-38.
[5]Thente K,Andersson B.The determination of olaquindox in pig feeds by high-peformance liquid chromatography[J].Journal of the Science of Food and Agriculture,1982,33(10):945-948.
[6]Poucke C V,Dumoulin F,Peteghem C V.Detection of banned antibacterialgrowth promoters in animalfeed by liquid chromatography-tandem mass spectrometry:optimization of the extraction solvent by experimental design[J].Analytica Chimica Acta,2005,529(1-2):211-220.
[7]曾静,朱宽正.高效液相色谱-串联质谱法检测水产品中的喹乙醇[J].中国食品卫生杂志,2006,18(5):423-425.
[8]杨文军,张丽英.高效液相色谱质谱联用法测定饲料中喹乙醇[J].中国饲料,2006(20):33-36.
[9]冀宝庆.喹乙醇及其代谢残留免疫检测技术研究[D].无锡:江南大学,2008.
[10]Zhao D,He L,Pu C,et al.A highly sensitive and specific ployclonal antibody-based enzyme-linked immunosorbent assay for detection of antibiotic olaquindox in animal feed samples[J]. Analytical and Bioanalytical Chemistry,2008,39(1):2653-2661.
[11]姜忠义.分子印迹聚合物的设计与制备[J].高分子材料科学与工程,2004,20(3):25-28.
[12]王华芳,何运华,何锡文,等.3-氨基苯硼酸为功能单体在壳聚糖上印迹牛血清白蛋白的研究[J].高等学校化学学报,2008,29(4):726-730.
[13]杨春梅,顾磊,孙怡,等.离子交联法制备氟尿嘧啶壳聚糖微球[J].华东理工大学学报:自然科学版,2010,36(4):546-549.
[14]Guo T Y,XiaY Q,Wang J,et al.Chitosan beads as molecularly imprinted polymer matrix for selective separation of proteins[J]. Biomaterials,2006,26(28):5737-5745
[15]Cormack P,Mosbach K.Molecular imprinting:recent developments and the road ahead[J].Reactive and Functional Polymers,1999,41(1-3):115-124.
Preparation and characterization of olaquindox molecularly imprinted polymer using the modified chitosan carrier
ZHAO Dong-yan1,QIAO Xu-guang2,*,XU Zhi-xiang2,AN Yan-dong2
(1.Department of Biological and Food,Zhejiang Pharmaceutical College,Ningbo 315100,China;2.Department of Food Science and Engineering,Shandong Agricultural University,Tai’an 271000,China)
A simple molecularly imprinted polymer(MIP)was prepared using olaquindox as the imprinted molecule,acrylamide as the functional monomer,and N,N’-Methylenebisacrylamide as the cross-linker,chitosan as matrix in the mixed solvent of doubly deionized water(DDW)and acetonitrile.This prepared material was evaluated by FT-IR spectra,SEM images,uptake kinetics experiments,static adsorption experiments and selective adsorption experiments.The results indicated that the adsorption capacity of the imprinted polymer were 10.14mg·g-1.The imprinting efficiency factor to quinocetone was 2.29,the imprinting efficiency factor to mequindox was 2.22.The MIP had much higher adsorption capacity and also had a faster adsorption capacity for the olaquindox.
chitosan;olaquindox;molecularly imprinted polymer;characterization
TS207.3
A
1002-0306(2014)12-0108-05
10.13386/j.issn1002-0306.2014.12.014
2013-10-28 *通讯联系人
赵冬艳(1976-)女,博士,讲师,研究方向:食品安全检测。
国家自然科学基金面上项目(31171699);山东省教育厅科技计划项目(J11LC29)。

