鱿鱼肝脏活性肽的制备及生物活性研究
朱 瑶,胡建恩,杨 杰,卢 航,刘鹏宇,赵 慧
(大连海洋大学食品科学与工程学院,辽宁大连116023)
近年来,我国鱿鱼渔获量占总渔获量的比重呈不断上升的趋势。在加工过程中产生大量副产物,这部分肝脏大都用于加工鱼粉、鱿鱼浆等初级产品或直接丢弃,这不仅造成资源浪费还对环境造成污染。鱿鱼肝脏约占鱿鱼湿重的15%左右,其中约含19%的蛋白质[1]。目前对于鱿鱼肝脏的研究主要集中在脂肪和蛋白质方面,其中蛋白质主要是制备酱油等调味品和酶制剂[2-3],对于活性肽的研究报道较为少见。笔者以鱿鱼肝脏蛋白为原料,通过酶解技术制备生物活性肽,并对其生物活性进行研究,以期为生物活性肽的制备提供新途径。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂。鱿鱼内脏购于辽宁大连海洋渔业总公司;木瓜蛋白酶、酸性蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶,购于天津诺奥科技发展有限公司;胃蛋白酶,购于上海莲冠生物化学有限公司;α-葡萄糖苷酶、对硝基苯麦芽戊糖(pNPG),购于Sigma公司;TT试剂、PT试剂、APTT试剂,购于上海太阳生物技术有限公司。
1.1.2 仪器与设备。Multiskan Ascent酶标仪,购于巩义市予华仪器有限责任公司;凝血仪为德国TECO产品;高效液相色谱为大连依利特科学仪器有限公司产品。
1.2 方法
1.2.1 肝脏基本营养成分的测定。将-18℃冷冻的鱿鱼内脏,于室温解冻,分离鱿鱼肝脏洗净后对其基本营养成分(水分、脂肪、蛋白质含量、灰分)进行测定。
1.2.2 鱿鱼肝脏蛋白质的制备及溶解度的测定。取鱿鱼肝脏与蒸馏水按1∶1.5(m/v)的比例捣碎制备鱿鱼肝脏匀浆液,于126℃ 、0.5 MPa条件下蒸煮20 min。将蒸煮液于5 000×g离心20 min,共得到4层物质。其中,最上层为油脂层,其余为蛋白质层,由上至下依次为样品Ⅰ、Ⅱ、Ⅲ。将得到的蛋白质烘干后粉碎,然后用丙酮进行少量多次脱脂处理,直至丙酮提取液颜色较浅为止。
称取样品 1 mg,分别溶于 10 ml pH 分别为 2、4、6、8、10和12的缓冲溶液中,充分混匀后取此浓度蛋白质溶液1 ml,采用Lowry法[4]测定样品中蛋白质含量,从而测定各蛋白质样品在不同pH条件下的溶解度,其计算公式为:蛋白质的溶解度=溶液中蛋白质的浓度×溶液总体积/样品的质量×100%。
1.3 鱿鱼肝脏生物活性肽的制备 选用酸性蛋白酶、中性蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶分别对鱿鱼肝脏蛋白进行酶解,酶解条件如表1所示。
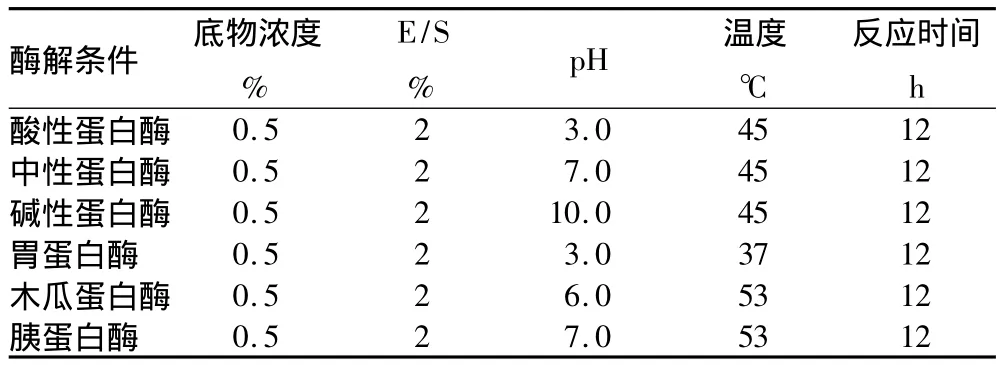
表1 6种酶对鱿鱼肝脏蛋白的酶解条件
1.4 鱿鱼肝脏蛋白酶解液水解度的测定 采用甲醛电位滴定法测定溶液中游离氨基酸的数量,计算鱿鱼肝脏蛋白酶解液的水解度(DH)[5]。
1.4.1 完全水解液的制备。取鱿鱼肝脏蛋白139.94 mg(100 mg蛋白质),放入反应瓶中加入6 mol/L的浓盐酸100 ml。将其密封后放入115℃的烘箱中消化24 h,水解完全后将水解液进行真空浓缩至0.5 ml。取一定量蒸馏水将其洗入烧杯中,用浓度为1 mol/L的NaOH溶液中和至中性(pH为6),于100 ml容量瓶中定容至刻度线。
1.4.2 酶解液水解度的测定。取灭酶后的水解液8.0 ml,置于容量150 ml的三角瓶中,加入60 ml去CO2蒸馏水,调节pH至8.2。向烧瓶中加入10.0 ml中性甲醛溶液,混匀。用0.1 mol/L的NaOH标准溶液滴定至pH 9.2,记录此时消耗标准NaOH溶液的体积V1。以相同浓度未水解的鱿鱼肝脏蛋白溶液为空白,记录此时消耗标准NaOH溶液的体积V2。计算每克原料蛋白水解得到的游离氨基的毫摩尔数。
同样取完全水解液8.0 ml,利用甲醛电位滴定法重复以上操作。以相同浓度未水解的蛋白质溶液作为空白对照,分别记录二者消耗标准NaOH溶液的体积V3和V4,计算每克原料蛋白完全水解得到的游离氨基的毫摩尔数。
按照下式计算鱿鱼肝脏蛋白各酶解液的水解度:

1.5 鱿鱼肝脏蛋白酶解液生物活性的测定
1.5.1 抗凝血活性的测定。兔静脉采血后,立即将其与0.109 mol/ml柠檬酸钠抗凝剂按体积比9∶1于离心管中混匀,以2 000 g离心15 min,收集上清血浆,置于-70℃冰箱中保存,备用。
待测血浆中 V样品:V血浆为 1∶9,空白对照中 V生理盐水∶V血浆为1∶9。
1.5.1.1 凝血酶原时间(PT)的测定。在检测血浆中加入足量的凝血活酶和钙离子,测定血浆凝固所需的时间即为血浆凝血酶原时间(PT)。取25 μl待测血浆于37℃预热1 min后,加入50 μl预热的PT试剂(5 min≤预热时间≤15 min),记录凝固时间即为PT值。以生理盐水作为空白对照,每个样品测定3组平行。
1.5.1.2 凝血酶时间(TT)的测定。待测血浆中加入“标准化”的凝血酶溶液后,血浆凝固所需要的时间为凝血酶时间(TT)。取50 μl待测血浆于37℃预热1 min,然后加入50 μl预热的TT试剂(5 min≤预热时间≤15 min),记录凝固时间即为TT值。以生理盐水作为空白对照,每个样品测定3组平行。
1.5.1.3 活化部分凝血活酶时间(APTT)的测定。在37℃条件下用白陶土(激活剂)激活Ⅺ、Ⅻ因子。用脑磷脂(部分凝血活酶)代替血小板第3因子,测定乏血小板血浆加入Ca2+离子后凝固所需的时间即为APTT。该试验是内源性凝血系统灵敏和常用的筛检试验。取25 μl待测血浆和25 μl APTT试剂混合,37℃预热 5 min,然后加入 25 μl 0.025 mol/ml预热的CaCl2溶液。记录凝固时间即为APTT值,以生理盐水作为空白对照。每个样品测定3组平行。
1.5.2 ACE抑制活性的测定。取5 μl样品与15 μl ACE混合后于37℃条件下预热5 min,加入25 μl 7.6 mmol/L的底物 HHL(底物溶解于608 mmol/L NaCl,pH 8.3、0.1 mol/L 硼酸缓冲液)中启动反应体系,37℃水浴条件下反应25 min,再加入10 μl的10%三氟乙酸终止反应后,用反相高效液相色谱法在波长228 nm条件下测定马尿酸的含量,以未加样品为空白对照,按照以下公式计算ACE活性抑制率:

1.5.3 抗氧化能力的测定。
1.5.3.1 还原力测定。根据Dike Teng等[6]测定还原力的方法稍作修改,对样品的还原力进行测定。取1 ml样品与1 ml 0.2 mol/L pH 6.6的磷酸盐缓冲液混匀,然后加入1 ml 0.1%的铁氰化钾,在50℃条件下反应20 min后,急速冷却,以1 ml 10%的TFA终止反应。取2 ml此反应液加入2 ml蒸馏水及0.8 ml 0.1%FeCl3混匀,10 min后测定混合液在波长700 nm处吸光值。以1 ml蒸馏水为空白对照,以90 μg/ml VC为阳性对照,按照以下公式计算羟自由基清除率:
1.5.3.2 羟自由基清除能力的测定。参照Fenton反应方法建立反应体系模型[7]。取1 ml 9 mmol/L FeSO4溶液、1 ml 9 mmol/L水杨酸-乙醇溶液及1 ml 5 mg/ml样品溶液于试管中混匀,再加入0.8 ml 8.8 mmol/L H2O2启动反应,将混合液于37℃反应30 min。以蒸馏水代替样品为空白对照,以蒸馏水代替H2O2为背景影响,同时以蒸馏水作为参比,测定反应液在波长510 nm处的吸光值,以250 μg/ml VC作为阳性对照,按照以下公式计算羟自由基清除率:
羟自由基清除率(%)=1-(AS-A0)/Ac×100%
式中,AS为样品反应吸光值,A0为样品背景吸光值,Ac为空白对照吸光值。
2 结果与分析
2.1 鱿鱼肝脏基本营养成分的测定结果 采用国标对鱿鱼肝脏基本营养成分进行了测定。由表2可知,鱿鱼肝脏中蛋白质占湿重的17.42%,占干重的33.74%。脂肪占湿重的32.56%,占干重63.06%。
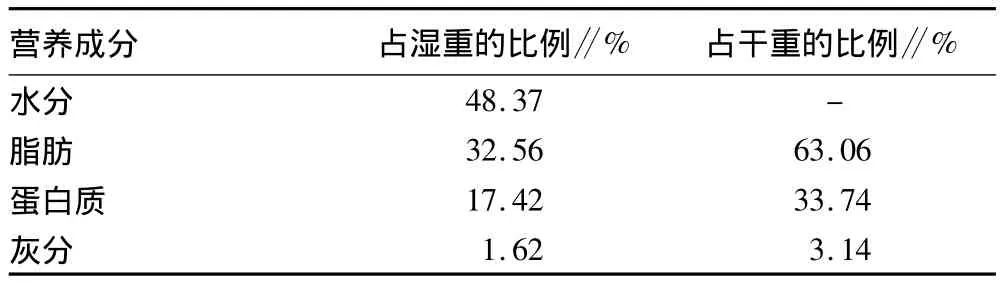
表2 鱿鱼肝脏基本营养成分的测定结果
2.2 鱿鱼肝脏蛋白质溶解度 鱿鱼肝脏经高温蒸煮离心后得到4层物质,自上而下依次为油脂、悬浮层、溶液层、沉淀层。将3个蛋白质样品分别于烘箱中烘干后,加入丙酮进行脱脂处理。将脱脂后的3个蛋白质样品分别溶解于pH为2、4、6、8、10 和12 溶液中,并测定溶解度。试验发现,溶液层样品在各pH条件下的溶解度均高于其他样品,在pH为10条件下溶解度最大,因此选用溶液层蛋白质为原料制备生物活性肽。
2.3 鱿鱼肝脏蛋白6种酶解液的水解度 采用甲醛定位法测定了6种蛋白酶解液的水解度。从图1可以看出,中性蛋白酶酶解液最大水解度为13%。
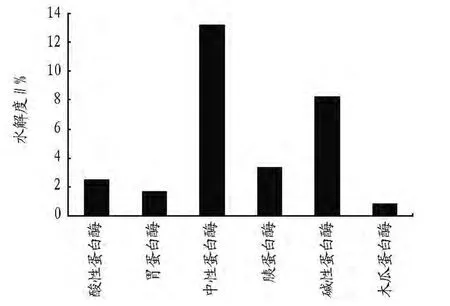
图1 6种蛋白酶解液的水解度
2.4 鱿鱼肝脏蛋白酶解液生物活性
2.4.1 抗凝血活性。分别测定了6种酶解液的抗凝血活性。结果表明,中性蛋白酶解液对凝血过程中的内源途径和共同途径作用最强,APTT值为59.8 s,TT值为34.2 s,较空白对照分别延长26.7和20.6 s。对于外源凝血途径(PT值),各酶解液的作用均不明显。阳性对照肝素钠的各值均超过了凝血仪的测定范围(0~300 s)。
2.4.2 ACE抑制活性。鱿鱼肝脏经6种蛋白酶水解后,对ACE均有较强的抑制活性,其中中性蛋白酶解液和碱性蛋白酶解液的抑制率较高,分别为68.0%和63.4%。
2.4.3 抗氧化活性。分别测定了6种酶解液的抗氧化活性。结果表明,酸性蛋白酶和胃蛋白酶的水解液还原力最强,其OD700与VC(1.04)相当,分别为0.96和1.00。酸性蛋白酶、木瓜蛋白酶和胰蛋白酶酶解液的羟自由基清除能力较好,分别为91.4%、92.2%和93.6%。且高于阳性对照VC(71.1%)。
3 讨论
我国海洋生物种类多、资源丰富,在其生长和代谢过程中生产各种具有特殊生理功能的活性物质,为开发研究活性化合物奠定基础。
该试验以鱿鱼肝脏为原料,通过酶解技术制备生物活性肽并测定其活性,得到6种酶解液中中性蛋白酶解液的抗凝血活性和ACE抑制活性最强;碱性蛋白酶也具有较强的ACE抑制活性;酸性蛋白酶和胃蛋白酶均具有较强的抗氧化活性。笔者从鱿鱼肝脏中制备生物活性肽并对其活性进行初步研究,为今后进一步分离纯化及活性研究提供理论基础,以期提高鱿鱼肝脏的综合利用效率。
[1]陈意.鱿鱼的营养及食用价值[J].食品与药品,2006,8(6):75-76.
[2]袁亚辉,姚美君.利用鱿鱼内脏生产海味素的研究[J].渔业现代化,2002(1):28-29.
[3]郭无暇,胡建恩,王秀武,等.鱿鱼副产物的综合利用[J].精细与专业化学品,2006,14(18):6-8.
[4]杨安钢.生物化学与分子生物学实验技术[M].北京:高等教育出版社,2001:248-252.
[5]新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994(11):65-67.
[6]TENG D K,FANG Y,SONG X Y,et al.Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide form goat placenta[J].Food and Bioproducts Processing,2010,159:1-7.
[7]丁利君,周圳辉,林燕如.芒萁中黄铜物质的提取及抗氧化研究[J].食品科技,2005,26(8):77-79.

