10种杀菌剂对水稻稻叶褐条斑病菌的室内毒力
冯爱卿, 陈 深,2, 朱小源, 苏 菁,2,汪文娟,2, 汪聪颖,2, 杨健源, 曾列先*
(1.广东省农业科学院植物保护研究所,广州 510640;2.广东省植物保护新技术重点实验室,广州 510640)
近几年,在广东水稻种植区普遍发生一种新病害—稻叶褐条斑病。该病主要在叶面上形成短细条状斑,病斑黄褐至黑褐色为主,四周黄晕不明显,严重时可致全叶枯死,引起穗枯,谷粒结实差或不结实,造成水稻严重减产。目前在广东省的阳江、韶关、东莞、广州市等水稻田间均有分布,对本地的水稻安全生产存在一定的威胁[1]。
水稻稻叶褐条斑病的病原菌为稻黑孢霉菌[Nigrospor a or yzae(Ber k.et Br.)Petch],属半知菌丝孢纲丝孢目暗色孢科黑孢霉属[1]。早在1957年Kiyose在日本东京发现稻黑孢霉菌可侵染水稻引起叶斑病,可弱寄生于水稻,具有潜伏侵染特性;后来又陆续报道其还可以侵染高粱、玉米、小麦、草地早熟禾、菩提榕树、棉花等,危害寄主范围在不断扩大。该病菌可通过种子带菌和风雨传播,在中国的主要稻区和世界各地均有分布,特别在热带地区发生普遍[2-15]。以前有关其严重危害的报道不多,近年在广东发生面积上升,估计与菌源长期积累、环境适宜、较强的致病类型出现有关。尽管稻黑孢霉菌已被证实可侵染多种植物,但是国内外有关其防治研究的报道不多,1987年罗宽等报道[16]用常规药剂防治该菌均无明显效果。因此,在抗病品种相对缺乏,对病原菌及病害的发生流行特性未尽悉的情况下,筛选高效、安全、对环境友好的杀菌剂无疑是当前防治稻叶褐条斑病流行的有效应急措施。目前国内外有关防治稻黑孢霉菌药剂的毒力测定尚未见报道。本文采用菌丝生长速率法测定了10种杀菌剂对水稻稻叶褐条斑病病菌的室内毒力,为进一步筛选防治水稻稻叶褐条斑病的高效新药剂提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试培养基
PSA培养基(马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水定容至1 000 mL)。
1.1.2 供试菌株
供试菌株稻黑孢霉菌[Nigrospor a or yzae(Ber k.et Br.)Petch]分离自阳江稻田病株上,经常规组织分离法获得,按照柯赫氏法则进行验证,在PSA上纯化、产孢后放置于4℃冰箱备用。病原菌分离与鉴定参见相关文献报道[17]。
1.1.3 供试药剂
选择10种杀菌剂进行室内筛选试验,供试杀菌剂及处理剂量(为有效成分用量)见表1。

表1 各供试药剂名称及处理剂量Table 1 Designation and treated dose of different f ungicides against Nigrospor a or yzae
1.2 试验方法及数据统计
采用菌丝生长速率法测定。在无菌条件下,将各供试药剂用无菌水稀释至低于第1个供试稀释倍数10倍的母液,然后取2 mL母液与18 mL培养基混匀,制成第1个供试稀释倍数的有毒培养基;取低于第1个供试稀释倍数10倍的母液10 mL,加入10 mL的无菌水,配制成低于第2个供试稀释倍数10倍的母液,取该母液2 mL与18 mL培养基混匀,制成第2个稀释倍数的有毒培养基;其他处理剂量依次类推,使各药液在培养基中的浓度为其设计使用浓度,以加无菌水的PSA平板为对照。供试菌株在PSA平板上25℃黑暗条件下培养3 d,从菌落边缘用打孔器打0.5 c m的菌饼,接种到含系列浓度的试验药剂及无药的PSA平板上,每个处理重复3次,培养4 d后采用十字交叉法测量各处理菌落直径,计算菌丝生长抑制率。将菌丝生长抑制率换算成几率值(y),药剂质量浓度(mg/L)转换成以10为底的对数值,并用DPS软件求出各供试药剂的毒力回归方程、有效抑制中浓度(EC50)及相关系数(r)[18]。
菌丝生长抑制率(%)=(对照菌落生长直径-处理菌落生长直径)/(对照菌落生长直径-菌饼直径)×100。
2 结果与分析
2.1 供试杀菌剂对稻黑孢霉菌菌丝生长的影响
10种供试杀菌剂在不同处理剂量下对稻黑孢霉菌菌丝生长的抑制作用见表2。由表2可知:10种药剂中,10%苯醚甲环唑水分散粒剂、50%咯菌腈可湿性粉剂、25%吡唑醚菌酯乳油对病原菌菌丝生长抑制作用最明显,其次是30%苯甲·丙环唑乳油、50%咪鲜胺锰盐可湿性粉剂,其他5种药剂对病原菌也有一定的抑制作用,但效果不明显。病菌在不含药培养基上培养4 d后菌落直径达7.1 c m,10%苯醚甲环唑水分散粒剂在处理剂量为3.3 mg/L下菌落直径为0.00 c m,抑菌率为100%;50%咯菌腈在处理剂量为3.20 mg/L下菌落直径仅为0.62 c m,抑菌率为91.27%;25%吡唑醚菌酯乳油在处理剂量为2.50 mg/L下菌落直径为0.90 c m,抑菌率为87.32%;30%苯甲·丙环唑乳油在处理剂量为5.00 mg/L下菌落直径为1.37 c m,抑菌率为80.70%;50%咪鲜胺锰盐可湿性粉剂在处理剂量为4.20 mg/L下菌落直径仅为0.67 c m,抑菌率为90.56%。这5种药剂的抑菌率显著好于其他的药剂处理,说明以上5种药剂对稻黑孢霉菌具有很好的防治效果。
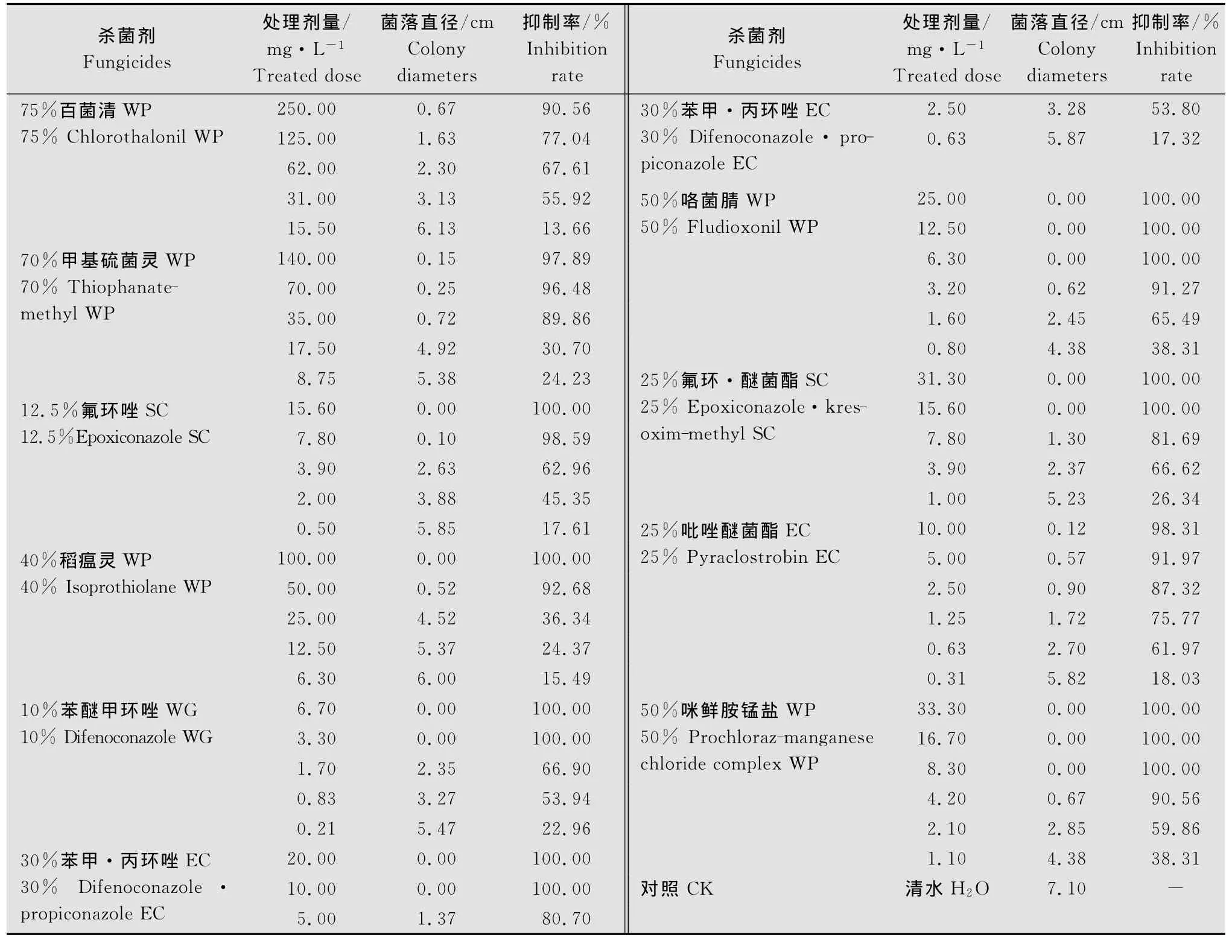
表2 10种药剂对稻黑孢霉病菌菌丝生长的抑制效果Table 2 Inhibitory effects of 10 f ungicides on mycelial growth of N.or yzae
2.2 供试杀菌剂对稻黑孢霉菌的室内毒力
供试杀菌剂对稻黑孢霉菌的室内毒力测定结果见表3。从表3可知,各药剂对稻黑孢霉菌的毒力差异显著,10%苯醚甲环唑水分散粒剂、25%吡唑醚菌酯乳油、50%咯菌腈可湿性粉剂对稻黑孢霉菌毒力位居前三位,EC50分别为0.507 2、0.639 8、0.995 9 mg/L,EC90分别为1.011 2、3.308 0、2.010 1 mg/L;其次是50%咪鲜胺锰盐可湿性粉剂、12.5%氟环唑悬浮剂、30%苯甲·丙环唑乳油、25%氟环·醚菌酯悬浮剂,EC50在1.380 3~2.118 2 mg/L,EC90在2.755 8~4.269 9 mg/L;毒力较弱的是40%稻瘟灵可湿性粉剂和70%甲基硫菌灵可湿性粉剂,毒力最小的是75%百菌清可湿性粉剂,EC50值41.595 7 mg/L,EC90值为216.172 5 mg/L。各种药剂的相关系数均在0.88以上,表明药剂浓度与抑制作用呈现较高的相关性。

表3 稻黑孢霉病菌对不同药剂的敏感性分析Table 3 Sensitivity of different fungicides against N.or yzae
3 结论与讨论
通过菌丝生长速率法测定了水稻稻叶褐条斑病病原菌对10种新旧药剂的敏感性,结果显示,近年的新型杀菌剂如10%苯醚甲环唑水分散粒剂、25%吡唑醚菌酯乳油、50%咯菌腈可湿性粉剂等对稻黑孢霉菌的毒力均比常规药剂40%稻瘟灵可湿性粉剂、70%甲基硫菌灵可湿性粉剂、75%百菌清可湿性粉剂等强。
不同杀菌剂室内毒力测定中,斜率越大说明病原菌对药剂的反应灵敏度越高,即随着单位浓度的增加,抑菌率明显增大[19]。10%苯醚甲环唑水分散粒剂、50%咯菌腈可湿性粉剂2种杀菌剂的斜率较大,且EC50、EC90值最低,其次是50%咪鲜胺锰盐可湿性粉剂、30%苯甲·丙环唑乳油,这4种药剂是室内筛选出的防治效果比较理想的药剂。杀菌剂的室内毒力测定是病原菌药剂选择的重要依据,本试验结果为水稻稻叶褐条斑病的化学防治提供了重要的科学数据。药剂防治效果还需考虑施用适期、使用方法、对水稻生长的安全性、对环境的影响及用药成本等因素,我们将对上述候选药剂做进一步的综合评价,为稻叶褐条斑病的化学防治提供技术支撑。
[1] 冯爱卿,汪文娟,曾列先,等.一种引致水稻稻叶褐条斑的病原鉴定初报[J].广东农业科学,2013(12):78-79,85.
[2] Blaszkowski J.The occurrence of Septoria nodor um Berk.and associated mycoflora in seeds of wheat cultivated in the Szczecin voivodeship[J].Acta Mycologica,1994,29:43-52.
[3] Blaszkowski J.The influence of f ungicides on the mycoflora of leaves of Triticu m aestivu m L.[J].Acta Mycologica,1994,29:147-157.
[4] Blaszkowski J,Piech M.Comparison of seed-borne f ungal communities of naked and husked oats and barley [J].Phytopat hology Polonica,2002,24:71-74.
[5] Do msch K H,Ga ms W,Anderson T H.Co mpendiu m of soil f ungi[M].London:Academic Press(London)Ltd,1980.
[6] Kirk P M,Cannon P F,David J C,et al.Ainsworth &Bisby’s dictionary of the fungi[M].Ninth Edition.CAB Inter national,2001.
[7] Neer gaard P.Seed pat hology[M].London:The Mac millan Press Ltd,1977.
[8] Piech M,Blaszkowski J.The infl uence of the degree of reproduction on the mycoflora of winter x Triticosecale seeds[J].Bulletin of the Polish Academy of Sciences:Biological Sciencesa,1993,41(4):392-399.
[9] Khodke S W,Sandhya K.A new leaf spotof Ficus religiosa by Nigrospora oryzae [J].Indian Phytopathology,2012,62(2):274.
[10]Zheng L,Shi F,Kelly D,et al.First reportof leaf spotof Kentucky bluegrass(Poa pr atensis)caused by Nigrospor a or yzae in Ontario[J].Plant Disease,2012,96(6):909.
[11]Zhang L X,Li S S,Tan G J,et al.First reportof Nigrospor a or yzae causing leaf spotof cotton in China[J].Plant Disease,2012,96(9):1379.
[12]梁力哲,Kaare Moller.中国水稻种子上常见寄生性真菌的检验识别[J].植物保护,1989,15(2):42-44.
[13]马炳田,王玲霞,李仕贵,等.四川省杂交水稻种子寄藏真菌研究[J].种子,2008,27(1):1-5.
[14]台莲梅,盖世武,辛惠普.黑龙江省垦区水稻种子病原真菌鉴定[J].黑龙江农业科学,2002(2):5-7.
[15]袁自清,程良.新疆水稻种子真菌区系的初步调查[J].八一农学院学报,1993,16(2):51-57.
[16]罗宽,王国平,黄声仪.水稻圆斑病研究[J].湖南农学院学报,1987(1):59-68.
[17]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[18]唐启义.DPSCC数据处理系统:实验设计、统计分析及数据挖掘[M].第二版.北京:科学出版社,2010.
[19]陈爱昌,魏周全,骆得功,等.马铃薯炭疽病发生情况及室内药剂筛选[J].植物保护,2012,38(5):162-164.

