四川省茂县花椒根结线虫病病原鉴定
王曦茁, 汪来发*, 杨佐忠, 刘子雄, 余明忠
(1.中国林业科学研究院森林生态与保护研究所,国家林业局森林保护学重点实验室,北京 100091;2.四川省森林病虫害防治检疫站,成都 610081;3.四川省茂县林业局,茂县 623200)
花椒(Zanthoxyl u m bungeanu m Maxi m)为芸香科花椒属落叶小乔木或灌木,原产于我国,是重要的木本油料和香料树种,因适应性强,分布广和收益大,深受群众欢迎[1]。我国自1999年实行退耕还林工程以来,四川省在退耕地大力种植花椒,目前已成为许多地区农业支柱产业和高半山农民增收致富的主要途径之一。2005年以来,四川阿坝州茂县部分乡镇的花椒幼树植株矮小,叶片发黄、失绿,生长缓慢,最后植株枯死,严重地块死亡率达到30%~50%。花椒根及根尖处形成许多小米粒或绿豆粒大小形状不规则的根结,随后侧根也出现大小不等、表面粗糙的形状不规则根结,表面为褐色至深褐色,根结表面又长出许多细的分枝须根,单株根结有的多达百个以上,主要分布在0~30 c m土层。剖开根结见有白色梨形雌虫,即花椒树感染了根结线虫。我国学者虽对花椒病害进行了广泛的研究[2],仅有一位学者提及花椒苗感染南方根结线虫[Mel oidogyne incognita (Kof oid & White)Chit wood][3],至今未见花椒根结线虫病的详细报道。随着经济发展,作为茂县的支柱产业,茂县的花椒栽植面积在不断扩大,根结线虫病造成的经济损失也在逐年增加,为了明确茂县花椒根结线虫病的病原种类,在2011年4月-9月间,笔者采集四川茂县影响严重的花椒根结线虫样品,通过花椒根结线虫形态观察测量、雌成虫会阴花纹、同工酶的酯酶谱带特征和分子生物学特征分析,明确了该县花椒根结线虫病的病原种类,现将结果报道如下。
1 材料与方法
1.1 花椒根结线虫的采集
在四川省茂县白溪乡和叠溪镇花椒种植区采集感病花椒样品,使用随机取样法,采集长有根结的根及其周围的病土,病土采自土壤表层5~30 c m处,每个地块随机采5个点,混匀后放入同一个采集袋内,做好标记。将采集的标样带回实验室,以单卵块接种在灭菌土中培养的刚长出两片真叶的易感病番茄幼苗的土中,培养2个月,用于后期鉴定[4]。
1.2 花椒根结线虫的获得
雌虫的分离和收集:单卵块繁殖60 d后,取被侵染的番茄根,在体视显微镜下将根结表皮用镊子或针尖轻轻拨开,剖面上乳白色的光滑球状物即为根结线虫的雌虫,用解剖针轻轻拨出,放入水中待用。
2龄幼虫的收集:单卵块繁殖60 d后,采集被侵染的番茄根清水洗净,剪成3 c m小段,装入500 mL三角瓶中,配制体积分数1%次氯酸钠溶液,在上述三角瓶中倒入200~300 mL次氯酸钠溶液,封口后猛摇3 min,立即用蒸馏水冲洗数次,先后过200目和500目筛,用蒸馏水反复冲洗留在500目筛子上的卵,最后用无菌水冲洗收集于无菌的小烧杯中。将上述卵放于26℃无菌培养箱中孵化3 d,得到根结线虫的2龄幼虫。
1.3 形态学鉴定
1.3.1 雌虫主要形态特征观察测量
观察头部特征、口针特征等。测量20条线虫体长、最大体宽、口针长和DEGO(背食道腺开口至口针基部球的距离)等形态指标。
1.3.2 2龄幼虫主要形态特征观察测量
观察头部特征、尾部特征等。共观测20条线虫。主要测计的指标为体长、最大体宽、口针长、DEGO和尾长。
1.3.3 雌虫会阴花纹的制作和观察
在体视显微镜下解剖根结,挑取成熟雌虫20条。将雌虫移入硬塑料板上的一滴体积分数45%乳酸中,用解剖刀切取下尾端(虫体后部约1/4处),将尾端的体内组织去掉,切除尾端表皮多余的部分,仅留下会阴花纹部分。将会阴花纹转移至一块载玻片上的纯甘油滴中,一个玻片上放10块会阴花纹,以AFG液为浮载剂,用树脂封片,制成永久玻片。在显微镜下观察会阴花纹的形态特征并拍照。
1.4 同工酶分析
取5μL浸提液(20%蔗糖+2%Triton X-100)移至自制研磨管中,解剖镜下分离一个刚开始产卵的雌虫,转入管内浸提液中,用自制的圆头磨面小玻璃棒充分研磨,补加10μL浸提液。至-20℃冷冻保存。参考Esbenshade和Triantaphyllou等的方法应用垂直板聚丙烯凝胶电泳做酯酶分析[5]。聚丙烯酰胺浓度分别为2.5%和7.5%。凝胶板大小为150 mm×120 mm,凝胶厚度1.5 mm,电极缓冲液是p H 8.3的Tris-盐酸缓冲液。每孔加样量为20μL(含浓度为1 mg/mL溴酚蓝溶液),电泳前30 min电压设在80 V,之后将其稳定在190 V,电泳进行约2 h,直到溴酚蓝指示条带迁移距离达到10 c m。酯酶染色参照胡凯基方法[6]。显色完全后蒸馏水漂洗3次,在固定液(10%醋酸+10%甘油)中固定3 h以上,酯酶表型的命名参照Esbenshade和Triantaphyllou等[5]的标准,以已鉴定的北方根结线虫(M.hapl a)样本(中国农业大学贾克功教授提供)作为参照系判读酯酶谱型,初步确定根结线虫的种类,每个样品做3个重复。
1.5 分子生物学鉴定
1.5.1 根结线虫DNA提取
在解剖镜下从组织内挑取1头雌虫置于载玻片上,无菌水冲洗3次,滴10μL预冷的线虫裂解液(10 mmol/L Tris-HCl p H 8.0,1 mmol/L EDTA p H 8.0,0.25 mol/L NaCl,1%SDS)在虫体上,用枪头压碎后从载玻片上吸取尽可能多含线虫物质的裂解液放入预先装有10μL无菌水的离心管中,加入2μL的1 mg/mL蛋白酶K并快速加入液氮中冷冻10 min,65℃水浴1 h,95℃水浴10 min使蛋白酶K变性,产物直接用于PCR扩增或者-20℃保存备用。
1.5.2 PCR扩增
r DNA-ITS区扩增采用的通用引物为V5367(5′-TTG ATT ACG TCC CTG CCC TTT-3′)和26S(5′-TTT CAC TCG CCG TTA CTA AGG-3′)[7];r DNA-IGS区扩增采用的通用引物为5S(5′-TTA ACT TGC CAG ATC GGA CG-3′)和18S(5′-TCT AAT GAG CCG TAC GC-3′)[8]。引物由北京赛百盛基因技术有限公司合成。
PCR体系(25μL)包括模板DNA 4μL,10×PCR buffer(Mg2+)2.5μL,d NTPs(2.5 mmol/L)2μL,上 游 引 物 (10μmol/L)1μL,下 游 引 物(10μmol/L)1μL,Taq DNA 聚 合 酶 (5 U/μL)0.2μL,加 H2O至25μL。r DNA-ITS区反应条件为:94℃预变性4 min;94℃30 s,55℃30 s,72℃1 min,循环35次;72℃延伸10 min,4℃保存。IGS区反应条件为:94℃预变性3 min;94℃30 s,53℃30 s,72℃90 s,循环45次;72℃延伸10 min,4℃保存。取5μL PCR产物采用1.2%琼脂糖凝胶120 V电泳30 min进行检测。
1.5.3 PCR产物的回收
PCR产物由DNA胶回收试剂盒(Ta Ka Ra)回收、纯化,具体操作步骤参照试剂盒操作说明。
1.5.4 PCR产物的克隆、测序及数据分析
将纯化后的PCR产物克隆至质粒载体p MD18-T(Ta Ka Ra)上,选取每种群各3个阳性克隆由Invitrogen公司测序。利用NCBI BLAST工具和DNA MAN 5.0软件,将获得的r DNA-ITS区和r DNA-IGS区序列与Gen Bank已登录的根结线虫序列进行比对分析。利用Mega5.0软件通过最大似然法(maxi mu m likelihood)构建系统发育树,采用Ki mura t wo-parameter模型。同时对构建的系统树作自展检验(bootstrap test)以获得分支的支持率,自展检验中重复抽样次数为1000次,以秀丽隐杆线虫(Caenorhabditis elegans)(X03680)的ITS和IGS序列作为外群。
2 结果与分析
2.1 根结线虫形态学鉴定
雌虫:体白色,梨形,颈短,头区大,无环纹,口针纤细,基球圆形和杆部有明显界线。锥部向背部稍稍弯曲,杆部末端最宽。
2龄幼虫:蠕虫状,头不突出,无缢缩,口针基部球圆形。尾部有明显透明区,尖端狭窄。
通过对会阴花纹观察,会阴花纹为近圆的六边形到卵圆形,背弓扁平或波浪形,侧线不明显,线纹平滑到波浪形,尾端区通常有刻点(图1)。
雌虫和2龄幼虫的部分测量值见表1。参照文献[9-10],初步确定花椒根结线虫为北方根结线虫(M.hapl a)。
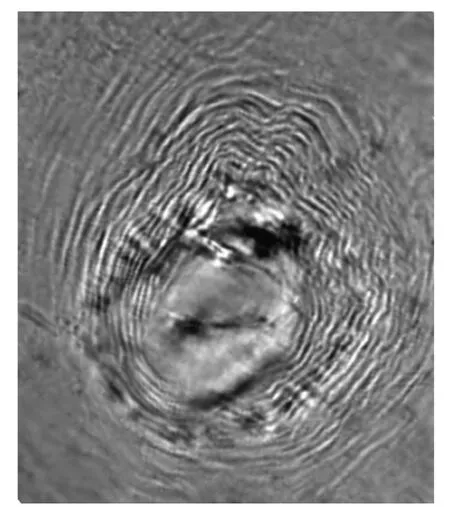
图1 花椒根结线虫的会阴花纹Fig.1 The perineal patter n of the pepper root-knot nematode

表1 花椒根结线虫雌虫和2龄幼虫的测量值1)Table 1 Measurementof females and second-stage juveniles of the pepper root-knot nematode
2.2 酯酶同工酶酶谱
将分离纯化的根结线虫种群进行同工酶分析,电泳结果显示分离纯化的种群根结线虫雌成虫的酯酶同工酶谱均出现一条酯酶带,酯酶谱带类型为H1,迁移率为0.5(图2),这与已知的北方根结线虫酯酶同工酶谱相同[5],因此可以断定侵染花椒的根结线虫为北方根结线虫单一种群(M.hapl a)。
2.3 分子生物学特征
2.3.1 PCR扩增及重组质粒DNA酶切鉴定
通过通用引物对花椒根结线虫的r DNA-ITS区和r DNA-IGS区进行PCR扩增,片段长度在770 bp左右(图3),同北方根结线虫的序列长度基本一致。重组质粒经酶切后都得到1个目的片段大小相似的片段(图3),这说明质粒为目的片段PCR扩增产物的重组克隆。
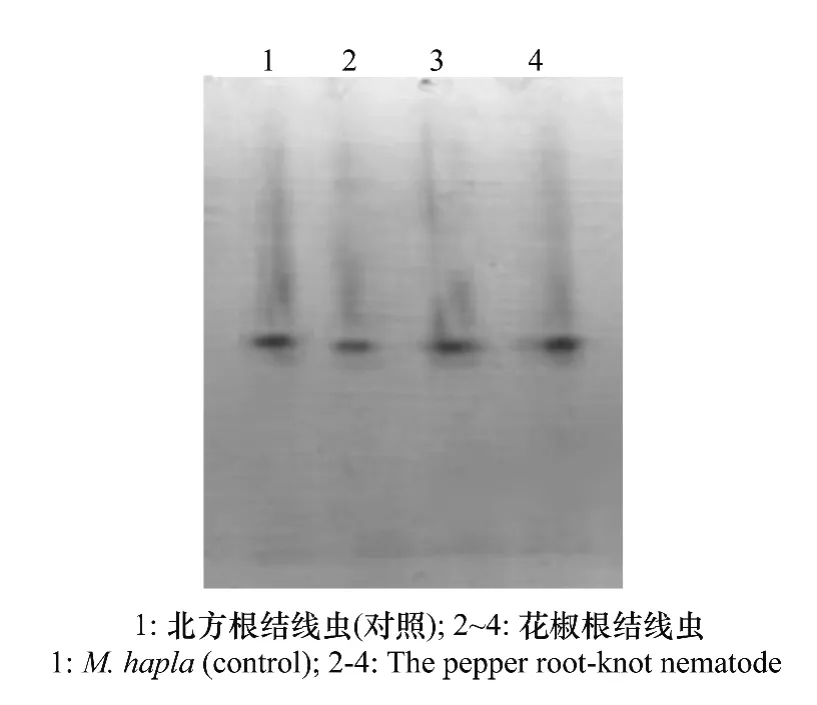
图2 花椒根结线虫酯酶电泳谱型Fig.2 Phenotype of ester ase isozy me(Est)of the pepper root-knot nematode

图3 花椒根结线虫ITS区和IGS区的PCR扩增及产物重组质粒的酶切鉴定结果Fig.3 The PCR identification results of the pepper root-knot nematode ITS and IGS fr agments
2.3.2 序列分析及同源性结果比较
测序结果表明,r DNA-ITS区目的片段长度为768 bp,其 中 ITS1-5.8S-ITS2 区 序 列 长 度 为477 bp,在Gen Bank中进行BLAST和DNA MAN 6.0比对分析,发现ITS1-5.8S-ITS2区序列与北方根结线虫(AY268108、AY281854和JX024147)序列只有1个碱基差异,序列相似性为99.79%;r DNAIGS区目的片段长度为768 bp,其中IGS2区序列长度为562 bp,与在美国分离获得北方根结线虫HI种群(AY528418)只有2个碱基差异,序列相似性为99.64%。将本研究中获得ITS和IGS序列与Gen-Bank中下载的已知根结线虫序列进行比对分析,用Maxi mu m likelihood法分别构建了系统发育树:图4为基于ITS序列构建的根结线虫系统发育树,花椒根结线虫与北方根结线虫位于同一大分支,支持率为98%,从树的分支状况来看,4种根结线虫可分为两组,第Ⅰ组包括所有的北方根结线虫,第Ⅱ组包括南方根结线虫、花生根结线虫和爪哇根结线虫。组间相隔较远,分支间的支持率大于98%,系统发育关系比较清晰。图5为基于IGS序列构建的根结线虫系统发育树,花椒根结线虫与北方根结线虫位于同一大分支,支持率为98%;与基于ITS序列的系统发育树相对应,常见的4种根结线虫也可分为两组:第Ⅰ组包括所有的北方根结线虫,而其他3种根结线虫全部位于Ⅱ组,组间相隔较远,两个大分支间支持率大于98%,北方根结线虫所在分支与南方根结线虫、花生根结线虫和爪哇根结线虫形成的分支间系统发育关系清晰,说明花椒根结线虫为北方根结线虫。
3 结论与讨论
由于寄主和环境等因素的影响,根结线虫种内和种间的形态常常有较大的变化,因此,单纯依赖一种方法鉴定很难做到快速、准确。应用r DNA-ITS和r RNA-IGS克隆、序列测定分析及比对,已成功地应用于根结线虫的鉴定[11-12]。本文根据花椒根结线虫雌虫和2龄幼虫的形态特征及雌成虫的会阴花纹,雌虫酯酶同工酶分析及分子生物学的检测(r DNA-ITS区和r RNA-IGS区),结果表明四川茂县地区花椒根结线虫的病原为北方根结线虫。在鉴定中,采用形态学、生物化学和分子生物学特征分析进行综合鉴定的方法,从而避免了用一种方法鉴定可能出现的误差。这是首次报道北方根结线虫引起的花椒新病害,同时也是首次报道北方根结线虫在我国四川省的分布。
近些年来的调查发现,花椒根结线虫病的发生在逐步扩展,但因为其危害具有隐蔽性,还未被关注和引起足够重视。茂县位于四川省西北部,阿坝藏族羌族自治州的东南缘,是岷江上游的高山峡谷地带。许多花椒栽植在退耕地及半高山坡上,海拔在1 500~2 000 m,冬冷夏凉、昼夜温差大、7月平均温度20.9℃,低于北方根结线虫分布南限温度(7月份平均温度为26.7℃)[13],因此在这样的生态环境下,北方根结线虫是可以生存的。在以前的报道中,四川省危害植物的根结线虫为常见的南方根结线虫(M.incognita)、爪哇根结线虫(M.j avanica)和花生根结线虫(M.arenaria)等[14],未见北方根结线虫的报道,北方根结线虫是由于苗木运输传进四川,还是原已存在,还有待进一步的研究。
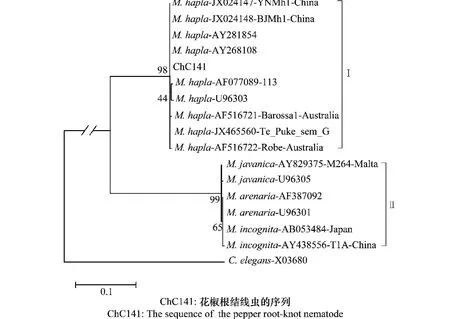
图4 根结线虫不同种群ITS序列的聚类分析(NJ)Fig.4 NJ tree of 16 Meloidogyne isolates based on ITS sequences of M.hapla

图5 根结线虫不同种群IGS序列的聚类分析(Maxi mum likelihood)Fig.5 Maxi mu m likelihood tree of 12 Meloidogyne isolates based on IGS sequences
根据根结线虫病害发生和流行的特点,目前花椒根结线虫病的发生范围仍很有限,建议建立无病种苗生产基地和进行植物检疫,发病区内种苗不得运输或携带到非发病区种植;选用无病地块的健壮、无病种苗;对已感病的苗木实行就地销毁;清除植株病残体及附近杂草,控制该病的扩展蔓延。
[1] 曾京京.我国花椒的栽培起源和地理分布[J].中国农史,2000,19(4):68-75.
[2] 李笃肇.花椒苗根结线虫病的发生与防治[J].特种经济动植物,2004(12):33.
[3] 张炳炎.花椒病虫害诊断与防治原色图谱[M].北京:金盾出版社,2006:1-191.
[4] 汪来发,杨宝君,李传道.华东地区根结线虫的调查[J].林业科学研究,2001,14(5):484-489.
[5] Esbenshade P R,Triantaphyllou H H.Use of enzy me phenotypes for identification of Meloidogyne species(Nematoda:Tylenchida)[J].Jour nal of Nematology,1985,17:6-20.
[6] 胡凯基.酯酶在根结线虫分类上应用的研究[J].林业科学研究,1988(6):650-656.
[7] Vrain T C,Wakarchuk D A,Levesque A C,et al.Intraspecific r DNA restriction frag ment length poly morphism in the Xiphinema a mericanu m gr oup [J].Funda mental and Applied Nematology,1992,15(6):563-573.
[8] Vahidi H,Curran J,Nelson D W,et al.Unusual sequences,ho mologous to 5S RNA,in riboso mal DNA repeats of the ne matode Meloidogyne arenaria[J].Journal of Molecular Evol u-tion,1988,27:222-227.
[9] 艾森拜克J D,赫什曼 H,萨塞J N,等.四种最常见根结线虫分类指南(附图检索)[M].杨宝君译.昆明:云南人民出版社,1986:17-28.
[10]谢辉.植物线虫分类学[M].第2版.北京:高等教育出版社,2005:243-247.
[11]Blok V C,Phillips M S,Far gette M J.Intergenic region of Meloidogyne mayaguensis and other major tropical root-knot nematodes[J].Jour nal of Nematology,1997,29(1):16-22.
[12]万新龙,李健洪,彭德良.根结线虫r DNA-ITS片段的克隆与序列分析[J].华中农业大学学报,2007,05(26):624-628.
[13]泰勒A L,萨塞J N.植物根结线虫[M].杨宝君,曾大鹏,译.北京:科学出版社,1983:67-121.
[14]李笃肇,郑志平,李清泽.四川省植物病原根结线虫种的记述[J].西南农业大学学报,1986(4):19-21.

