不同贮藏温度条件下菜用大豆蔗糖代谢与相关酶活性变化
王 远,宋江峰*,刘春泉3,李大婧3
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2. 江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.南京市(明天)农产品加 工技术研究中心,江苏 南京 210014)
不同贮藏温度条件下菜用大豆蔗糖代谢与相关酶活性变化
王 远1,2,宋江峰2,*,刘春泉2,3,李大婧2,3
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2. 江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.南京市(明天)农产品加 工技术研究中心,江苏 南京 210014)
以‘新大粒1号’菜用大豆为试材,研究不同贮藏温度(1、5、10、20 ℃)条件下菜用大豆蔗糖代谢及相关酶活性的变化情况。结果表明,贮藏期间菜用大豆蔗糖、果糖及葡萄糖含量均呈整体下降趋势,1 ℃有效控制了蔗糖降解;酸性转化酶(AI)活性在第1天达到峰值后逐渐下降,不受贮藏温度影响;20 ℃条件下中性转化酶(NI)活性持续增加,至第4天达到最大值,其他温度组变化差异不显著(P>0.05);蔗糖合成酶(SS)活性略有降低后快速升高,至第4天达到峰值后逐渐下降;蔗糖磷酸合成酶(SPS)活性呈整体下降趋势,与蔗糖含量呈极显著正相关(P<0.01),与果糖含量呈显著正相关(P <0.05),其他酶活性与糖含量之间均无显著相关性(P>0.05)。这表明SPS可能与‘新大粒1号’菜用大豆中蔗糖降解密切相关。
菜用大豆;贮藏温度;蔗糖代谢;蔗糖磷酸合成酶
菜用大豆(Glycine max [L.] Merr.)由于采收时温度较高,极易衰老、黄化和营养耗竭,严重影响其食味品质。甜味作为菜用大豆重要的食味品质指标,主要依赖于蔗糖、葡萄糖和果糖含量以及蔗糖代谢相关酶活性的调控[1]。与蔗糖代谢相关的酶主要包括酸性转化酶(acid invertase,AI)、中性转化酶(neutral invertase,NI)、蔗糖合成酶(sucrose synthase,SS)和蔗糖磷酸合成酶(sucrose phosphate synthase,SPS),其中转化酶主要负
责蔗糖降解,AI在快速生长的组织活性较高,例如根尖和未成熟的茎;NI在贮藏组织中含量较高,但主要存在于细胞质中,常被认为当AI活性较低或蔗糖合成受限时才发挥降解作用[2]。SS和SPS催化蔗糖合成和降解,与果实品质形成和成熟衰老密切相关[3]。果蔬采后蔗糖代谢的研究在西兰花[4]、甘蔗[5]等中都已有报道,其关键调节酶及作用机制差异显著。目前菜用大豆蔗糖代谢的研究主要集中在生长发育阶段,张古文等[6]报道称菜用大豆发育过程中蔗糖含量约为可溶性糖的70%,蔗糖代谢相关酶净活性是调控蔗糖积累的主要因素;Kassinee等[7]认为发育过程中‘Ajigen’品种的AI是调节其蔗糖代谢的关键酶,与蔗糖含量呈显著负相关;而‘Fuuki’品种中SS和SPS对其蔗糖代谢 起关键调节作用,与蔗糖含量均呈显著正相关。针对菜用大豆采后蔗糖代谢的研究鲜有报道。因此,本研究拟考察不同贮藏温度条件下‘新大粒1号’菜用大豆蔗糖代谢及相关酶活性变化规律,以期明确采后蔗糖代谢关键调节酶及其调控机制。
1 材料与方法
1.1 材料与试剂
供试菜用大豆品种为‘新大粒1号’,于2013年10月16日采自江苏省农业科学院六合基地,采收当天运至实验室。(4±1)℃预冷0.5 h,选取大小均一,成熟度基本一致,籽粒饱满,无锈斑、病虫害及机械损伤的豆荚,0.02 mm聚乙烯保鲜袋分装,每袋约500 g,橡皮筋封口。分别置于温度为(1±1)、(5±1)、(10±1)、(20±1)℃,相对湿度为85%~90%恒温恒湿箱中,贮藏7 d。分批取样,进行相关指标测定。
尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)、果糖-6-磷酸(fructose 6-phosphate,6-P-F)(均为生化试剂) 美国Sigma公司。
1.2 仪器与设备
配有1260示差检测器的1200液相色谱仪 美国安捷伦科技有限公司;HPX-160BSH-III恒温恒湿箱 上海沪粤明科学仪器有限公司;AR224CN电子天平 赛多利斯科学仪器(北京)有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;H-2050R冷冻离心机 长沙湘仪离心机有限公司。
1.3 方法
1.3.1 蔗糖、果糖、葡萄糖的提取及含量测定
参照Giannoccaro等[8]的方法,略加改动。取菜用大豆约1 g,液氮研磨后,加5 mL水混匀,50 ℃水浴15 min,4 ℃条件下12 000 r/min离心20 min,取上清液,残渣加水复提,合并上清液加入等体积乙腈,0.45 μm过滤器过滤,用于液相色谱分析。
色谱条件为:C a r b o h y d r a t e色谱柱(150 mm×4.6 mm,5 μm),示差检测器检测,流动相:乙腈-水(75∶25,V/V),流速1.00 mL/min,检测器温度30 ℃,柱温箱温度30 ℃。
糖标准溶液配制:准确称取蔗糖、果糖、葡萄糖各3.0 g(精确到0.000 1 g),转移到100 mL容量瓶,高纯水定容至100 mL,得到30 mg/mL的混标溶液,分别稀释到10、8、6、4、2 mg/mL。进样前经0.45 μm微孔滤膜过滤。每个样品重复3 次。
1.3.2 粗酶提取液制备
参照Nielsen等[9]的方法,略加改动。取菜用大豆约1 g,液氮研磨,加入6 mL预冷提取液混匀,4 ℃条件下12 000 r/min离心20 min,上清液备用。提取液组成为:50 mmol/L 4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)-NaOH(pH 7.5),10 mmol/L MgCl2,1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),2.5 mmol/L二硫苏糖醇(DL-dithiothreitol),10 mmol/L VC,0.1 g/100 mL牛血清白蛋白(bovine serum albumin,BSA),0.5 g/100 mL交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)。
1.3.3 AI和NI活性测定
参照Nielsen等[9]的方法,略加改动。540 nm波长处测定吸光度,转化酶活性单位为μmol/(h·g),以葡萄糖计。
1.3.4 SS和SPS活性测定
参照Giannoccaro等[8]的方法,略加改动。620 nm波长处测定吸光度,合成酶活性单位为μmol/(h·g),以蔗糖计。
1.4 数据处理与分析
采用Excel 2003和SAS V8统计分析软件对实验数据进行显著性检验和相关性分析,所有数值均为3 次重复平均值。
2 结果与分析
2.1 不同贮藏温度条件下菜用大豆主要糖含量变化
由图1可以看出,菜用大豆采后蔗糖、葡萄糖、果糖含量均呈整体下降趋势,但不同贮藏温度对糖含量影响不同。贮藏第1天,蔗糖和果糖含量在20 ℃条件下急剧下降,但1 ℃贮藏明显延缓了其下降趋势;葡萄糖含量下降较快,不同贮藏温度对其无显著影响(P>0.05)。贮藏第4天,各温度条件下蔗糖含量差异显著(P<0.05),随着贮藏温度的升高,蔗糖含量下降。果糖含量在1 ℃条件下显著高于其他贮藏温度组(P<0.05),而葡萄糖的含量随着贮藏温度升高略有增加。贮藏第7天,蔗糖、葡
萄糖和果糖含量均随温度的升高而减少,低温减少了贮藏期间可溶性糖含量的损失,且1 ℃条件下贮藏时大豆的蔗糖含量显著高于其他贮藏温度组(P<0.05),果糖含量在1 ℃与5 ℃组无显著性差异,但显著高于10 ℃和20 ℃组(P<0.05)。
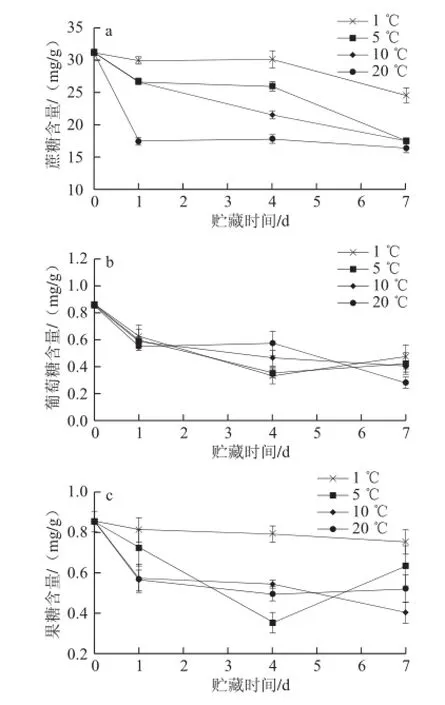
图1 菜用大豆采后蔗糖(a)、葡萄糖(b)、果糖(c)含量的变化Fig.1 Changes in the contents of sucrose (a), glucose (b) and fructose (c) in postharvest vegetable soybean
2.2 不同贮藏温度条件下菜用大豆的酶活性变化
2.2.1 AI活性

图2 菜用大豆采后AI活性的变化Fig.2 Change in acid invertase activity in postharvest vegetable soybean
图2表明,菜用大豆采后AI活性呈先上升后下降趋势,不同贮藏温度对AI活性变化趋势基本无影响。贮藏第1天,AI活性达到峰值,20 ℃条件下AI活性与10 ℃组无显著性差异(P>0.05),但显著高于1 ℃和5 ℃组(P<0.05);随着贮藏时间的延长AI活性逐渐下降,但5 ℃条件下大豆的AI活性下降最为缓慢,且在第7天显著高于其他贮藏温度组(P<0.05)。
2.2.2 NI活性

图3 菜用大豆采后NI活性的变化Fig.3 Change in neutral invertase activity in postharvest vegetable soybean
图3表明,菜用大豆采后NI活性总体表现为先升高后降低再增加的趋势。1、5 ℃和10 ℃条件下NI活性均在贮藏第1天达到峰值,但1 ℃峰值并不明显,而20 ℃条件下NI活性持续增加,在第4天达到最大值,其他温度组NI活性均在第4天出现不同程度的下降,且显著低于20 ℃组(P<0.05)。贮藏至第7天,1、5 ℃和10 ℃条件下NI活性均增加,而20 ℃条件下NI活性降低,但均高于初始值。
2.2.3 SS活性

图4 菜用大豆采后SS活性的变化Fig.4 Change in sucrose synthase activity in postharvest vegetable soybean
图4表明,菜用大豆采后SS活性略有降低后快速升高再减少,不同贮藏温度对SS活性变化趋势基本无影响。但贮藏第1天,20 ℃组显著降低了SS活性(P<0.05);贮藏第4天,SS活性达到峰值,不同温度条件下菜用大豆的SS活性无显著差异(P<0.05);贮藏第7天,SS活性急剧下降,1 ℃条件下SS活性显著高于其他温度组(P<0.05),但相对于初始值SS活性仅略有下降。
2.2.4 SPS活性
图5表明,菜用大豆采后SPS活性呈整体下降趋势,但不同温度条件下SPS活性差异显著。贮藏第1天,10 ℃和20 ℃组SPS活性急剧下降,1 ℃和5 ℃组SPS活性仅略有降低。随着贮藏期的延长,至第4天SPS活性明显随着
贮藏温度的升高而降低,且在第7天,1 ℃组SPS活性与其他温度组差异达到显著性水平(P<0.05),其他贮藏温度条件下均无显著差异(P>0.05)。
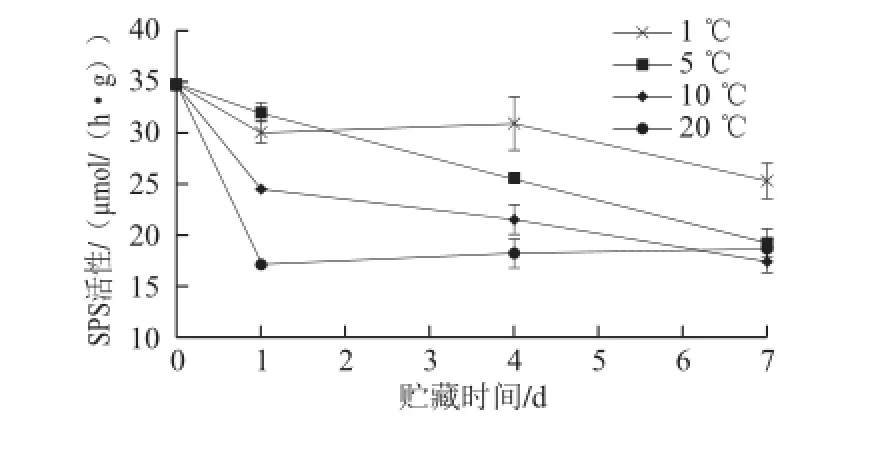
图5 菜用大豆采后SPS活性的变化Fig.5 Change in sucrose phosphate synthase activity in postharvest vegetable soybean
2.3 采后菜用大豆的主要糖含量与酶活性相关性分析
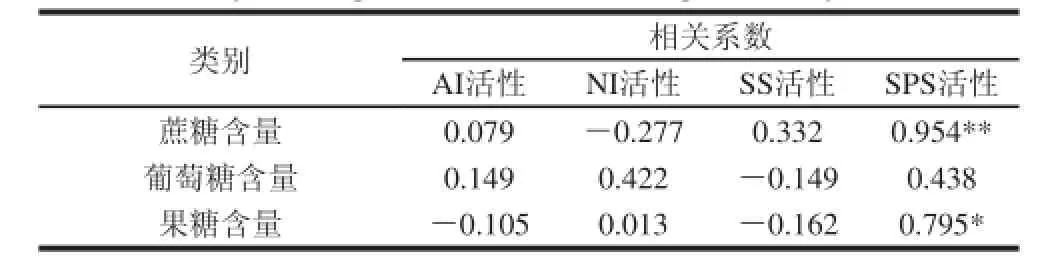
表1 菜用大豆蔗糖代谢相关酶活性与糖含量相关系数Table 1 Correlation coefficient between sucrose-metabolizing enzyme activity and sugar concentration in vegetable soybean
由表1可以看出,菜用大豆采后SPS活性与蔗糖含量呈极显著正相关(P<0.01),与果糖含量呈显著正相关(P<0.05)。其他酶活性与蔗糖、葡萄糖、果糖含量仅有微弱的正或负相关性,且均不显著(P>0.05)。
3 讨 论
蔗糖与之代谢相关的果糖、葡萄糖等糖类物质不仅与菜用大豆甜味品质密切相关,也是其代谢中间物质和风味物质形成的关键[10]。本研究表明,菜用大豆采后蔗糖、果糖和葡萄糖含量均呈整体下降趋势,这与Glew[11]、Sugimoto[12]等研究结果一致。但低温明显延缓了蔗糖含量下降,贮藏末期1 ℃显著减少了蔗糖含量的下降(P<0.05)。5 ℃组与与10、20 ℃无显著差异(P>0.05),说明较低的温度更有利于维持可溶性碳水化合物含量[13-14]。
蔗糖浓度由AI、NI、SS、SPS活性共同决定[15],不同温度条件下蔗糖代谢差异,也体现了温度对酶活性的调节作用。本研究表明,贮藏第1天AI和NI活性显著增加,SS和SPS活性降低,蔗糖含量急剧下降,这与王君等[16]研究结果一致。可能主要用于呼吸作用,转化为有机酸或者代谢中间物质[17]。蔗糖降解有利于葡萄糖、果糖含量增加,更多的己糖用于呼吸作用也进一步促进蔗糖了的降解[18]。本研究中果糖和葡萄糖含量整体均有所下降,可能主要由于其初始量较低,在贮藏过程中进一步通过呼吸作用消耗所致。SS在第4天有明显的活性高峰,可能主要起了催化蔗糖降解的作用,且在缺氧条件下作用更明显[19]。不同温度条件下AI、NI和SS活性差异不显著(P>0.05),且与可溶性糖含量均无显著相关性(P>0.05)。说明它们未对‘新大粒1号’菜用大豆采后蔗糖降解起关键调节作用。有研究[20]报道,菜用大豆‘Huuki’品种的AI与其蔗糖降解密切相关,其活性与蔗糖、果糖、葡萄糖含量均呈显著负相关(P<0.05),可能与品种、贮藏初期可溶性糖浓度[5],非生物因素如水、缺氧等相关[4]。而NI在细胞的分布区域以及其新的生理功能的研究表明,NI在糖类物质卸载或者果实成熟时起才起关键调节作用[21]。SPS活性呈整体下降趋势,这与Batta[22]、Moriguchi[23]等研究结果一致,可能与光反应终止导致蔗糖合成底物减少有关[24]。SPS调节光合产物的分配,较高的活性有利于蔗糖/淀粉比例增加,促进蔗糖积累[25]。菜用大豆贮藏期间低温有效抑制了SPS活性下降,而对其他酶活性并无显著影响。此外,菜用大豆贮藏期SPS活性与蔗糖含量呈极显著正相关(P<0.01)。因此推测SPS可能是‘新大粒1号’菜用大豆采后蔗糖代谢中的关键调节酶,这与苹果[26]、梨[27]等研究一致。SPS活性反映了蔗糖合成的能力,低温有利于延缓贮藏期SPS活性下降或调节其活性增加,保持蔗糖较高的合成速率,减少贮藏期蔗糖含量下降。
4 结4 论
‘新大粒1号’菜用大豆贮藏期间蔗糖、果糖、葡萄糖含量不断下降,但不同温度条件下糖含量差异显著。AI、NI和SS活性受温度调节作用不明显,但1 ℃显著抑制了SPS活性在整个贮藏期的下降,减少了蔗糖降解;且SPS活性与蔗糖含量呈极显著正相关(P<0.01),与果糖含量呈显著正相关(P<0.05),而其他酶活性与糖含量均无显著相关性(P>0.05)。因此,SPS可能在菜用大豆采后蔗糖代谢中起关键调节作用。
[1] SONG J Y, AN G H, KIM C J. Color, texture, nutrient contents, and sensory values of vegetable soybeans [Glycine max(L.) Merrill] as affected by blanching[J]. Food Chemistry, 2003, 83(1): 69-74.
[2] WINTER H, HUBER S C. Regulation of sucrose metabolism in higher plants: localization and regulation of activity of key enzymes[J]. Critical Reviews in Plant Sciences, 2000, 19(1): 31-67.
[3] GROF C P L, ALBERTSON P L, BURSLE J, et al. Sucrose-phosphate synthase, a biochemical marker of high sucrose accumulation in sugarcane[J]. Crop Science, 2007, 47(4): 1530-1539.
[4] PRAMANIK B K, MATSUI T, SUZUKI H, et al. Changes in acid invertase activity and sugar distribution during postharvest senescence in broccoli[J]. Pakistan Journal Biological Sciences, 2004, 7(5): 679-684.
[5] LONTOM W, KOSITTRAKUM M, LINGLE S E. Relationship of acid invertase activities to sugar content in sugarcane internodes during ripening and after harvest[J]. Thai Journal of Agricultural Sciences, 2008, 41(3): 143-151.
[6] 张古文, 胡齐赞, 徐盛春, 等. 菜用大豆籽粒发育过程中蔗糖积累及相关酶活性的研究[J]. 浙江农业学报, 2012, 24(6): 1015-1020.
[7] KASSINEE S, TOSHIYUKI M, TOSHIYUKI M, et al. Changes in carbohydrate content and the activities of acid invertase, sucrose synthase[J]. Asian Journal of Plant Sciences, 2005, 4(6): 684-690.
[8] GIANNOCCARO E, WANG Y J, CHEN P. Effects of solvent, temperature, time, solvent-to-sample ratio, sample size, and defatting on the extraction of soluble sugars in soybean[J]. Journal of Food Science, 2006, 71(1): C59-C64.
[9] NIELSEN T H, SKAERBAEK H C, KARLSEN P. Carbohydrate metabolism during fruit development in sweet pepper (Capsicum annuum) plants[J]. Physiologia Plantarum, 1991, 82(2): 311-319.
[10] 王丹英, 汪自强, 方勇, 等. 菜用大豆食味品质及其与内含物关系研究[J]. 金华职业技术学院学报, 2002, 2(3): 15-17.
[11] GLEW R H, AYAZ F A, SANZ C, et al. Effect of postharvest period on sugars, organic acids and fatty acids composition in commercially sold medlar (Mespilus germanica ‘Dutch’) fruit[J]. European Food Research and Technology, 2003, 216(5): 390-394.
[12] SUGIMOTO M, GOTO H, OTOMO K, et al. Metabolomic profiles and sensory attributes of edamame under various storage duration and temperature conditions[J]. Journal of Agricultural and Food Chemistry, 2010, 58(14): 8418-8425.
[13] WANG K, SHAO X, GONG Y, et al. The metabolism of soluble carbohydrates related to chilling injury in peach fruit exposed to cold stress[J]. Postharvest Biology and Technology, 2013, 86: 53-61.
[14] AGOPIAN D, GHEDINI R, PERONI-OKITA F H G, et al. Low temperature induced changes in activity and protein levels of the enzymes associated to conversion of starch to sucrose in banana fruit[J]. Postharvest Biology and Technology, 2011, 62(2): 133-140.
[15] HATCH M D, GLASZIOU K T. Sugar accumulation cycle in sugar cane. Ⅱ. Relationship of invertase activity to sugar content & growth rate in storage tissue of plants grown in controlled environments[J]. Plant Physiology, 1963, 38(3): 344-348.
[16] 王君, 李磊, 谢冰, 等. 采后黄冠梨果实糖代谢及相关酶活性变化规律[J]. 食品科学, 2010, 31(18): 390-393.
[17] MAO L, LIU W. Study on postharvest physiological changes and storage techniques of sugarcane[J]. Scientia Agricultura Sinica, 2000, 33(5): 41-45.
[18] ZANOR M I, OSORIO S, NUNES N A, et al. RNA interference of LIN5 in tomato confirms its role in controlling Brix content, uncovers the influence of sugars on the levels of fruit hormones, and demonstrates the importance of sucrose cleavage for normal fruit development and fertility[J]. Plant Physiology, 2009, 150(3): 1204-1218.
[19] GEIGENBERGER P. Response of plant metabolism to too little oxygen[J]. Current Opinion in Plant Biology, 2003, 6(3): 247-256.
[20] KASSINEE S, MATSUI T, OKUDA N. Changes in acid invertase activity and sugar distribution during postharvest senescence in vegetable soybean[J]. Asian Journal of Plant Sciences, 2004, 3(4): 433-438.
[21] SZARKA A, HOREMANS N, PASSARELLA S, et al. Demonstration of an intramitochondrial invertase activity and the corresponding sugar transporters of the inner mitochondrial membrane in Jerusalem artichoke (Helianthus tuberosus L.) tubers[J]. Planta, 2008, 228(5): 765-775.
[22] BATTA S K, THIND K S, SINGH P, et al. Variability in activities of sucrose metabolizing enzymes in relation to sucrose accumulation among parents and their progenies of sugarcane[J]. Sugar Tech, 2011, 13(2): 114-122.
[23] MORIGUCHI T, ABE K, TANAKA K, et al. Polyuronides changes in japanese and Chinese pear fruits during ripening on the tree[J]. Journal of the Japanese Society for Horticultural Science, 1998, 67: 375-377.
[24] MAO L, QUE F, WANG G. Sugar metabolism and involvement of enzymes in sugarcane (Saccharum officinarum L.) stems during storage[J]. Food Chemistry, 2006, 98(2): 338-342.
[25] WORRELL A C, BRUNEAU J M, SUMMERFELT K, et al. Expression of a maize sucrose phosphate synthase in tomato alters leaf carbohydrate partitioning[J]. The Plant Cell Online, 1991, 3(10): 1121-1130.
[26] ZHU Z, LIU R, LI B, et al. Characterization of genes encoding key enzymes involved in sugar metabolism of apple fruit in controlled atmosphere storage[J]. Food Chemistry, 2013, 141(4): 3323-3328.
[27] ITAI A, TANAHASHI T. Inhibition of sucrose loss during cold storage in Japanese pear (Pyrus pyrifolia Nakai) by 1-MCP[J]. Postharvest Biology and Technology, 2008, 48(3): 355-363.
Changes of Sucrose Metabolism and Related Enzyme Activities in Vegetable Soybean at Different Storage Temperatures
WANG Yuan1,2, SONG Jiang-feng2,*, LIU Chun-quan2,3, LI Da-jing2,3
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 3. Nanjing (Tomorrow) Engineering Research Center for Agricultural Products Processing, Nanjing 210014, China)
Xindali No. 1 vegetable soybean was used as materials to investigate the changes of sucrose metabolism and related enzyme activities during storage at different temperatures (1, 5, 10, and 20 ℃). Results demonstrated that the contents of sucrose, fructose and glucose in vegetable soybean showed an overall downward trend, while storage at 1 ℃inhibited the degradation of sucrose significantly. The activity of acid invertase (AI) re ached the peak level on the first day, and then decreased gradually. It was not affected by various temperatures. The activity of neutral invertase (NI) increased until the fourth day at 20 ℃, while no significant difference was found among other storage temperature groups (P > 0.05). The activity of sucrose synthase (SS) increased rapidly with a slight decrease at first, and reached the peak level on the fourth day, and then decreased gradually. Furthermore, the activity of sucrose phosphate synthase (SPS) showed a decreasing trend. It had a significantly positive correlation with sucrose content (P < 0.01), and a positive correlation with the content of fructose (P < 0.05). However, no positive correlation was found between other enzymes and sugar content (P > 0.05). Therefore, SPS might play an important role in the sucrose degradation of Xindali No. 1 vegetable soybean.
vegetable soybean; storage temperature; sucrose metabolism; sucrose phosphate synthase (SPS)
TS255.3
A
1002-6630(2014)18-0185-05
10.7506/spkx1002-6630-201418036
2014-01-21
国家自然科学基金青年科学基金项目(31301534);南通市重大科技创新专项(XA2013012)
王远(1989—),男,硕士研究生,研究方向为农产品加工与贮藏。E-mail:wangyuan2013@126.com
*通信作者:宋江峰(1981—),男,助理研究员,博士,研究方向为果蔬采后品质与加工过程控制。
E-mail:songjiangfeng102@163.com

